经前期综合征肝气郁证大鼠血清对海马神经元5-HT1AR信号转导通路的影响Δ
金航,张惠云(山东中医药大学中医药经典理论教育部重点实验室,济南250355)
近年来,经前期综合征(Premenstrual Syndrome,PMS)已成为情志病证研究领域的代表性病种,本课题组的前期研究[1]已证实,41.9%的育龄妇女均有不同程度的PMS。PMS肝气郁证是PMS的主要亚型,是肝疏泄不及的表现,是以经前出现抑郁寡欢等情绪异常,月经来潮后症状自行消失为主要临床表现的病证。现已证实PMS症状的发生与中枢神经系统5-羟色胺(Serotonin,5-HT)能神经异常密切相关[2]。Ho HP等[3]等通过对5-HT受体及其与之相耦联的G蛋白研究认为,PMS的产生可能与5-HT受体及其信号转导异常有关。但目前对与编码控制5-HT合成、释放、重摄取、代谢以及受体活性有关的基因研究较少,如5-羟色胺转运体(Serotonin transporter,SERT)基因、单胺氧化酶(Monoamine oxidase,MAO)基因、5-羟色胺1A受体(Serotonin receptor-1A,5-HT1AR)基因等。
为了进一步探索PMS肝气郁证发病的微观作用机制,本课题组从细胞水平研究PMS肝气郁证大鼠血清对海马原代神经元中5-HT1AR、SERT、MAO-A、MAO-B蛋白和基因表达的影响。
1 仪器与材料
1.1 仪器
高速低温离心机(上海天美科学仪器有限公司);低温冰箱(日本三洋公司);CO2培养箱(上海力新有限公司);倒置显微镜(重庆光电仪器有限公司);Tecan酶标仪(上海麦莎生物科技有限公司);凝胶成像系统、FR-200A全自动紫外-可见分析仪(上海复日科技有限公司);PCR扩增仪(大连宝生物工程有限公司);ks 400图像分析系统(德国Zeiss公司)。
1.2 试药
经前舒颗粒(秦皇岛市山海关制药厂,批号:Z20053087);神经基质、B27、谷氨酰胺(美国Gibico公司);胎牛血清、多聚赖氨酸、MAO-B兔抗(批号:M1821)均购自美国Sigma公司;RNAisoTMPlus、Taq HS(不含 dNTP Mixture)、Rnase 抗化剂、dNTP Mixture、DL2 000 marker、Promega的RT反转录试剂盒(大连宝生物工程有限公司);预染蛋白marker(美国Thermo Fisher Scientific公司);BeyoECL Plus试剂盒(碧云天生物技术研究所);5-HT1AR兔抗(批号:ab44635)、驴抗兔二抗(批号:ab16284)购自英国Abcam公司;驴抗羊二抗(批号:sc-2020)、MAO-A羊抗(批号:sc-18396)均购自美国Santa Cruz公司;SERT兔抗(美国Millipore公司,批号:AB1594P)。

表1 引物序列与RT-PCR反应参数Tab 1 The gene sequences of primers and RT-PCR reaction parameters
1.3 动物与神经元细胞
SPF级健康SD大鼠36只,♀,体重180~220 g;新生SD乳鼠(24 h)5只,均由山东中医药大学实验动物中心提供(动物生产许可证号:SCXK(鲁)20050015)。大鼠海马区神经细胞由山东中医药大学中医药经典理论教育部重点实验室培养。
2 方法
2.1 复制模型与含药血清的制备
筛选处于非接受期的SD大鼠36只,随机均分为正常、模型、经前舒组。根据文献方法[4,5],将模型组和经前舒组大鼠前足与对侧后足用无菌纱布捆缚,妨碍其自由活动,以大鼠稍能活动、取食为度。复制模型同时,经前舒组大鼠给予经前舒颗粒(10 g·kg-1,相当于人临床8倍剂量[6]);正常、模型组大鼠给予相同体积的灭菌饮用水(10 mL·kg-1)。ig给药,每天1次,连续5 d。复制模型、给药完成后即进行宏观行为学观察和旷场实验[7]。
给药完毕断头取血,离心,收集血清,-70℃贮藏。使用前56℃灭活30 min,0.45 μm微孔滤膜过滤。
2.2 大鼠血清中5-HT含量的测定
参照文献[8]加以改进色谱条件。色谱柱:ZORBA×SB-C18(250 mm ×4.6 mm ,5 μm);流动相:甲醇18%(V/V)-乙酸钠(100 mmol·L-1)-柠檬酸(85 mmol·L-1)-正二丁胺(0.4 mmol·L-1)-辛烷基磺酸钠(1.5 mmol·L-1)-乙二胺四乙酸(EDTA,0.2 mmol·L-1),调pH值至3.7;抽滤、脱气;流速:0.9 mL·min-1;进样量:20 μL;柱温:18 ℃;工作电压:0.4 mv;量程:1 μA。
2.3 RNA提取与RT-PCR检测
将培养的新生大鼠海马区神经元细胞分为3组,分别加入正常、模型、经前舒组大鼠血清,继续培养24 h后收集细胞,运用RT-PCR半定量方法检测大鼠海马区神经元细胞中5-HT1AR、SERT、MAO-A、MAO-B的mRNA相对表达量。按照RNAisoTMPlus试剂盒和Promega的RT反转录试剂盒说明进行RNA抽提和反转录。根据目的cDNA序列,用引物设计软件(Primer 3)设计引物,由济南博亚生物工程技术服务有限公司合成。引物序列与RT-PCR反应参数见表1(以β-actin作为内参,按下列公式计算各基因的相对表达丰度:被检测基因表达丰度=被检测基因光密度值/β-actin光密度值;Tm为解链温度)。
2.4 蛋白提取和Western blot法检测
分组消化收获35 mm培养皿对数生长期细胞,PBS洗涤1遍,加入100 μL RIPA(含1 mL PMSF:100∶1)冰浴裂解细胞,提取蛋白。Bradford法测定蛋白浓度,绘制浓度曲线。加入β-actin作为内参,采用SDS-PAGE凝胶电泳分离总蛋白,将蛋白电转移至硝酸纤维素膜上(1 h)。用含5%脱脂奶粉的TBST室温封闭1 h,分别与一抗(1∶200)于4℃孵育过夜,二抗(1∶2 000)室温孵育2 h,BeyoECL Plus A液和B液显色,曝光,对mRNA表达情况进行检测。显色过的NC膜用洗脱液室温洗脱15 min,再用β-actin抗体孵育,ECL化学发光法显色,用KS400图像分析系统进行光密度扫描,以5-HT1AR、MAO-A、MAO-B、SERT基因的蛋白光密度值与对应内参光密度值的比值作为该样品中5-HT1AR、MAO-A、MAO-B、SERT蛋白相对表达量参数,并进行统计分析。
2.5 统计学方法
利用SPSS 16.0统计软件进行单因素方差分析,LSD法检验统计数据,所有数据均用±s表示。P<0.05表示有显著性差异。
3 结果
3.1 大鼠宏观行为学观察及旷场实验评价
与正常组比较,模型组大鼠不活跃,精神萎靡,眼神呆滞,相互扎堆睡觉,对外界刺激不敏感;用电笔刺激,正常组大鼠激惹时常迅速躲开,模型组大鼠亦逃避电笔刺激,但反应迟缓,速度较慢;而经前舒组大鼠变化不明显。
旷场实验中水平得分和垂直得分分别反映动物的兴奋性和动物对环境的适应性,而旷场总分是动物探索行为和兴奋性的总体反映。结果表明,与正常组比较,模型组大鼠水平得分、垂直得分和旷场总分均显著减少(P<0.01),结合宏观行为学观察初步判定模型复制成功;与模型组比较,经前舒组大鼠水平得分、垂直得分和旷场总分均显著增加(P<0.05或P<0.01),初步说明经前舒颗粒可缓解PMS肝气郁证症状。大鼠旷场实验得分见图1。
3.2 大鼠血清中5-HT含量的测定
与正常组比较,模型组5-HT含量降低1/2左右(P<0.01),经前舒组则无显著性差异;与模型组比较,经前舒组5-HT含量显著升高(P<0.01)。大鼠血清中5-HT含量分析比较结果见表2。
3.3 大鼠血清对原代培养大鼠海马神经元SERT、MAO-A、MAO-B、5-HT1AR mRNA表达量的影响
运用RT-PCR半定量方法检测大鼠海马神经元中5-HT1AR、SERT、MAO-A、MAO-B基因mRNA的相对表达量。与加入正常组大鼠血清的神经元细胞比较,模型组大鼠血清的干预能显著影响海马原代神经细胞中相关基因的表达:MAO-A mRNA表达量显著升高(P<0.05),5-HT1AR、SERT mRNA表达量显著降低(P<0.05),可推测海马神经元中MAO-A、SERT、5-HT1AR表达异常可能是导致经前抑郁的重要病因之一。加入经前舒干预大鼠血清能显著改变神经元中相关基因表达水平异常升高或降低的状态。本研究未发现MAO-B基因表达显著增高或降低的现象,说明经前舒颗粒可能是通过调节MAO-A、5-HT1AR、SERT基因表达来发挥作用的。大鼠原代神经元中5-HT1AR、SERT、MAO-A、MAO-B的RT-PCR电泳图见图2;大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比值见表3。
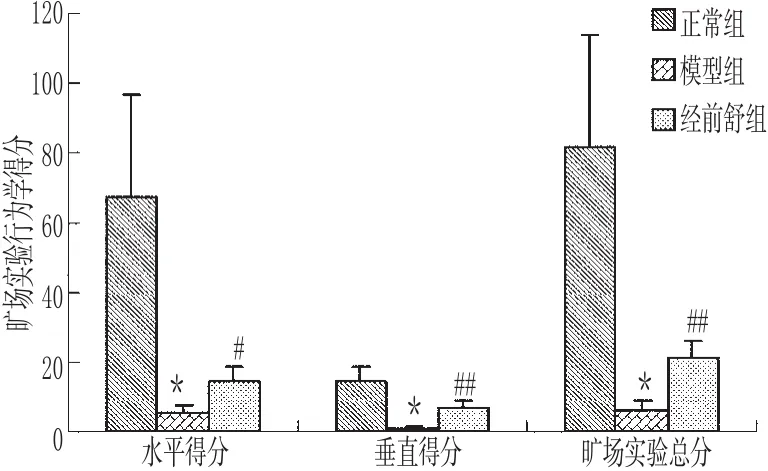
图1 大鼠旷场实验得分与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01 Fig 1 Score of the open field testvs.normal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
表2 大鼠血清中5-HT含量分析比较结果(±s,n=8)Tab 2 Comparison of 5-HT content in rat serum(±s,n=8)

表2 大鼠血清中5-HT含量分析比较结果(±s,n=8)Tab 2 Comparison of 5-HT content in rat serum(±s,n=8)
与正常组比较:*P<0.01;与模型组比较:#P<0.01vs.normal group:*P<0.01;vs.model group:#P<0.01
组别正常组模型组经前舒组5-HT/ng·mL-1 3 109.16±188.86 1 433.77±358.04*2 904.15±292.60#
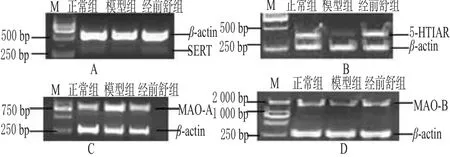
图2 大鼠原代神经元中5-HT1AR、SERT、MAO-A、MAO-B的RT-PCR电泳图A.5-羟色胺转运体;B.5-羟色胺1A受体;C.单胺氧化酶-A;D.单胺氧化酶-B;M.DL2000 makerFig 2 RT-PCR electrophoretogram of 5-HT1AR,SERT and MAO-A,MAO-B in primary cultured neuronA.SERT;B.5-HT1AR;C.MAO-A;D.MAO-B;M.DL2000 marker
3.4 大鼠血清对原代培养大鼠海马神经元SERT、MAO-A、MAO-B、5-HT1AR蛋白表达量的影响
运用Western blot方法检测不同组大鼠血清对大鼠海马神经元中5-HT1AR、SERT、MAO-A、MAO-B蛋白表达量的影响。与正常组比较,模型组大鼠血清的干预能显著影响海马原代神经细胞中相关蛋白的表达:MAO-A蛋白表达量显著升高(P<0.05),而5-HT1AR、SERT 蛋白表达量显著降低(P<0.05);经前舒干预大鼠血清则能显著改变神经元中相关蛋白表达水平异常升高或降低的状态。本研究未发现MAO-B蛋白表达显著增高或降低的现象,说明经前抑郁可能与大鼠海马中MAO-A、5-HT1AR、SERT蛋白表达异常有关,而经前舒颗粒可能是通过调节这几个基因来发挥作用的。Western blot方法分析大鼠原代神经元细胞中5-HT1AR、SERT、MAO-A、MAO-B见图3;大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比见表4。
表3 大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比值(±s,n=3)Tab 3 The optical density ratio of internal reference to 5-HT1AR,SERT,MAO-A,MAO-B in primary hippocampal neurons(±s,n=3)

表3 大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比值(±s,n=3)Tab 3 The optical density ratio of internal reference to 5-HT1AR,SERT,MAO-A,MAO-B in primary hippocampal neurons(±s,n=3)
与正常组比较:*P<0.05;与模型组比较:#P<0.05vs.normal group:*P<0.05;vs.model group:#P<0.05
分组正常组模型组经前舒组SERT 0.523±0.048 0.237±0.033*0.477±0.069#5-HT1AR 0.303±0.042 0.221±0.021*0.305±0.048#MAO-A 0.597±0.153 1.132±0.132*0.509±0.187#MAO-B 0.268±0.041 0.272±0.042 0.261±0.047

图3 Western blot方法分析大鼠原代神经元细胞中5-HT1-AR、SERT、MAO-A、MAO-BA.5-羟色胺1A受体;B.5-羟色胺转运体;C.单胺氧化酶-A;D.单胺氧化酶-BFig 3 Western blot analysis of 5-HT1AR,SERT,MAO-A、MAO-B in primary hippocampal neuronsA.5-HT1AR;B.SERT;C.MAO-A;D.MAO-B
表4 大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比(±s,n=3)Tab 4 The optical density ratio of internal reference to 5-HT1AR,SERT,MAO-A,MAO-B in primary hippocampal neurons(±s,n=3)

表4 大鼠海马原代神经细胞5-HT1AR、SERT、MAO-A、MAO-B与内参光密度比(±s,n=3)Tab 4 The optical density ratio of internal reference to 5-HT1AR,SERT,MAO-A,MAO-B in primary hippocampal neurons(±s,n=3)
与正常组比较:*P<0.05;与模型组比较:#P<0.05vs.normal group:*P<0.05;vs.model group:#P<0.05
分组正常组模型组经前舒组MAO-B 0.315±0.120 0.310±0.108 0.317±0.177 5-HT1AR 0.417±0.060 0.203±0.037*0.405±0.018#SERT 0.232±0.049 0.113±0.010*0.189±0.022#MAO-A 0.377±0.060 0.532±0.040*0.414±0.035#
4 讨论
中医药理论认为,肝脏疏泄功能失常是PMS的重要发病机制,疏泄太过产生肝气逆证;疏泄不及产生肝气郁证。PMS肝气郁证的发病机制目前尚不明确,大多处于假说阶段。
5-HT是中枢神经系统内一种重要的神经递质,普遍认为中枢神经系统内5-HT能神经功能系统发生紊乱可能导致一系列不良情绪,如焦虑、抑郁、恐惧等的发生。5-HT1AR和情感障碍关系最为密切[9]。研究发现,抑郁症患者海马5-HT1AR的结合率下降、mRNA减少[10,11]。有研究发现,当神经冲动引起5-HT释放到突触间隙时,5-HT可被SERT再摄取到突触前的5-HT神经元,重新循环释放或被MAO降解[12]。Ravary A等[13]制备了SERT基因敲除小鼠,发现其5-HT的再摄取减少。另有研究表明,SERT敲除小鼠更容易有焦虑[14]和抑郁情绪[15]。MAO是单胺类神经递质的一种重要代谢酶,分A和B两型(MAO-A、MAO-B)[16]。MAO-A是5-HT合成及代谢的关键酶,与女性抑郁症的发病有关[17]。MAO-B可通过生物激活神经毒素或是升高有害的H2O2的水平来加速大脑的老化[18]。
由本研究结果可以推测,血清中5-HT含量的改变是影响海马神经元中5-HT1AR、SERT、MAO-A、MAO-B蛋白和基因表达的重要原因。根据PMS肝气郁证与4种基因蛋白表达水平的相关性,可以进一步揭示PMS肝气郁证的发病机制。本研究仅就目前研究结果初步推断,PMS肝气郁证可能与5-HT1AR、MAO-A、MAO-B、SERT信号转导通路异常有关,这种异常可能与5-HT含量有关,而经前舒中的某些有效成分或其代谢成分可能通过影响5-HT的含量或直接作用调整5-HT1AR、MAO-A、MAO-B、SERT信号转导通路,从而发挥治疗PMS肝气郁证的作用,但目前其具体作用机制尚不清楚,还需进行进一步研究。
[1]乔明琦,张珍玉,徐旭杰,等.经前期综合征证候分布规律的流行病学调查研究[J].中国中医基础医学杂志,1997,3(3):31.
[2]Milewicz A,Jedrzejuk D.Premenstrual syndrome:From etiology to treatment[J].Maturitas,2006,1(55):47.
[3]Ho HP,Olsson M,Westberg L,et al.The serotonin reuptake inhibitor fluoxetine reduces sex steroid-related aggression in female rats:an animal model of premenstrual irritability?[J].Neuropsychopharmacol,2001,24(5):502.
[4]魏 盛,乔明琦.经前期综合征肝气逆、肝气郁证动物模型改进及肝失疏泄微观机制研究[J].山东中医药大学学报,2007,31(5):404.
[5]Zhang Huiyun,Wei Sheng,Sun Peng,et al.Empirical study of changes of pre-menstrual syndrome model rats with liver-qi invasion and liver-qi depression in peripheral blood,sexual hormones,different encephalic regions and accommodate hormones[J].World Sci Tech,2010,12(1):51.
[6]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:202.
[7]孙世光,李自发,鹿 岩,等.白香丹胶囊对经前期综合征肝气逆证大鼠旷场行为学和原代培养皮层神经元细胞相对活力的影响[J].中国药房,2011,22(3):209.
[8]Imwalle DB,Gustafson JA,Rissman EF.Lack of functional estrogen receptorβ influences anxiety behavior and serotonin content in female mice[J].Physiology Behavior,2005,84(1):157.
[9]Bier P,Ward NM.Is there a role for 5-HT1A agonists in the treatment of depression?[J].Biol Psychiatry,2003,53(3):193.
[10]Arango V,Underwood MD,Boldrini M,et al.Serotonin 1A receptors,serotonin transporter binding and serotonin transporter mRNA expression in the brainstem of depressed suicide victims[J].Neuropsychopharmacol,2001,25(6):892.
[11]Hensler JG.Regulation of 5-HT1A receptor function in brain following agonist or antidepressant administration[J].Life Sci,2003,72(3):1 665.
[12]aan het Rot M,Mathew SJ,charney DS.Neurobiogical mechanisms in major depressive disorder[J].CMAJ,2009,180(3):305.
[13]Ravary A,Muzerelle A,Darmon M,et al.Abnormal trafficking and subcellular localization of an N-terminally truncated serotonin transporter protein[J].Eur J Neurosci,2001,13(7):1 349.
[14]Kalueff AV,Fox MA,Gallagher PS,et al.Hypolocomotion,anxiety and serotonin syndrome-like behavior contribute to the complex phenotype of serotonin transporter knockout mice[J].Genes Brain Behav,2007,6(4):389.
[15]Zhao S,Edwards J,Carroll J,et al.Insertion mutation at the C-terminus of the serotonin transporter disrupts brain serotonin function and emotion-related behaviors in mice[J].Neurosci,2006,140(1):321.
[16]李牧尧.单胺氧化酶缺陷与精神行为异常[J].国外医学遗传学分册,1995,18(2):88.
[17]Preising M,Bellivier F,Fenton BT,et al.Association between bipolar disorder and monoamine oxidase A gene polymorphisms:results of a multicenter study[J].Am J Psychiatry,2000,157(6):948.
[18]侯一平.中枢神经内的单胺氧化酶-I,单胺氧气酶B[J].兰州医学院学报,1996,22(3):67.

