乌头碱在豚鼠和小鼠肝微粒体细胞色素氧化酶中的代谢作用研究
谢利霞,吕 昌,叶 玲,唐 斓(1.广东医学院附属南山医院药剂科,广东深圳 51805;.南方医科大学药学院,广州 510515)
乌头碱(Aconitine,AC)具有祛寒、止痛等功效,为中医和民间常用中草药。其毒性成分主要损害神经和心血管系统,表现为各种类型的心律失常[1]。目前国内、外学者已对AC类物质的毒性机制进行了有益探索,如Murayama M等[2]探索了AC类物质的抗炎作用和毒性大小,Xiao K等[3]研究了AC体外对受孕大鼠的胎盘毒性,结果均显示AC有直接的毒性作用。笔者采用小鼠醋酸扭体法和毒性评价实验测定得单体AC的安全范围是0.068 79~0.087 08 mg·kg-1(ED95~LD5),安全范围相当窄。这种高毒性和狭窄的治疗范围与AC在体内的代谢相关。研究表明,AC可被人体重要的Ⅰ相药物代谢酶系统——细胞色素P450氧化酶(CYP450)系所代谢,生成毒性和药理活性改变的多个代谢产物,参与体内作用[4~6]。但目前仅对AC的代谢转化途径和代谢产物在大鼠和人的尿液及肝微粒体中进行过研究,药物与CYP450的相互作用是药物产生治疗作用和(或)毒性反应的关键因素。笔者选择豚鼠和小鼠肝微粒体在体外研究AC在不同种属中的代谢特征,并采用超高效液相色谱-多级质谱(UPLC-MS/MS)法测定AC在2个种属肝微粒体孵育样品中的代谢产物,分析比较AC代谢转化途径和产物生成的种属差异,以期为AC的临床应用提供理论依据。
1 仪器与材料
1.1 仪器
Waters Micromass高分辨质谱(HRMS)仪、AcquityTM高效液相色谱(HPLC)仪(美国Waters公司);恒温水浴箱(上海福码实验设备有限公司);超纯水制备系统(美国Millpore公司);NI-2RC涡旋仪(美国热电仪器公司);5423高速离心机、移液枪(德国Eppendorf公司)。
1.2 试药
AC(美国LC Laboratories)公司;双嘧达莫(美国Sigma Aldrich公司);小鼠和豚鼠肝微粒体、烟酰胺腺嘌呤二核苷酸磷酸氯化镁溶液(NADP,glucose-6-phosphate and magnesium chlo-ride,以下简称溶液A)、6-磷酸葡萄糖脱氢酶枸橼酸钠溶液(glucose-6-phosphate dehydrogenase in sodium citrate,以下简称溶液B)均购于美国BD公司。
2 方法与结果
2.1 AC供试品母液的制备
精密称取AC 12.93 mg,置于1.5 mL离心管中,精密吸取200µL二甲基亚砜(DMSO)加入离心管,超声溶解后精密吸取乙腈800µL加入离心管,涡旋混匀。即制备20 mmol·L-1的AC供试品母液,于-20℃贮藏,备用。
2.2 AC在体外肝微粒体Ⅰ相代谢体系的建立
(1)肝微粒体酶(20µL,10 mg·mL-1)的终浓度控制在约0.4 mg·mL-1,反应体系加入溶液A 50 µL和溶液B 10 µL,整个体系在50 mmol·L-1的PBS溶液中(pH 7.4)。(2)上述混合物置于37℃水浴培养5 min后加入AC供试品母液(20µL,终浓度控制在10µmol·L-1,DMSO终浓度为0.2%),混合均匀;上述混合物(整个体系总体积约为1 000µL)置于37℃水浴培养至30~120 min。(3)将反应系统移入冰浴终止反应,加入50 µmol·L-1双嘧达莫(100%乙腈溶解)50 μL为内标,加入二氯甲烷4 mL,涡旋30 s,样品离心(3 500 r·min-1)15 min,取出上清液即蛋白层后将二氯甲烷层转移到另一干净玻璃管中以氮气吹干,加入水-乙腈(1∶1)110 μL复溶后离心(13 000 r·min-1)15 min,取上清液供UPLC-MS/MS和HPLC-HRMS分析用。
2.3 UPLC-MS/MS和HPLC-HRMS法鉴定ACⅠ相代谢产物方法
2.3.1 UPLC-MS/MS鉴定ACⅠ相代谢产物方法 (1)UPLC条件:流动相A为0.05%醋酸铵水溶液,流动相B为乙腈溶液(梯度洗脱:0~12 min,90%A~55%A;12~22 min,35%A;22~26 min,0%A;26~30 min,0%A;30~30.1 min,90%A;30~33 min,90%A),流速为0.35 mL·min-1,柱温为常温。(2)MS条件:离子源为ESI+,毛细管电压为3.0 kV,锥孔电压为35 V,离子源温度为110℃,干燥气(氮气)温度为500℃。
2.3.2 HPLC-HRMS法鉴定ACⅠ相代谢产物方法 (1)HPLC条件:流动相A为0.05%醋酸铵水溶液,流动相B为乙腈溶液(梯度洗脱:0~12 min,90%A~55%A;12~22 min,35%A;22~26 min,0%A;26~30 min,0%A;30~30.1 min,90%A;30~33 min,90%A),流速为0.35 mL·min-1,柱温为常温。(2)HRMS条件:离子源为ESI,正离子全扫描方式;毛细管电压为4 500 V,雾化气压为1.5 bar(1 bar=0.1 MPa),干燥气温度为200 ℃,氮气流速为8.0 mL·min-1。
2.4 AC在肝微粒体中代谢物的结构鉴定
2.4.1 AC的裂解规律 AC结构中有3个羟基,分别在C3、C13和C15位;有4个甲氧基,分别在C1、C6、C16和C18位,C8位取代基为乙酰氧基,C14位取代基为苯甲酰氧基。N上连接的基团为乙基。这些基团都处在AC空间结构的外围,在电离的过程中容易失去而产生相应的碎片离子。在选定的MSn条件下对AC进行多级串联质谱分析。
[M+H-60]+离子为基峰离子(m/z586),经研究证实,AC结构中C8的乙酰氧基是这个离子产生的结构基础。电离过程中,C8的乙酰氧基和邻近碳上的氢结合,形成一分子乙酸,AC准分子离子丢失质量数为60 Da的乙酸中性碎片后产生了[M+H-60]+离子。Li R等[6]报道,[M+H-60]+(m/z586)、[M+H-60-32-28]+(m/z526)、[M+H-60-32×3-122]+(m/z368)均为AC的诊断离子。图1也显示,这3种诊断离子为AC特有的裂解离子。这将对其代谢产物的鉴定提供依据。
2.4.2 代谢物的结构鉴定 AC在豚鼠和小鼠体外肝微粒体中进行Ⅰ相代谢酶孵育后,利用UPLC-MS/MS和HPLCHRMS方法,发现并确证多个代谢产物,结果都相同。
2.4.3 分子量为MW-14的代谢产物:aMD14([M+H]+m/z632)
AC在肝微粒体中孵育后的UPLC-MS/MS联用总离子流图的基础上,经过提取得到2个m/z632的提取离子流图。通过高分辨质谱确定他们的元素组成,发现其分子式为C33H46NO11(表1中M1、M2),所以认为其是同分异构体。以UPLC-MS/MS对各个组分进行MS2研究,同时参考原型药物的裂解规律,对2个代谢产物物的结构进行了初步推断。2个代谢产物m/z632的二级质谱均含有主要的碎片信息m/z572(图1中B2、C2),比AC相应的碎片离子m/z586低14个质量单位,表明这2个化合物与AC具有相同的碎片的断裂方式,证明二萜的化学骨架结构是完整的。在前文总结的裂解规律中提到,对AC进行串联,可以发现MS2谱中基峰离子为m/z586,为丢失乙酸后生成的[M+H-60]+离子。选择该离子进行串联,会产生m/z368的离子[M+H-60-(32×3)-122]+。笔者认为[M+H-60]+离子进一步裂解,先后脱去C1、C6、C16位甲氧基和C14位的苯甲酰氧基,最终形成m/z368的离子。aMD14类代谢产物均比原型药物少14Da,AC类物质在体内生物转化过程中较容易发生甲氧基的去甲基化反应。所以,笔者认为这2个化合物为去甲基化产物。如果是C1、C6或C16位发生了去甲基化反应生成了羟基,由于在裂解的过程中,这些基团会以水的形式脱去,所以形成的仍然还是m/z368的离子;如果丢失亚甲基的不是上述位置,则发生了改变的基团被保留到最后,最终形成的特征离子的m/z应该是354(368-14)。根据这个规律,笔者初步分析去甲基化反应发生的位置在C1、C6或C16位。研究结果显示,M2的相对丰度高于M1,考虑电子效应和空间位阻及参照拉巴乌头碱的代谢规律[7],16位甲氧基最易脱掉甲基,因此具有较高丰度且保留时间为2.35 min的M2被鉴定为16-O-去甲基乌头碱。由于除16位外1、2、18位均含甲氧基且都有可能发生脱甲基反应,故不能确定脱甲基的具体位置。M1鉴定为O-去甲基乌头碱。质谱见图1。
2.4.4 分子量为MW-28的代谢产物:aMD28([M+H]+,m/z618) 肝微粒体孵育体系中一共发现2个m/z618的色谱峰。通过高分辨质谱确定他们的元素组成,发现它们的分子式均为C32H44NO11(表1中M3、M4),认为它们是同分异构体。aMD 28类代谢产物均比原型药物少28Da,AC类物质在体内生物转化过程中较容易发生甲氧基的去甲基化反应及N上的去乙基化反应。参考原型药物的裂解规律,对2个代谢产物的结构进行初步推断,认为这2个化合物中一个去掉2个甲基,另一个N位脱掉1个乙基。保留时间为0.96 min的M3有诊断离子m/z558和m/z498,m/z498推测为m/z558脱掉一分子甲氧基(-OCH3)和1分子乙基(-C2H5),只有N上接-C2H5的化合物才可在电子轰击中脱去此碎片,因此M3为N位脱乙基产物,而另一化合物M4则为脱2个甲基的代谢物。质谱见图1。
2.4.5 分子量为MW-2的代谢产物:aMD2([M+H]+m/z644)肝微粒体孵育体系中发现1个m/z644的色谱峰。通过高分辨质谱确定它们的元素组成,发现其元素组成为C34H46NO11(表1中M5),aMD2代谢产物比原型药物少2Da,所以认为此代谢物为AC的脱氢化产物。对各个组分进行MS2研究,记录各个组分的裂解规律,比较它们之间的相同点和不同点,同时参考原型药物的裂解规律,对次代谢产物的结构进行初步推断。aMD2的MS2图出现了典型的诊断离子m/z586,m/z552以及m/z524,则在C15位不可能出现脱氢现象,故代谢产物应为3位脱氢产物。质谱见图2。
2.4.6 分子量为MW+16的代谢产物:aMD16([M+H]+m/z662) 肝微粒体孵育体系中发现2个m/z662的色谱峰。通过高分辨质谱确定它们的元素组成,发现其中一个的元素组成为C34H48NO12(表1中M6),其余为杂质,aMp16代谢产物比原型药物多16 Da,所以认为此代谢物为AC的羟化产物。
2.4.7 分子量为MW-16的代谢产物:aMD16([M+H]+m/z630) 微粒体孵育体系中发现1个m/z630的色谱峰。通过高分辨质谱确定元素组成为C34H48NO10(表1中M7),aMp16代谢产物比原型药物少16 Da,所以认为此代谢物为AC的脱氧产物。对其进行MS2研究,记录其裂解规律,同时参考原型药物的裂解规律,对此代谢产物的结构进行初步推断。MS2图谱中显示了典型的诊断离子m/z510。推测其为3位脱氧产物。
2.4.8 分子量为MW-42的代谢产物:aMD42([M+H]+m/z604) 肝微粒体孵育体系中发现2个m/z604的色谱峰。对其进行多级质谱串联,在MS2图中未发现[M+H-60]+离子,AC的裂解规律指出,[M+H-60]+离子是由C8位基团脱去所产生的,所以代谢产物结构中AC有的C8位基团一定发生了改变。AC在水中很不稳定,C8位酰键极易发生水解,其水解产物为14-苯甲酰乌头胺(也称8-去乙酰乌头碱),产物与AC相差42 Da,笔者推断aMD42为AC的水解产物:14-苯甲酰乌头胺(表1中M8)。质谱见图2。

表1 乌头碱在豚鼠和小鼠肝微粒体中代谢产物Tab 1 Metabolites of aconitine in liver microsomes of guinea pig and mice

A1.AC 的MS图;A2.AC[M+H]+(m/z 646)的MS2图;B1.M1的MS图;B2.M1[M+H]+(m/z 632)的 MS2图;C1.M2的MS图;C2.M2[M+H]+(m/z 632)的MS2图;D1.M3的MS图;D2.M3[M+H]+(m/z 618)的MS2图;E1.M4的MS图;E2.M4[M+H]+(m/z 618)的MS2图Fig 1 Mass chromatogramsA1.MS chromatograms of AC;A2.MS2[M+H]+(m/z 646)of AC;B1.MS chromatograms of M1;B2.MS2[M+H]+(m/z 632)of M1;C1.MS chromatograms of M2;C2.MS2[M+H]+(m/z 632)of M2;D1.MS chromatograms of M3;D2.MS2[M+H]+(m/z 618)of M3;E1.MS chromatograms of M4;E2.MS2[M+H]+(m/z 618)of M4
2.5 代谢物小结
由“2.4”项下分析可知,AC在小鼠和豚鼠肝微粒体中的代谢产物一致,都检测到了8种代谢产物,其中有2个脱甲基产物(M1、M2),1个脱双甲基产物(M3),1个脱乙基产物(M4),1个脱氢产物(M5),1个羟化产物(M6),1个脱氧产物(M7)和1个水解产物(M8)。从结构上看,其代谢规律以水解、脱甲基、羟化、脱氢代谢为主,而CYP参与了其中最重要的脱甲基、羟化、脱氢代谢(M1~M6)。AC在豚鼠和小鼠肝微粒体中代谢产物见表1;AC在豚鼠和小鼠肝微粒体中可能的代谢途径见图3。
3 讨论
研究结果表明,在小鼠和豚鼠肝微粒体代谢系统中AC至少产生了8个代谢产物(M1~M8)。其中M1~M6为CYP异构体参与代谢产生的代谢物,并且O-脱甲基、N-脱乙基、脱氢和加氧反应为最主要的CYP代谢途径。将这些代谢物的结构与AC比较,显示仅在其侧链发生了变化,表明这些代谢产物可能仍具有药理活性。构效关系研究显示,AC的高毒性与以下官能团有关:C8位的乙酰氧基,C13位的羟基,C1、C6、C16、C18位的4个甲氧基以及C24位的苯氧基酯[8]。代谢物M8为C8位乙酰氧基水解的衍生物,其毒性比AC低得多。代谢物M9、M10和M11也同样去掉了一些使AC毒性增强的官能团,提示经微粒体代谢产生的代谢产物可能仍具有药理活性,但毒性会降低。当C8位和C14位上的基团发生水解形成单酯结构后化合物的毒性会降低,同时其镇痛和抗心律不齐的药理作用会显著增强[7],因此AC经C8位水解形成的单酯结构代谢物M8,与AC相比,药理作用会增强且毒性会降低。上述结果有助于乌头属生物碱的中毒和解毒的相关研究。
此外,AC在体外小鼠和豚鼠肝微粒体中的主要Ⅰ相代谢途径相同,结合文献报道,AC在大鼠肝微粒体中产生的主要CYP代谢产物与笔者的研究一致,O-脱甲基、N-脱乙基和脱氢反应为最主要的CYP代谢途径[4]。在人的肝微粒体和尿液中也发现一致的代谢产物[8],说明由于药物代谢途径的不同,产物对AC药效或安全性的影响不同而导致的种属差异的风险相对较小。

图2 质谱图A1.M5的MS图;A2.M5[M+H]+(m/z 662)的MS2图;B1.M6的MS图;B2.M6[M+H]+(m/z 644)的MS2图;C1.M7的MS图;C2.M7[M+H]+(m/z 630)的MS2图;D1.M8的MS图;D2.M8[M+H]+(m/z 604)的MS2图Fig 2 Mass chromatogramsA1.MS chromatograms of M5;B1.MS2[M+H]+(m/z 662)of M5;B1.MS chromatograms of M6;B2.MS2[M+H]+(m/z 644)of M6;C1.MS chromatograms of M7;C2.MS2[M+H]+(m/z 630)of M7;D1.MS chromatograms of M8;D2.MS2[M+H]+(m/z 604)of M8
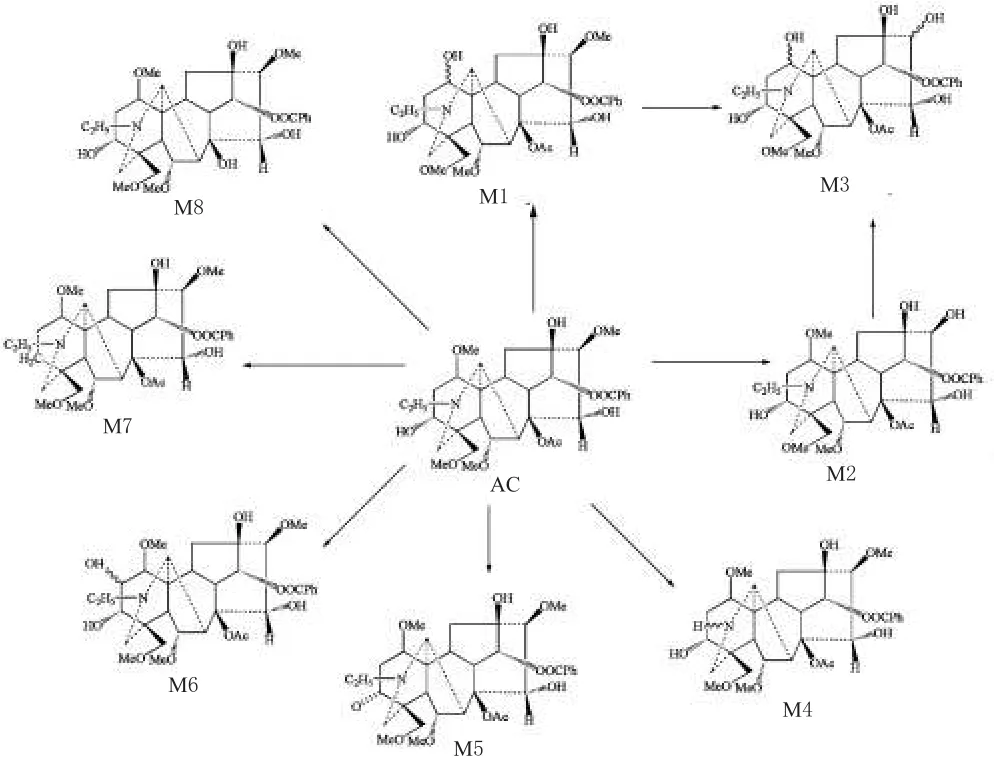
图3 AC在豚鼠和小鼠肝微粒体中可能的代谢途径Fig 3 Proposed metabolic pathways of AC in liver microsomes of mice and guinea pig
[1]吕桂玲,张一民,宋兴芳,等.653例含乌头碱类药物致不良反应文献分析[J].中国药房,2007,18(5):374.
[2]Murayama M,Mori T,Bando H,et al.Studies on the constituents of Aconitum species.Ⅸ.The pharmacological properties of pyro-type aconitine alkaloids,components of processed aconite powder'kako-bushi-matsu':analgesic,antiinflammatory and acute toxic activities[J].J Ethnopharmacol,1991,35(2):159.
[3]Xiao K,Wang L,Liu Y,et al.Study of aconitine toxicity in rat embryos in vitro[J].Birth Defects Res B Dev Reprod Toxicol,2007,80(3):208.
[4]Wang Y,Wang S,Liu Y,et al.Characterization of metabolites and cytochrome P450 isoforms involved in the microsomal metabolism of aconitine[J].J Chromatogr B Analyt Technol Biomed Life Sci,2006,844(2):292.
[5]Tang L,Ye L,Lu C,et al.Involvement of CYP3A4/5 and CYP2D6 in the metabolism of aconitine using human liver microsomes and recombinant CYP450 enzymes[J].Toxicol Lett,2011,202(1):47.
[6]Li R,Wu Z,Zhang F,et al.Differentiation of three pairs of aconite alkaloid isomers from aconitum nagarum var.lasiandrum by electrospray ionization tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(2):157.
[7]孙 莹,张宏桂,史向国,等.兔体内乌头碱代谢产物研究[J].药学学报,2002,37(10):781.
[8]Ameri A.The effects of aconitum alkaloids on the central nervous system[J].Prog Neurobiol,1998,56(2):211.

