大黄素固体脂质纳米粒在小鼠体内的组织分布研究
张 洪,闫士君,张福明(武汉大学人民医院药学部,武汉 430060)
大黄素(EMO)是我国传统中药大黄的主要有效成分,其化学名为1,3,8-三羟基-6甲基蒽醌(1,3,6-trihydroxy-6methy lanthraquinone),分子量为270.23。目前国内、外很多学者对其作了深入研究,发现具有广泛的药理作用,不仅具有抗炎、调节脂代谢、保护肝肾功能,而且对肝癌、肺癌、乳腺癌、结肠癌等多种恶性肿瘤具有明显的抑制作用[1,2]。
固体脂质纳米粒(Solid lipid nanoparticles,SLN)是20世纪末期兴起的一种新型纳米载药系统,不仅具备物理稳定性高、良好靶向性和能增加药物稳定性的优点,还具有脂质体毒性低、可大规模生产的优势[3,4],近年来已成为药剂学科中的研究热点。笔者采用实验室制备好的大黄素固体脂质纳米粒(EMO-SLN),通过iv给药,研究其在小鼠体内的组织分布特点,进行EMO-SLN的靶向性探讨,为其临床应用提供理论依据。
1 仪器与材料
1.1 仪器
P680型分析型高效液相色谱(HPLC)仪(美国戴安公司);XW-80型涡旋混合器(上海医科大学仪器厂);3K30型冷冻高速离心机(美国Sigma公司);BF2000型水浴氮气挥干仪(北京八方实验仪器有限公司);AG245型电子天平(德国Mettler Toledo公司);玻璃匀浆器(武汉凯博仪器公司)。
1.2 试药
EMO原料药(宝鸡市方晟生物开发有限公司,批号:080726);EMO对照品(中国食品药品检定研究院,批号:0753-8902);EMO-SLN(武汉大学人民医院药学部自制);肝素钠注射液(天津市生物化学制药厂);其余试剂均为分析纯。
1.3 动物
SPF级昆明种小鼠132只,♀♂兼半,体重(200±20)g,由武汉大学人民医院实验动物中心提供(动物生产许可证号:SYXK(鄂)2004-002)。
2 方法与结果
2.1 对照品溶液的制备
精密称取EMO对照品3 mg,用甲醇定容至100 mL,配成浓度为30 μg·mL-1的溶液,从中精密量取1、2、5、10 mL,分别置于100 mL容量瓶中,精密量取此溶液2、5 mL,分别置于10 mL容量瓶中,加甲醇稀释至刻度,配成浓度分别为0.3、0.6、1.5、3.0、6.0、15.0 μg·mL-1的系列对照品溶液。
2.2 生物样品的采集和处理
取健康小鼠60只,随机分成2组,实验前禁食12 h,分别iv EMO对照品溶液和EMO-SLN混悬(剂量均为10 mg·kg-1),于给药后0.083、0.250、0.500、1.000、2.000、6.000 h脱臼处死小鼠,取小鼠心、肝、脾、肺、肾各组织样品,用生理盐水冲净表面血液和内容物后,精密称定,加入2倍量的生理盐水研磨成匀浆。精密量取血浆或匀浆100 μL,置于5 mL的离心管中,加入30%H2SO4100 μL,涡旋混合30 s,70 ℃水浴30 min,水解30 min,冷却至室温。加入乙醚1 mL,涡旋混合提取3 min,3 000 r·min-1离心5 min,转移上清液至5 mL离心管中。下层水相依法用乙醚萃取1次,合并乙醚液,于40℃氮气下吹干,残余物用100 μL 甲醇溶解,涡旋混合 3 min,12 000 r·min-1离心 10 min,取上清液20 μL进样,记录色谱图和峰面积。
2.3 EMO小鼠体内分析方法的建立
2.3.1 色谱条件[5]色谱柱:ASM-Kromasil-C18(150 mm×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸(90∶10);流速:1.0 mL·min-1;检测波长:254 nm;进样量:20 μL;柱温:40 ℃。
2.3.2 方法的专属性试验 取空白血浆和组织匀浆给药后收集的血浆和匀浆样品,按“2.2”项下方法操作,照上述色谱条件进样20 μL,测定。结果表明,在选定的条件下,EMO与内源性物质分离良好,且在样品处理过程中未引入干扰性物质,方法的专属性良好。小鼠组织匀浆样品的HPLC见图1。
2.3.3 标准曲线的制备 取空白血浆或空白组织匀浆100 μL,置于5 mL离心管中,加系列对照品溶液使之成为相当于血浆或组织匀浆浓度0.3、0.6、1.5、3.0、6.0、15.0 μg·mL-1的样品,按照“2.2”项下方法操作。以待测物浓度(c)为横坐标,对照品峰面积积分值(A)为纵坐标,进行线性回归,得血浆和各组织匀浆的回归方程。结果表明,EMO检测浓度在0.3~15.0 μg·mL-1范围内与峰面积积分值呈良好线性关系。EMO在小鼠组织匀浆和血浆中的回归方程见表1。
2.3.4 精密度试验 分别取空白血浆和组织匀浆100 μL,加入不同浓度EMO对照品溶液,涡旋混合3 min,制成高、中、低浓度EMO血浆样品,各浓度制备3个样本,按“2.2”项下方法操作,日内和日间精密度试验各重复5次,计算精密度。结果,日内、日间精密度的RSD均<15%,符合生物样品分析要求。精密度试验结果见表2。
2.3.5 方法回收率试验 精密吸取适量3种浓度的EMO对照品溶液,加到100 μL空白血浆和组织匀浆中,涡旋混合3 min,制成高、中、低浓度生物样品,每一浓度分别制备3个样本。按“2.2”项下方法操作,记录峰面积,将其代入回归方程计算测得的浓度,以测得浓度与实际加入浓度之比计算方法回收率,结果见表3。
2.3.6 提取回收率试验 精密吸取适量的3种浓度的EMO对照品溶液适量,加到100 μL空白血浆和组织匀浆中,涡旋混合3 min,制成高、中、低浓度的血浆样品,每一浓度分别制备3个样本。按“2.2”项下方法操作,记录样品峰面积,将样品峰面积与空白峰面积相除即得提取回收率,结果见表4。
由表3、表4可知,RSD均<15%,方法重现性较好。说明所采用的分析方法符合生物样品分析要求,可用于提取小鼠组织和血浆样品中EMO。
2.4 实验方案
2.4.1 小鼠体内组织分布实验 将72只昆明种小鼠随机分成对照组与制剂组,每组再分成6个时间点,每个时间点6只。以用EMO对照品溶液的一组作为对照组,用EMO-SLN混悬液为制剂组。禁食12 h后,尾iv给药,剂量为10 mg·kg-1。分别于给药后0.083、0.250、0.500、1.000、2.000、6.000 h摘眼球取血,加肝素抗凝,4 000 r·min-1离心10 min分离血浆,然后将小鼠颈椎脱臼处死,迅速取出心、肝、脾、肺、肾,用生理盐水洗净各组织表面的残血,并用滤纸将水分吸干,于-20℃下贮藏,待用[6]。
取100 μL小鼠组织匀浆和血浆,按“2.2”项下方法操作,测定不同时间点尾ivEMO对照品溶液和EMO-SLN混悬液后,小鼠血浆和各组织中的EMO浓度。小鼠尾iv EMO对照品溶液和EMO-SLN混悬液后的药物浓度比较见表5(表中a为EMO对照品溶液;b为EMO-SLN混悬液)。
2.4.2 小鼠体内单点浓度的横向比较 为了直观地比较小鼠尾iv EMO对照品溶液和EMO-SLN混悬液后EMO在不同组织中的分布情况,以尾iv 0.250 h后为例绘制小鼠各组织中EMO平均浓度直方图。小鼠尾iv EMO对照品溶液和EMOSLN混悬液0.25 h的组织分布见图2。
由图2可知,小鼠iv EMO-SLN混悬液和EMO对照品溶液后,药物在肝脏中的浓度最高,其次是血浆、肺和心,而在脾、肾中浓度最低。为进一步说明EMO-SLN混悬液对EMO在小鼠体内分布的改变特征,笔者还对实验所得数据进行了定量处理,利用3p97软件对数据进行拟和,通过软件得出各组织的AUC。
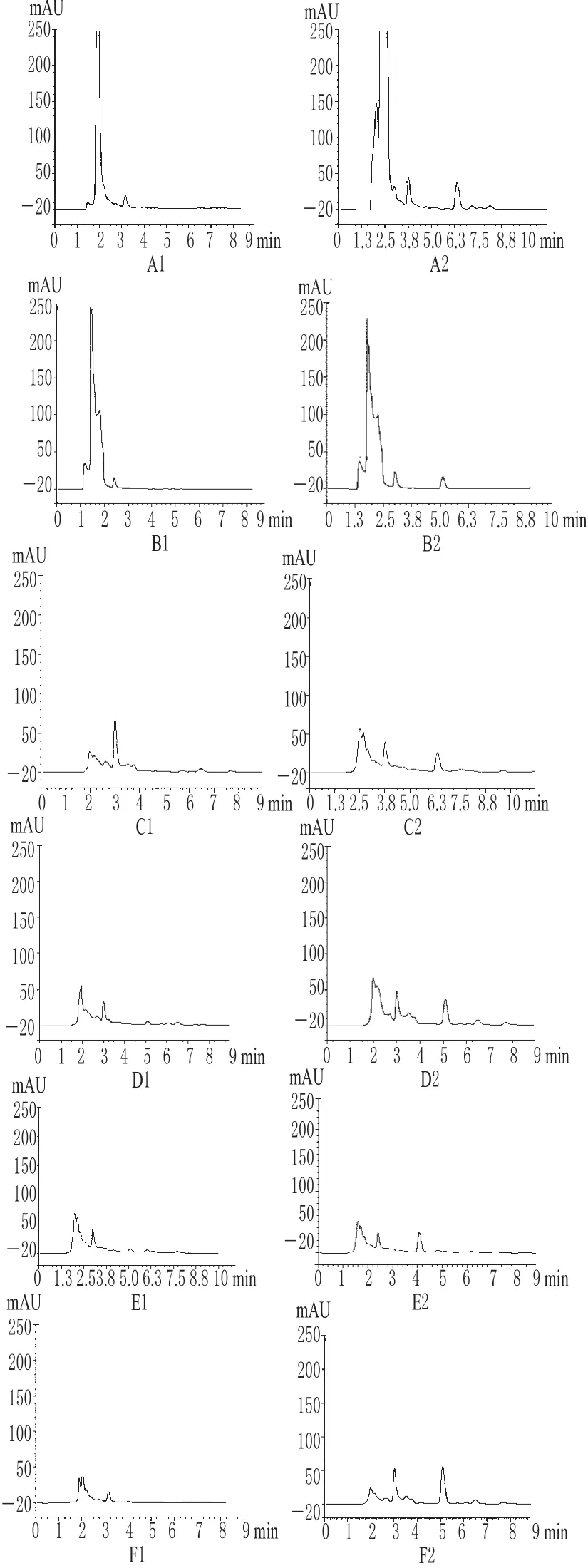
图1 小鼠组织匀浆样品的HPLC图A1.心空白匀浆;A2.注射EMO-SLN后心匀浆样品;B1.肝空白匀浆;B2.注射EMO-SLN后肝匀浆样品;C1.脾空白匀浆;C2.注射EMO-SLN后脾匀浆样品;D1.肺空白匀浆;D2.注射EMO-SLN后肺匀浆样品;E1.肾空白匀浆;E2.注射EMO-SLN后肾匀浆样品;F1.空白血浆;F2.注射EMO-SLN后血浆样品Fig 1 HPLC chromatograms of EMO in homogenate sample of mouse tissnesA1.heart blank homogenate;A2.heart homogenate sample after EMOSLN injection;B1.liver blank homogenate;B2.liver homogenate sample after EMO-SLN injection;C1.spleen blank homogenate;C2.spleen homogenate sample after EMO-SLN injection;D1.lung blank homogenate;D2.lung homogenate sample after EMO-SLN injection;E1.kidney blank homogenate;E2.kidney homogenate sample after EMO-SLN injection;F1.blank plasma;F2.plasma sample after EMO-SLN injection

表1 EMO在小鼠组织匀浆和血浆中的回归方程Tab 1 Regression equation of EMO in different mouse tissue homogenates and plasma

表2 精密度试验结果(n=3)Tab 2Results of precision test(n=3)

表3 方法回收率试验结果Tab 3 Results of methodology recovery test
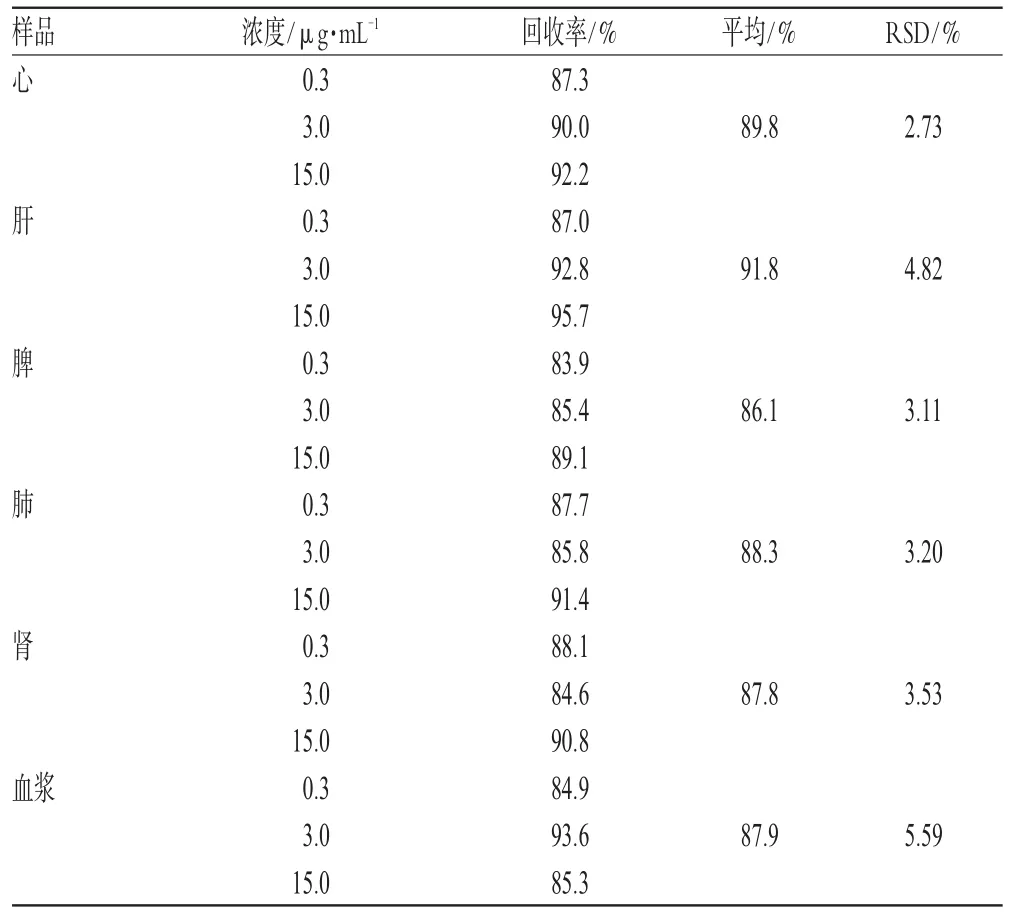
表4 提取回收率试验结果Tab 4 Results of extraction recovery test

表5 小鼠尾iv EMO对照品溶液和EMO-SLN混悬液后的药物浓度比较Tab 5 Comparison of the concentrations of EMO after i.v.injection of EMO control solution and EMO-SLN suspension in mice

图2 小鼠尾iv EMO对照品溶液和EMO-SLN混悬液0.25 h的组织分布图Fig 2 Tissue distribution of EMO 0.25 h after i.v.injection of EMO control solution and EMO-SLN suspension in mice
2.4.3 EMO-SLN混悬液靶向性评价 根据参考文献[7],综合选用靶向性参数:总靶向效率摄取率(re)、总靶向性(Te)来进行评价。其中:re=AUCn/AUCs,Te=AUC靶/AUC总,式中n和s分别表示混悬液和溶液。EMO对照品溶液、EMO-SLN混悬液的靶向性参数比较结果见表6。

表6 EMO对照品溶液、EMO-SLN混悬液的靶向性参数比较结果Tab 6 Comparison of target parameters of EMO control solution and EMO-SLN suspension
由表6可知,小鼠尾iv EMO-SLN混悬液后,肝脏和脾脏的re分别是4.139和2.194,肝脏的Te也远远高于其它各器官,达到了57.99%,这说明小鼠经尾iv EMO-SLN混悬液后,其肝脏靶向明显,药物浓集于肝脏中。
3 讨论
SLN的体内分析方法很多,本文采用HPLC法测定EMO在组织的分布,简单可行,在所选用的色谱条件下,样品内源性物质不干扰EMO的测定,测定结果较好。将EMO制成SLN后改变了其在小鼠组织的分布,肝脏的靶向性明显增强,肝脏re和总靶向性都明显增强。这使其有望用于肝癌、肝纤维化的治疗。
本研究中涡旋提取是很重要的步骤,生物样本的提取中出现了多次涡旋过程。组织匀浆样本比血浆样品黏稠,为了提高涡旋效率,提高提取回收率,故选用了功率较大的涡旋仪,涡旋较长时间,尽可能使其混合均匀,使液-液萃取的效率提高。
从小鼠体内分布研究可以看出,小鼠尾iv给予相同剂量的EMO对照品溶液和EMO-SLN混悬液后不同时间里,药物在血浆、心、肝、脾、肺、肾分布呈现出不同程度的差异。通过比较各器官的re、Te可知,EMO-SLN在肝脏、脾脏的浓度最高。
本研究表明,与EMO对照品溶液比较,EMO-SLN混悬液可在组织中较长时间保持较高浓度,消除较慢,更利于维持稳态血药浓度。
[1]Shieh DE,Chen YY,Yen MH,et al.Emodin-induced apoptosis through p53-dependent pathway in human hepatoma cells[J].Life Sci,2004,74(18):2 279.
[2]Cha TL,Qiu L,Chen CT,et al.Emodin down-regulates androgen receptor and inhibits prostate cancer cell growth[J].Cancer Res,2005,65(15):2 287.
[3]Muller RH,Mader K,Gohla S.Solid lipid nanoparticles(SLN)for controlled drug delivery-a review of the state of the art[J].Eur J Pharm Biopharm,2000,50(1):161.
[4]Mehnert W,Mader K.Solid lipid nanoparticles:production,characterization and applications[J].Adv Drug Deliver Rev,2001,47(2):165.
[5]陈力奋,袁国平.反相高效液相色谱法测定联苯双酯及其滴丸的含量[J].海峡药学,2006,18(4):85.
[6]张 洪,成 蓓.联苯双酯固体脂质纳米粒在小鼠体内组织分布的研究[J].中国药房,2009,20(22):1718.
[7]毕殿洲.药剂学[M].第4版.北京:人民卫生出版社,2000:450.

