1 H磁共振波谱技术在髋部骨质疏松症患者病情评估中的应用
张思伟,田铁桥,罗建东
(广东省中医院影像科,广州510105)
骨质疏松症(OP)是一种常见病、多发病,髋部骨折是其最严重的并发症,治疗棘手,预后差。目前髋部OP的诊断主要通过测定骨密度(BMD),以反映患者的骨量情况,但对骨折的预测能力有限[1]。1H磁共振波谱(1H-MRS)技术能通过无创性观察人体骨髓代谢及生化变化来评估骨质量的情况,为认识骨质生物学特性提供了一条新途径,成为一种独立于BMD测定的新方法[2]。2010年11月~2011年11月,我们采用1H-MRS技术观察了20例OP患者骨髓参数并分析其与BMD的相关性,现报告如下。
1 资料与方法
1.1 临床资料 20例OP患者,男3例,女17例;年龄35~70岁,平均50.75岁。均符合WHO的OP诊断标准[3],排除其他影响骨代谢疾病或药物使用者及合并有心、脑血管、肝、肾等严重原发病症者。Discovery QDR双能X线骨密度仪(美国Hologic公司)检查示9例受试者诊断为骨质疏松(骨质疏松组),男1例,女8例;11例诊断为低骨量(低骨量组),男2例,女9例。另选取健康体检、BMD检测正常者20例为对照组,其中男5例,女15例;年龄38~69岁,平均50.1岁。
1.2 髋部1H-MRS检查 采用德国 Siemens公司1.5T超导MR机及体部线圈,同时采用单体素点分辨波谱序列(Point resolved spectroscopy,PRESS)(TR:3 000 ms,TE:25 ms)进行波谱采集。所有病例均采用TSE T1WI序列作无角度的矢状、横断和冠状面扫描,作为1H-MRS三维空间定位图。扫描参数:TR:623 ms,TE:23 ms,矩阵 336 × 448,层数20,层厚3 mm,层间距1 mm。并分别选取股骨头(1.5 cm ×1.5 cm ×1.5 cm)、股骨颈(1.0 cm ×1.5 cm ×1.5 cm)及股骨大粗隆区(1.5 cm ×1.5 cm ×3.0 cm)3个感兴趣容积(VOI)体素。波谱采集前均进行采集部位的匀场处理,然后完成波谱采集。采集的波谱原始数据采用MR机自带工作站SPECTROSCOPY后处理软件包进行分析并计算以下指标:①脂肪分数(Fat fraction,FF):为脂肪相对信号强度振幅与总信号强度振幅(水和脂肪)的百分比,FF=[Ifat(Iwat+Ifat)]×100%,其中,Ifat和 Iwat分别指脂肪和水的峰值;②脂水峰比(Lipid water ratio,LWR),LWR=Ifat/Iwat;③基线宽度 (Line width,LW)。分析上述指标与BMD的相关性。
1.3 统计学方法 采用SPSS13.0统计软件。计量数据以¯x±s表示,各组间的比较采用方差分析;对BMD与各分析指标之间关系采用直线相关分析,检验水准 α =0.05。
2 结果
2.1 三组髋部1H-MRS曲线形态 三组谱线均显示两个明显的波峰,即4.7 ppm左右的水峰和1.3~0.9 ppm之间的脂峰,各组相比,骨质疏松者谱线的脂峰最为高耸,脂峰与水峰峰值相差最大;低骨量者次之,正常人谱线脂峰最为低矮,脂峰与水峰峰值相差最小。
2.2 三组髋部不同部位1H-MRS分析指标 骨质疏松组FF、LWR均高于对照组及低骨量组,而股骨颈及大粗隆区水峰LW均明显低于对照组及低骨量组(P均<0.05)。低骨量组FF、LWR均明显高于对照组,而股骨颈及大粗隆区水峰LW则均明显低于对照组(P均<0.05)。各组间脂峰LW及股骨头水峰LW比较无统计学差异,见表1。
2.31H-MRS分析指标与 BMD的相关性 股骨头、股骨颈及大粗隆区的FF与整体髋BMD值均呈负相关(r分别为 -0.58、-0.48、-0.40,P均 <0.05),股骨头、股骨颈及大粗隆区的LWR与整体髋BMD值均呈负相关(r分别为 -0.58、-0.48、-0.40,P 均 <0.05),而股骨头、股骨颈及大粗隆区的脂峰和水峰LW均与整体髋BMD值无明显相关性(P 均 >0.05)。
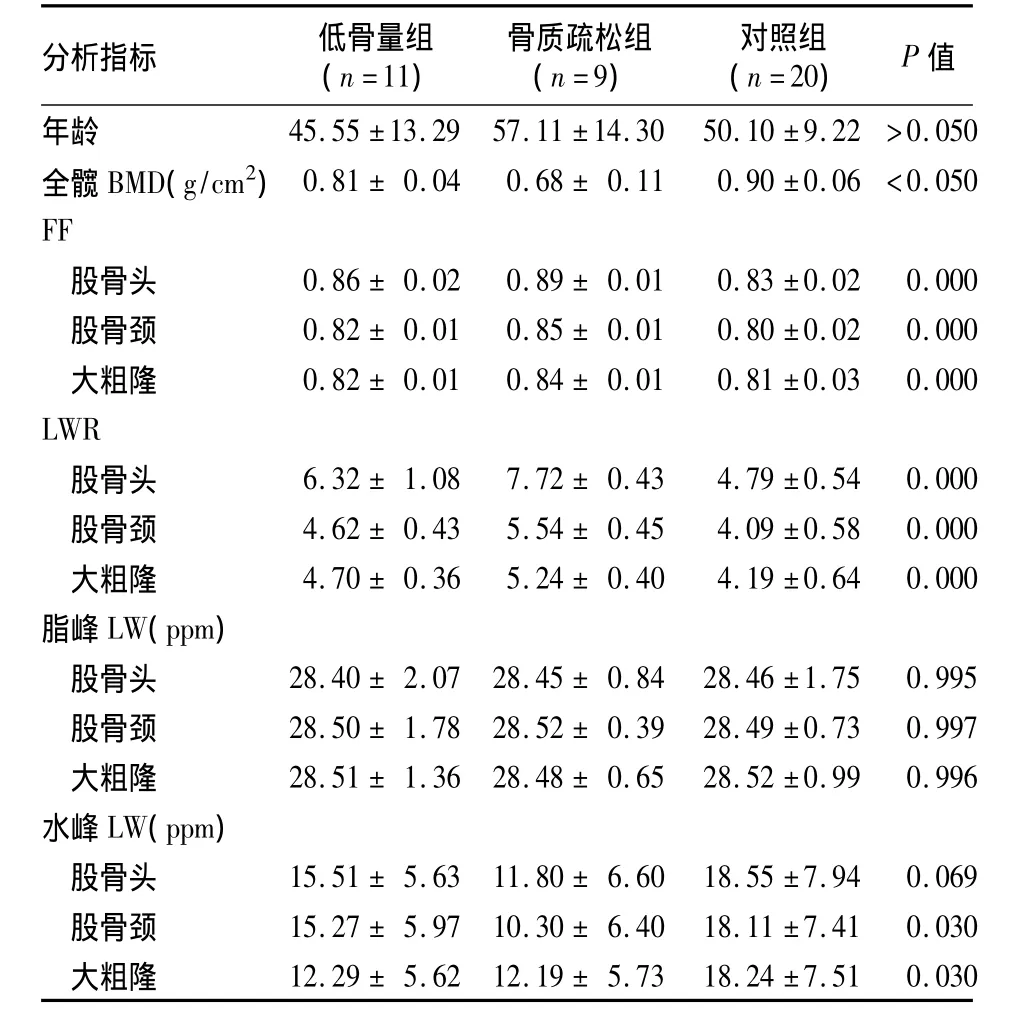
表1 各组髋部不同部位1H-MRS分析指标比较(¯x±s)
3 讨论
人体骨髓分为红骨髓和黄骨髓。红骨髓具有造血功能,其成分包括40%水、40%脂肪、20%蛋白;黄骨髓无造血功能,成分包括15%水、80%脂肪、5%蛋白,主要成分是脂肪细胞。不同年龄阶段骨髓内脂肪、水、蛋白质、矿物质等成分的量不断变化,刚出生的婴儿体内大部分为红骨髓,随着年龄增长直至成人,部分红骨髓生理性转换为黄骨髓;其转化始于外周骨,逐渐向中轴骨发展。25岁左右,人体骨髓的分布趋于稳定,红骨髓主要集中于中轴骨、肱骨及股骨近端,其余部分以黄骨髓为主。红黄骨髓这种生理性转换,反映出人体骨髓随年龄增长,骨髓的脂肪相应增多水分相应减少。已有组织形态学研究证实了该种变化:人体骨髓随年龄增长,造血组织、骨小梁萎缩,脂肪组织相应增多,并由脂肪组织来替代骨小梁和造血组织萎缩后所残余空间位置,该改变在OP患者更为显著[4]。干细胞研究亦发现,脂肪细胞和成骨细胞有共同前体细胞即骨髓间充质干细胞,两者同源,相互竞争,因而骨髓脂肪细胞增多会竞争性抑制成骨细胞的分化和成骨作用,从而可能导致 OP 的发生[5]。Liney 等[6]应用 3.0T MR 对16名健康者的跟骨与腰椎行1H-MRS研究,发现跟骨FF明显较L3椎体FF高,L3的FF与年龄呈正相关(P=0.003),但跟骨的FF与年龄无相关性(P=0.14),FF具有从L1椎体向L5椎体逐渐增加的趋势。Griffith在其腰椎1H-MRS研究中亦发现OP患者腰椎骨髓脂肪含量高于正常人[7]。本研究显示低骨量组、骨质疏松组左股骨FF及LWR均明显高于对照组,且FF及LWR与全髋BMD均呈负相关(P均<0.05),这种变化以骨质疏松组最为明显,与已有文献报道结果一致。反映骨量异常者骨髓脂肪含量相应增多,且骨质疏松越严重则骨髓内脂肪含量就越高,提示骨髓脂肪含量与骨代谢有相关性,骨髓脂肪含量相应增多可能与OP的发生存在关联。
目前常用的OP诊断方法主要是通过测定BMD来反映患者的骨量情况。骨量是指一定长度或体积内的骨矿物质含量,而是否发生骨折,取决于骨强度。骨强度主要反映于骨量和骨质量两个方面;骨质量是指骨的微结构、骨转换率、微损伤积累、材料强度及矿化程度。研究显示骨量只代表骨强度的70% ~85%,其不反映骨结构,不能单独作为骨强度的替代物,对骨折的预测能力有限[1]。当骨的微结构发生变化、而骨量未改变时,其骨强度已下降。
MRS是目前惟一能无创性获得活体代谢及生化变化的检查技术,MRS中1H波谱临床应用最广。在MR均匀磁场中,同种元素的同一种原子由于化学环境的不同可引起化学结构的变化,其共振频率亦有差异,这种频率差异称为化学位移。化学位移是MRS的基础,由于不同化合物之间存在频率差异,MRS才能将不同的化合物分辨出来。MRS谱线的横轴表示化学位移即频率,纵轴表示各种具有不同化学物的信号强度。MRS以检测物与参照物共振频率相比得到的相对值的百万分之一(ppm)来表示。在正常组织中,某种代谢物的浓度恒定。当组织发生病变时,代谢物浓度即发生改变。新近1HMRS研究表明应用FF参数能有效评估人体椎骨骨髓成分变化[7,8]。本研究结果显示股骨头、股骨颈及大粗隆区的FF及LWR与整体髋BMD值均呈负相关,髋部骨髓脂肪含量随BMD减低而增加,与已有文献报道结果一致。我们还发现各兴趣区的脂峰和水峰LW均与整体髋BMD值无明显相关性,与文献结果不完全相同[9,10],可能与 LW和静态主磁场及检查部位本身局部磁场的均匀性有关,在不同研究报道中使用的MR机型不同,所采用的磁体类型、匀场技术等不同,导致MRS采集时主磁场的匀场性可能存在差异,从而使得反映局部磁场不均匀性的LW受到影响。因此,参数LW的应用价值有待进一步研究,而应用FF、LWR为参数的1H-MRS检查可用来评估股骨骨髓脂肪含量,通过股骨骨髓脂肪含量变化可预测OP的发生。
总之,骨髓脂肪含量与BMD存在相关性,骨髓脂肪细胞增多可能导致OP的发生。1H-MRS检查能有效显示骨髓分子生化成分变化,通过对骨髓中水和脂肪含量进行半定量分析,可为评价OP及预防其引发的骨折提供新思路。但OP和骨髓脂肪含量之间相互作用的机制尚有待进一步研究。
[1]Crawford RP,Cann CE,Keaveny TM.Finite element models predict in vitro vertebral body compressive strength better than quantitative computed tomography[J].Bone,2003,33(4):744-750.
[2]Schellinger D,Lin CS,Lim J,et al.Bone marrow fat and bone mineral density on proton MR spectroscopy and dual-energy X-ray absorptiometry:their ratio as a new indicator of bone weakening[J].AJR,2004,183(6):1761-1765.
[3]Kanis JA.Diagnosis of osteoporosis and assessment of fracture risk[J].Lancet,2002,359(9321):1929-1936.
[4]Verma S,Rajaratnam JH,Denton J,et al.Adipocytic proportion of bone marrow is inversely related to bone formation in osteoporosis[J].JClin Pathol,2002,55(9):693-698.
[5]Gimble JM,Nuttall ME.Bone and fat:old questions,new insights[J].Endocrine,2004,23(2-3):183-188.
[6]Liney GP,Bernard CP,Manton DJ,et al.Age,gender,and skeletal variation in bone marrow composition:a preliminary study at 3.0 Tesla[J].JMagn Reson Imaging,2007,26(3):787-793.
[7]Griffith JF,Yeung DK,Antonio GE,et al.Vertebral marrow fat content and diffusion and perfusion indexes in women with varying bone density:MR evaluation[J].Radiology,2006,241(3):831-838.
[8]Fanucci E,Manenti G,Masala S,et al.Multiparameter characterisation of vertebral osteoporosis with 3-T MR[J].Radiol Med,2007,112(2):208-223.
[9]Schellinger D,Lin CS,Hatipoglu HG,et al.Potential value of vertebral proton MR spectroscopy in determining bone weakness[J].Am JNeuroradiol,2001,22(8):1620-1627.
[10]Shih TT,Chang CJ,Hsu CY,et al.Correlation of bone marrow lipid water content with bone mineral density on the lumbar spine[J].Spine,2004,29(24):2844-2850.

