脑瘫患者骨髓间充质干细胞体外培养特性分析
王亚莉,陈国军,方 凤,陈 丽,张 青,刘厚奇
(1浙江武警总队医院,浙江嘉兴314000;2第二军医大学发育生物学研究所)
间充质干细胞因具有强大的分化能力和组织修复能力广泛用于脑瘫的治疗。据报道,骨髓间充质干细胞(Human marrow mesenchymal cells,hMSCs)可在体外成功培养、分化为神经干细胞、血管内皮细胞、肝细胞、软骨组织、骨组织等[1],发挥修复损伤组织的作用。自2010年12月以来,我院开始采用自体hMSCs体外转化神经干细胞治疗脑瘫,取得较好效果。现对hMSCs体外培养生长特性进行分析,旨在指导临床把握治疗时机和提高种子细胞质量,提高治疗效果。
1 材料与方法
1.1 材料 MSC培养基(含DMEM、MCDS、优级FBS、LAA,Sigma 公司),0.05%Trypsin-EDTA(GIBCO公司),PBS缓冲液,bFGF,倒置显微镜,CD34、CD109、CD29、CD44 单抗,大皿(100 mm)、中皿(60 mm)培养皿。38份骨髓样本取自38例脑瘫患者[(男22例,女16例,年龄1~35岁;其中1~3岁11例(婴幼儿组)、4~6岁9例(学龄前组)、7~19岁10例(学龄组),20~35岁8例(成人组)]。患者均签署知情同意书,通过医院伦理委员会审批。
1.2 hMSCs原代细胞(P0)分离培养 各组均根据0.6~1 mL/kg体质量于右侧髂后上嵴采集骨髓12~50 mL,骨髓收集管中按100 U/mL加入肝素抗凝,骨髓样分装到多支15 mL离心管,每管5 mL,加入等量PBS溶液,配平,离心7 min,1 000 r/min。离心结束小心取出,用移液管抽取上层液体,弃掉,用吸管抽取中间白膜层(尽量少带入红细胞),抽至新管内,加入PBS清洗2次,用培养基重悬后倒入培养皿中。根据骨髓量的多少以及白膜层是否明显决定放入大皿或中皿。置37℃、5%CO2饱和湿度孵箱内孵育,48 h半量换液,4 d后全量换液,弃去大量的悬浮细胞,以后每3~4 d根据培养基颜色换液。
1.3 原代及传代细胞生长形态特征及细胞增长速率计算 原代细胞一般在分离后6~9 d传代1次,P1以后于细胞生长达到覆盖培养皿的60% ~80%后予1∶2或1∶3传代。从第2代以后,每次传代时行hMSCs鉴定:弃去上清,用PBS清洗2次,滴加0.05%的Trypsin-EDTA胰酶消化,显微镜下观察细胞触角收缩,细胞变成圆形后,添加培养基终止消化,制成(1~3)×106/mL的细胞悬液分装于不同培养皿中,3~4 d根据培养基颜色换液。流式细胞仪检测示CD34、CD109阴性,CD29和CD44阳性率均>90%证实为hMSCs。倒置相差显微镜逐日观察原代及传代细胞生长情况和形态特征。并计算各组细 胞 增 长 速 率,细 胞 增 长 速 率 =(传代天数
1.4 统计学方法 采用SPSS10.0统计软件进行统计分析,计量数据以x¯±s表示、行t检验,率的比较行 χ2检验,检验水准 α =0.05。
2 结果
P0第2天可见贴壁生长,先呈圆点形,逐渐伸出触角成梭形,原代细胞贴壁较慢,24 h后逐渐贴壁,换液培养,贴壁细胞渐形成集落。婴幼儿组、学龄前及学龄组hMSCs形成集落明显,细胞数较多,细胞呈长梭形较集中,生长速度快;成人组hMSCs形成集落小,细胞数较少,细胞较大呈短梭形散在分布。各组细胞成簇生长,在杂质细胞较多时培养基由鲜红转为暗红,当第4天全量换液后杂质细胞减少,培养皿中呈现培养基本身的粉红色,呈簇生长的细胞簇面积增大,中心较密集,似菊花状。各组于6~9 d进行传代第1次(P1),P1以后的细胞在培养皿中呈均匀分布,生长速率逐渐增快。各组细胞传代时间情况见表1,细胞增长速率比较见表2。

表1 各组细胞传代时间(d,¯x±s)
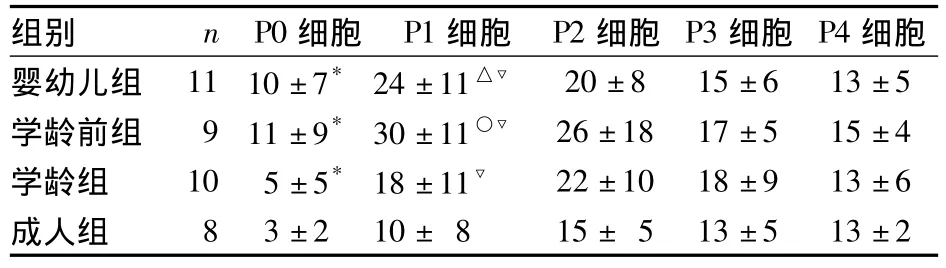
表2 各组细胞增长速率(%,¯x±s)
3 讨论
hMSCs具有可分离并体外培养与扩增的特性,组织修复性能好。大量研究证实间充质干细胞可转化为神经干细胞修复脑损伤[2,3],而患者间充质干细胞的实验室细胞工程质量是关键因素,骨髓hMSCs的含量、质量、活性等随着年龄的增长而下降[4,5]。陈国军等[6]曾对 11 个月 ~3 岁、4 ~20 岁、21岁~40岁以及41~60岁的20例患者的hMSCs体外培养增殖速度与传代时间进行观察,发现40岁以内患者首次传代时间无明显差异,<20岁者P1传代时间明显短于>20岁者,且培养达到治疗数量细胞所需时间明显短于>20岁者。
本研究结果显示,脑瘫患者无论年龄大小,其hMSCs均可成功于体外分离、培养、扩增。原代细胞贴壁较慢,且贴壁不稳固,可能因培养皿中有较多的红细胞等其余杂质细胞,影响间充质干细胞的贴壁,故半量换液或全量换液过程中动作一定要轻柔,切忌剧烈晃动,以免影响细胞的贴壁生长;贴壁后的细胞呈簇生长,在培养皿中不是均匀铺开,所以一般6~9 d无论细胞生长是否覆盖培养皿的60%以上均应给予传代,否则细胞聚集在一起出现老化现象。原代细胞传代时,呈簇生长的细胞被吹散开来,轻轻晃动培养皿,使细胞均匀覆盖培养皿,有利于细胞的贴壁增殖。经过首次传代后大量的红细胞已被清除,P1以后的细胞在培养皿中呈均匀分布,培养基澄清透明容易观察细胞的生长状态。研究发现,儿童的hMSCs与成人相比倍增时间短,形成的集落多,其 MSCs用于组织工程和细胞治疗较为理想[7,8]。本研究亦发现,<20岁的3个年龄组 hMSCs生长速度均明显快于成人组,P1~P2代细胞增殖速度较快,传代需要的时间短,P3~P4代细胞增长速率逐渐减慢。而成人组hMSCs细胞快速生长期不明显。
综上所述,脑瘫患者自体hMSCs是理想的种子细胞,具有取材方便,易于培养、扩增的优点;<20岁者的hMSCs培养速度快,生长效率高,在短时间内培养可获取足够细胞数。
[1]李洪伟,郭今开,周冰,等.人骨髓间充质干细胞体外培养及其生物学特性[J].山东医药,2011,51(26):91-93.
[2]Titomanlio L,Kavelaars A,Dalous J.Stem cell therapy for neonatal brain injury:perspectives and challenges[J].Ann Neurol,2011,70(5):698-712.
[3]Chen A,Siow B,Blamire AM.Transplantation of magnetically labeled mesenchymal stem cells in a model of perinatal brain injury[J].Stem Cell Res,2010,5(3):255-266.
[4]Tokalov SV,Gruener S,Schindler S.A number of bone marrow mesenchymal stem cells but neither phenotype nor differentiation capacities changes with age of rats[J].Mol Cells,2007,24(2):255-260.
[5]Iagunov AS,Baumann M,Abolmaali ND,et al.Effect of maturation on the osteogonic response of cultured stromal bone marrow cells to basic fibroblast growth factor[J].Bone,2000,27(6):777-783.
[6]陈国军,王亚莉,方凤,等.不同年龄患者骨髓间充质干细胞体外生长特性[J].国际检验医学杂志,2011,32(19):2189-2191.
[7]Choumerianou DM,Martimianaki G,Stiakaki E,et al.Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults[J].Cytotherapy,2010,12(7):881-887.
[8]王海峰,李鲁生,张涵,等.脑瘫患者骨髓间充质干细胞传代过程中细胞表型和所分泌细胞因子变化特点[J].武警医学,2011,22(3):199-202.

