表皮生长因子对CacyBP/SIP过表达慢病毒载体转染的结肠癌细胞CacyBP/SIP核转位的影响
谢福利,翟惠虹
(1宁夏师范学院医学院,宁夏固原756000;2宁夏医科大学总医院)
据报道[1~4],钙周期素结合蛋白(CacyBP/SIP)核转位在肿瘤发生、发展、侵袭、转移等方面均起促进作用,但机理目前尚不明确。有报道,表皮生长因子在结肠癌组织、癌周组织、癌远侧组织均有表达[5,6],且随肿瘤分期增加而表达增强,用其单克隆抗体处理LST174结肠癌细胞可见到一定程度的增殖抑制[7]。2010年7月~2011年9月,我们观察了表皮生长因子对CacyBP/SIP过表达慢病毒载体转染的结肠癌细胞CacyBP/SIP核转位的影响,现报告如下。
1 材料与方法
1.1 材料 结肠癌SW480细胞购于上海中科院。L15培养基、小牛血清、胰酶购自Gibco公司;DAPI染色剂、表皮生长因子购于Sigma公司、胞质胞核蛋白抽提试剂盒购于Pierce公司;CacyBP/SIP mAb购于Cell signaling;FITC标记的羊抗鼠IgG购自中山公司;Triton x-100裂解液试剂盒购自北京鼎国公司;PVDF膜购自Merck公司。
1.2 过表达CacyBP/SIP慢病毒载体的构建及转染应用人结肠癌细胞株HCT-116的cDNA序列,采用PrimerPremierv5.0软件分别设计上游和下游引物;引物序列及用途见表1。应用PCR法扩增CacyBP/SIPcDNA序列。PCR扩增条件:94℃预变性5min;30次循环:94℃变性30 s,55℃退火30s,72℃延伸1min;72℃总延伸10 min。PCR产物常规测序。带有绿色荧光的慢病毒载体与目的基因分别用NheI和EcoRI进行双酶切,T4连接酶将酶切后的产物相连,连接产物转化大肠杆菌DH5α感受态细胞,应用PCR法筛选阳性克隆。PCR扩增条件:94℃预变性2min;30次循环:94℃变性30s,60℃退火30s,72℃延伸1min;72℃总延伸6min。接种阳性转化子。对构建载体的阳性克隆PCR结果电泳鉴定(图1);进行测序与目标基因比对(图2)。

表1 引物序列及用途
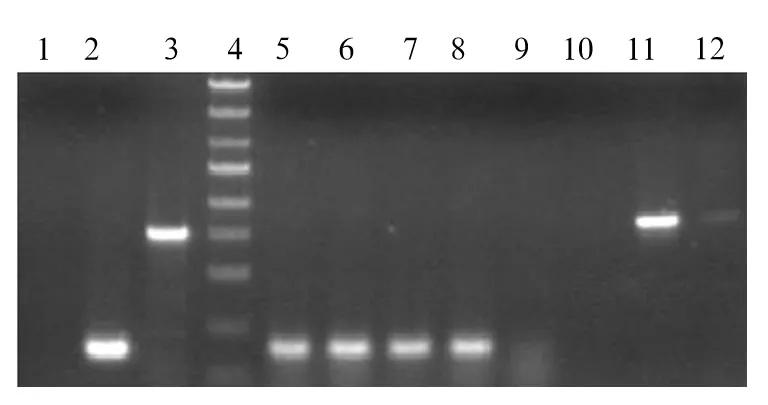
图1 阳性克隆PCR电泳注:1:阴性对照(ddH2O);2:阴性对照(空载自连对照组);3:阳性对照(GAPDH);4:Marker:5kb,3kb,2kb,1.5kb,1kb,750bp,500bp,250bp,100bp;5~12:CacyBP-1~8号转化子

图2 部分基因测序比对
将构建好的带有绿荧光蛋白的CacyBP-Lentivirus载体转染至结肠癌SW480细胞:将人结肠癌细胞SW480细胞用含10%的56℃、30min热灭活小牛血清的L15培养基,在37℃、5%CO2饱和湿度培养箱中培养,隔天换液,待细胞长至80% ~90%传代。至细胞在T50瓶长至30% ~50%时,每瓶加入Polybrene500μL(5μg/mL)、完全培养基4400μL和过表达CacyBP/SIP的慢病毒颗粒100μL(1×108),在水平方向轻轻摇动培养瓶,使之充分混匀,放入培养箱培养8~12h后观察细胞状态,弃去细胞上清,更换为新鲜培养基继续培养。待细胞长至80%以上融合时,正常消化传代。
1.3 表皮生长因子刺激及CacyBP/SIP在细胞内定位和表达检测 ①激光共聚焦显微镜法:取3个12孔培养板,每孔放置一个细胞爬片,每孔接种(3~4)×104个细胞于12孔板。待细胞长至最佳状态时,吸干培养基,用PBS冲洗2次,每个培养板加入2mL含100ng/mL表皮生长因子培养基,对照组每孔分别加入完全培养基作为对照。放入培养箱培养1h。用4%多聚甲醛1mL,固定20min,PBS冲洗3遍,再用0.1%的 Tritont100,37℃温箱内打孔45 min,PBS冲洗3遍,最后用含DAPI封片剂染色封片。观察刺激前后CacyBP/SIP在细胞中的定位。②Westernblot法:将转染后的SW480细胞予100 ng/mL表皮生长因子刺激1h,胰酶消化后以500转离心3min,取细胞沉淀用细胞质蛋白、核蛋白抽提试剂盒分别抽提胞质、胞核蛋白,用BCA试剂盒进行蛋白定量;上样缓冲液稀释至5μg/μL、煮沸后-80℃冻存;将20μL蛋白样品上样到12%SDSPAGE胶加样孔内,电泳电压80V,时间20min;湿式转膜,电流200mA,60min;加入5%脱脂牛奶封闭60min后,加入CacyBP/SIP单抗(1∶200)4℃孵育过夜,常规洗膜后加入羊抗鼠IgG(1∶2000)的二抗,室温孵育1h,洗涤。曝光、显影。检测刺激前后CacyBP/SIP在细胞中的定位。
2 结果
激光共聚焦检测结果显示表皮生长因子刺激前CacyBP/SIP主要位于细胞胞质内,刺激1h后CacyBP/SIP转位至细胞核内(图3)。Westernblot检测结果显示刺激前CacyBP/SIP主要在胞质内表达,刺激1h后可在细胞核内表达(图4)。
3 讨论

图3 激光共聚焦法检测表皮生长因子刺激前、后CacyBP/SIP在细胞内定位

图4 Western blot检测表皮生长因子刺激前、后CacyBP/SIP在细胞质及细胞核中的表达
CacyBP/SIP相对分子质量约为26kD,含一个687bp的开放阅读框,编码228个氨基酸,存在7个磷酸化位点和1个核定位信号[8]。CacyBP/SIP的C-末端可形成两性α-螺旋,与S100蛋白家族的结构域相似,C-末端(155-229)为S100蛋白结合域,N-末端(1-80)可与Siah-1结合,中间(73-155)即可与Skp1结合的区域[9]。目前对CacyBP/SIP功能的研究报道较少,其功能主要表现在以下两方面:①与红细胞有关:据报道[10,11],促红细胞生成素受体活化可促进CacyBP/SIP表达上调;②与p53有关:参与新的泛素—蛋白酶体降解,当p53在细胞内表达升高时,可诱导Siah-1基因表达[12],共同组成泛素连接酶复合体 (Siah-1-CacyBP/SIP-SCF),将未被磷酸化的β-catenin蛋白酶体降解。
以往研究发现,CacyBP/SIP在胃癌阿霉素耐药细胞中高表达并参与胃癌细胞多药耐药,其下调可以部分逆转耐药性[13,14]。进一步研究发现,CacyBP/SIP可抑制胃癌细胞的恶性表型,下调其表达能促进胃癌细胞的恶性表型,推测其通过促进癌细胞的凋亡和参与降解β-catenin影响靶分子的表达。但在肾细胞癌中发现,CacyBP/SIP表达上调能抑制肾细胞癌的增殖和肿瘤形成[15]。近年来又发现CacyBP/SIP参与乳腺癌、胰腺癌的发生、发展及复发转移,可能成为预后不良的生物学指标之一[16~19]。因此推断CacyBP/SIP与恶性肿瘤的发生、发展密切相关。本课题组前期采用淋巴细胞杂交瘤技术制备了三株CacyBP/SIP单克隆抗体,对正常及肿瘤组织中CacyBP/SIP表达分布状况做了较系统的研究[20,21],发现 CacyBP/SIP 在结肠癌组织中的表达明显高于癌旁组织,在正常结肠组织不表达,且主要定位于胞质及胞核;予KCl刺激后,通过升高胞质内Ca2+浓度,可诱导CacyBP/SIP核转位。
表皮生长因子是1962年美国Cohen博士在实验中偶然发现,是一类广泛存在于人类和动物体内的小分子多肽,不同种类动物的EGF氨基酸组成及结构有一定差异,不同来源的表皮生长因子均能促进表皮细胞的分裂与增殖[22],与肿瘤的发生、发展关系密切。其基因在第4号染色体上(q25-q27),约有 120 kb[23],等电点(PI)为 4.6,相对分子质量为6 045 Da,由53个氨基酸残基组成的单链多肽,含3个链内二硫键[24]。有报道新型表皮生长因子受体抑制剂不管是单用还是与放疗、化疗联合,均可提高患者生存率、延长缓解期[25]。
慢病毒载体是在HIV-1病毒基础上改造而成的病毒载体系统,其基因组是正链RNA,进入细胞后,在细胞质中被其自身携带的反转录酶反转为DNA,形成DNA整合前复合体,进入细胞核后DNA整合到细胞基因组中。整合后的DNA转录mRNA,回到细胞质中,表达目的蛋白。鉴于慢病毒载体具有转染效率高、可稳定长效表达、安全性高、可表达调控等优点,我们构建了CacyBP/SIP过表达慢病毒载体并将其转染至结肠癌SW480细胞。激光共聚焦法及Western blot法均发现表皮生长因子刺激前CacyBP/SIP均主要定位于细胞胞质,刺激后CacyBP/SIP可发生核转位现象,Western blot检测亦证实CacyBP/SIP在刺激前位于胞质,刺激后部分位于胞核。
蛋白在细胞中的定位常与其功能密切相关,很多蛋白分子从无活性形式变为活性形式时会发生分子定位的变化,进入到特定的亚细胞结构中发挥其功能,其核转位现象提示其可能作为信号分子传递信息,从而参与细胞功能的调节。我们前期已发现CacyBP/SIP在结肠癌组织中高表达,免疫组化结果提示CacyBP/SIP位于胞质及胞核,表皮生长因子可诱导CacyBP/SIP核转位,关于CacyBP/SIP是否作为信使传递上游促进恶性肿瘤增殖的信号,尚需进一步研究。
[1] Filipek A,Jastrzebska B,Nowotny M,et al.Ca2+-dependent translocation of the calcyclinbinding protein in neurons and neuroblastoma NB-2a cells[J].J Biol Chem,2002,277(23):21103-21109.
[2]Wu J,Tan X,Peng X,et al.Translocation and phosphorylat ion of calcyclin binding protein during retinoic acid-induced neuronal differentiation of neuroblastoma SH-SY5Y cells[J].J Biochem Mol Biol,2003,36(4):354-358.
[3]胡文华,尹芳,金晓航,等.CacyBP编码基因对胃癌细胞多药耐药性形成的影响[J].中华肿瘤杂志,2002,24(5):426-429.
[4]ZHai H,Shi Y,Jin H,et al.Expression of calcyclin-bindingprotein/Siah-1 interacting protein in normal and malignant human tissues:an immunohistochemical survey[J].J Histochem Cytochem,2008,56(8):765-772.
[5]张捷,王年吉,许瑞吉.人表皮生长因子及受体在人结肠癌中的表达[J].解放军医学杂志,1993,18(3):185-187.
[6]范国利,许延发.表皮生长因子受体在大肠癌中表达的意义[J].陕西医学杂志,2000,29(1):23-25.
[7]曲娴,陈杰,刘彤华.表皮生长因子受体单克隆抗体抗人结肠癌LST174 的作用[J].世界华人消化杂志,2001,9(7):841.
[8]Filipek A,Kuznicki J.Molecular cloning and expression of a mouse brain cDNA encoding a novel protein target of calcyclin[J].JNeuroehem,1998,70(5):1793-1798.
[9]Filipek A,Jastrzebska B,Nowotny M,et al.CacyBP/SIP,a calcyclin and Siah-1-interaeting-protein,binds EF-hand proteins of the S100 family[J].JBiol Chem,2002,277(32):28848-28852.
[10]Xia ZB,Dai MS,Magoulas C,et al.Differentially expressed genes during in vitro differentiation of murine embryonic stem cells transduced with a human erythropoietin receptor cDNA[J].JHematother Stem Cell Res,2000,9(5):651-658.
[11]Pircher TJ,Geiger JN,Zhang D,et al.Wojchowski DM.Integrative signaling by minimal erythropoietin receptor forms and c-Kit[J].JBiol Chem,2001,276(12):8995-9002.
[12]Matsuzawa SS,Takayama BA,Froesch JM,et al.P53-inducible human homologue of Drosophila seven in absentia(Siah)inhibits cell growth:suppression by BAG-1[J].EMBO J,1998,17(10):2736-2747.
[13]Hu W,Yin F,Jin X,et al.Effect of human calcyclin binding protein encoding gene on development of multiple drug resistance in gastric cancer[J].Zhong hua Zhong Liu Za Zhi,2002,24(5):426-429.
[14]Shi YQ,Hu WH,Yin F,et al.Regulation of drug sensitivity of gastric cancer cells by human calcyclin-binding-protein(CacyBP)[J].Gastric Cancer,2004,7(3):160-166.
[15]Sun S,Ning X,Liu J,et al.Over expressed CacyBP/SIPleads to the suppression of growth in renal cell carcinoma[J].Biochem Biophys Res Commun,2007,356(4):864-871.
[16]宁晓暄,孙世仁,张坤,等.S100分子结合域缺失对钙周期素结合蛋白生物学功能影响的研究[J].中华肿瘤防治杂志,2008,15(13):968-971.
[17]王宁菊,马刚,翟惠虹.钙周期素结合蛋白与乳腺癌临床的相关性研究[J].第四军医大学学报,2009,30(21):2403-2407.
[18]Chen X,Han G,Zhai H,et al.Expression and clinical significance of CacyBP/SIP in pancreatic cancer[J].Pancreatology,2008,8(4-5):470-477.
[19]Wang N,Ma Q,Wang Y,et al.CacyBP/SIP expression is involved in the clinical progression of breast cancer[J].World J Surg,2010,34(11):2545-2552.
[20]Chen X,Mo P,Li X,et al.CacyBP/SIP protein promotes proliferation and G1/Stransition of human pancreatic cancer cells[J].Molecular Carcinogenesis,2011,50(11):804-810.
[21]Zhai H,Shi Y,Yu J,et al.Establishment and characterization of calcyclin-binding-protein(CacyBP)monoclonal antibody[J].Hybri2 doma(Larchm t),2006,25(2):91-94.
[22]孙同柱,吴志谷,付小兵,等.重组人表皮生长因子对大鼠皮肤生的影响[J].中华实验外科杂志,2003,20(7):665.
[23]Pachc JC.Epidemal grow th factors In Geoffrey J Laurent Steven D.Shapiro eds Encyclopedia of Respiratory Medicine[M].Boston:Academ ic Press,2006:129-133.
[24]曾嵘,邵晓霞,夏其昌.人表皮生长因子肽谱及一级结构质谱法分析[J].生物化学与生物物理学报,1999,31(1):31-36.
[25]邵仲英,封宇飞,傅得兴.新型表皮生长因子受体抑制剂——西妥昔单抗[J].中国全科医学,2006,9(4):317-318.

