缺血后适应减轻大鼠肢体缺血再灌注后的心肌损伤*
赵利军,门秀丽,李宏杰,孔小燕,吴 静,刘丽华
(河北联合大学基础医学院病理生理学教研室,河北 唐山 063000)
肢体缺血再灌注(limb ischemia-reperfusion,LIR)损伤是一个全身性的病理过程,常可累及心、脑、肺等远隔器官[1]。调动机体内源性保护机制,减轻损伤程度,即预适应,是目前再灌注损伤研究领域的讨论热点。在众多预适应措施中,缺血后适应(ischemic postconditioning,IPostC)因其可操作性方面的优势,逐渐受到人们的重视。IPostC可通过抗氧化酶的激活、抑制炎症反应等启动细胞保护通路[2]。此外,目前关于IPostC器官保护作用的研究多是针对缺血器官本身而言的,临床可行性会受到一定的限制。本研究借鉴缺血后适应的处理方法,观察发生在肢体的IPostC对远隔组织——心肌的保护效应。
材料和方法
1 动物与分组
健康SPF级雄性Wistar大鼠24只,体重200~250 g,购自河南医科大学实验动物中心。动物术前24 h禁食,饮水自由。动物随机分为3组(每组8只):正常对照组(C组)、缺血再灌注组(IR组)和缺血再灌注+缺血后适应组(IR+IPostC组)。
2 动物模型制备及标本采集
复制大鼠LIR模型[1],使用标准化弹性的橡皮带环绕结扎大鼠双后肢根部阻断血流4 h,然后松解橡皮带恢复血流灌注4 h。C组动物松弛结扎双后肢不阻断血流,IR+IPostC组在4 h缺血后,松解肢体恢复血流灌注5 min,再缺血5 min,反复5次进行缺血后适应,然后再进入4 h血流再灌注阶段。实验结束时自腹主动脉取血,4℃、3500 r/min离心15 min留取血浆,生化测定待用。取心肌组织100 mg,加入1 mL冷生理盐水,冰浴条件下电动匀浆3 min制备10%心肌组织匀浆,3500 r/min低温离心15 min留取上清液,进行心肌组织各项生化指标检测。每组随机取2只大鼠,在取血结束后,迅速在心脏左室游离壁处取材,将取下的组织块立即投入冷的4%戊二醛-磷酸缓冲液,切成1 mm×1 mm×1 mm的小块预固定,后转入2.5%戊二醛中固定,经丙酮脱水、环氧树脂618包埋、超薄切片、染色后在透射电镜下观察心肌组织的超微结构。
3 试剂、设备来源及指标测定
心肌组织匀浆及血清制备应用FSH-II型高速电动匀浆器(江苏金坛金城国胜实验仪器厂)和SIGMA-2M/ETM低温高速离心机(Sigma)。超氧化物歧化酶(superoxide dismutase,SOD)、黄嘌呤氧化酶(xanthine oxidase,XOD)、丙二醛(malondialdehyde,MDA)和髓过氧化物酶(myeloperoxidase,MPO)测定采用生化试剂盒(购自南京建成生物制品公司),操作步骤严格依照试剂盒说明书进行。速率法测定血清心肌肌钙蛋白I(myocardial troponin I,cTnI)含量,应用肌钙蛋白胶乳增强免疫比浊定量测定试剂盒(太原市川至生物工程有限公司)进行。血清肌酸激酶(creatine kinase,CK)及其MB同工酶(creatine kinase MB,CK-MB)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)和α-羟丁酸脱氢酶(α-hydroxybutyrate dehydrogenase,α-HBDH)测定应用7150型全自动生化分析仪(Hitachi)进行。组织超微结构观察应用JEM-100CX透射电子显微镜(JEOL Ltd.)。
4 统计学处理
采用SPSS 13.0统计软件包进行分析实验数据,计量资料以均数±标准差()表示,均数间比较采用单因素方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
结 果
1 心肌损伤的生化指标检测结果
与C组比较,再灌注后血清CK、CK-MB和cTnI均升高(P<0.05)。IR+IPostC组与IR组比较,血清CK、CK-MB和cTnI都有所降低(P<0.05),见表1。再灌注后,血清AST、LDH和α-HBDH水平均较C组升高(P<0.05)。IR+IPostC组与IR组比较,血清AST、LDH和α-HBDH都有所降低(P <0.05),见表1。
表1 各组动物血清CK、CK-MB、cTnI、AST、LDH和α-HBDH的变化Table1.The serum levels of CK,CK-MB,cTnI,AST,LDH and α-HBDH in different groups(.n=8)

表1 各组动物血清CK、CK-MB、cTnI、AST、LDH和α-HBDH的变化Table1.The serum levels of CK,CK-MB,cTnI,AST,LDH and α-HBDH in different groups(.n=8)
#P <0.05 vs C group;▲P <0.05 vs IR group.
Group CK(103U/L) CK-MB(103U/L) cTnI(μg/L) AST(103U/L) LDH(103U/L) α-HBDH(103U/L)C 0.42 ±0.06 0.55 ±0.12 0.38 ±0.06 0.480 ±0.0600.490 ±0.120 0.600 ±0.110 IR 15.37 ±1.67# 19.12 ±2.48# 3.32 ±0.79# 1.837 ±0.670# 3.856 ±0.480# 4.220 ±0.730#IR+IPostC 8.78 ±1.56#▲ 10.58 ±0.73#▲ 1.14 ±0.09#▲ 0.953 ±0.260#▲ 1.058 ±0.410#▲ 2.138 ±0.500#▲
2 氧化应激各项指标的检测结果
2.1 血浆SOD、XOD活性和MDA水平 与C组比较,再灌注后血浆XOD活性和MDA水平升高,而SOD活性下降(P<0.05),但IR+IPostC组与IR组比较,血浆XOD活性和MDA水平有所降低而SOD活性有所回升(P<0.05),见表2。
2.2 心肌组织SOD、MDA和MPO水平 与C组比较,再灌注后心肌组织MPO活性和MDA水平升高,而SOD活性下降(P<0.05),但IR+IPostC组与IR组比较,心肌组织MPO活性和MDA水平有所降低而SOD活性有所回升(P<0.05),见表3。
3 心肌组织超微结构变化
电镜下可见C组心肌肌原纤维排列整齐,明暗带清晰,线粒体基质致密,嵴排列紧密整齐,糖原颗粒丰富,见图1A。IR组可见肌丝排列紊乱或消失,基质明显水肿,线粒体大部分或全部的嵴和膜融合或消失,空泡化明显,糖原数量明显减少,见图1B。IR+IPostC组心肌上述病理改变有所减轻,见图1C。
表2 血浆SOD、XOD和MDA水平Table2.The plasma levels of SOD,XOD and MDA in different groups(.n=8)

表2 血浆SOD、XOD和MDA水平Table2.The plasma levels of SOD,XOD and MDA in different groups(.n=8)
#P <0.05 vs C group;▲P <0.05 vs IR group.
Group SOD(103U/L) XOD(U/L) MDA(μmol/L)C 75.678 ±19.614 34.030 ±1.652 6.500 ±1.095 IR 7.832 ±1.679# 52.980 ±9.358# 38.595 ±15.551#IR+IPostC 54.341 ±9.091#▲ 35.142 ±1.823#▲ 7.119 ±1.067#▲
表3 心肌组织SOD、MPO和MDA水平Table3.The levels of SOD,MPO and MDA in myocardial tissues of different groups(.n=8)

表3 心肌组织SOD、MPO和MDA水平Table3.The levels of SOD,MPO and MDA in myocardial tissues of different groups(.n=8)
#P <0.05 vs C group;▲P <0.05 vs IR group.
Group SOD[103U/g protein]MDA[μmol/(g protein)]MPO(U/g)C 48.353±13.067 0.226±0.090 0.424±0.076 IR 19.090±10.355# 0.514±0.098# 0.717±0.069#IR+IPostC 27.031±11.921#▲ 0.452±0.071#▲ 0.591±0.037#▲
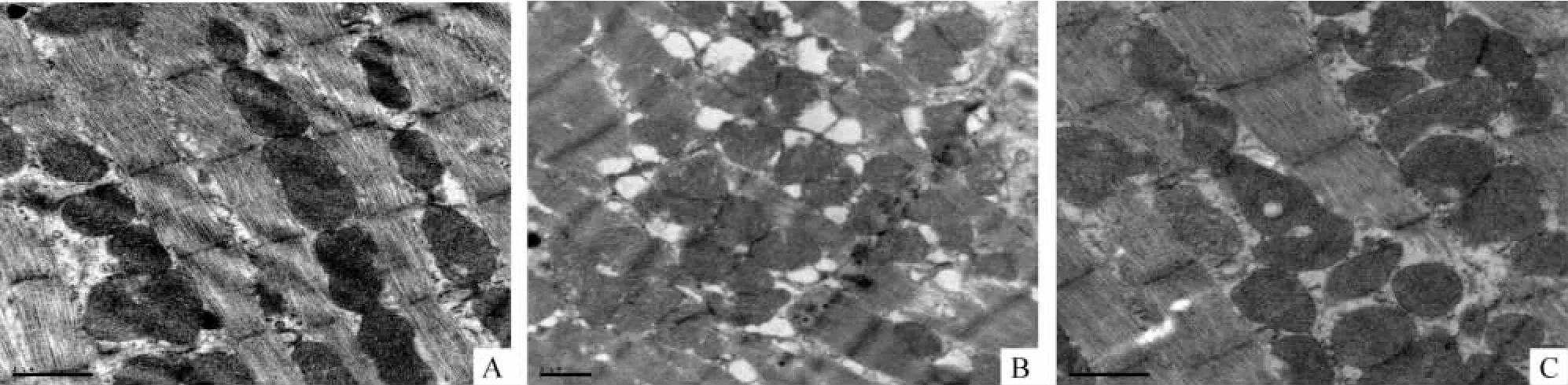
Figure1.Myocardial tissue ultrastructure in the three groups(×5000).A:C group;B:IR group;C:IR+IPostC group.图1 心肌组织超微结构
讨 论
近年来,减轻再灌注损伤的各种适应机制和措施受到人们的普遍重视。由于组织缺血的发生往往无法提前预知,所以曾备受关注的缺血预适应的临床应用受到很大限制。与预适应相对应,IPostC是在长时间组织器官缺血后,先进行短暂的重复性血管开通及再闭,然后再实施持续性复灌[3]。IPostC中多种细胞外信号可通过G蛋白偶联受体启动细胞内再灌注损伤补救激酶(reperfusion injury salvage kinase,RISK)通路,从而激活多种细胞内保护性蛋白,有广泛的全身组织保护作用[4]。
缺血再灌注损伤是多因素参与、非抗原依赖性的全身炎症反应过程。我们以前的研究证实,LIR有远隔器官损伤作用,可引发心功能的障碍和心肌组织的损伤等[1]。CK是主要分布在骨骼肌和心肌细胞的胞浆酶,而CK-MB在心肌细胞中含量最多,本实验中对CK和CK-MB的同步观察可排除骨骼肌损伤对心肌酶学指标的干扰。cTnI比CK-MB更具有心肌特异性和灵敏性,是目前最理想的心肌细胞损伤标志物[5]。本实验发现,LIR后心肌细胞胞浆酶CK和CK-MB释放增加,且血中cTnI水平上升,同时观察到心肌细胞肌丝排列紊乱或消失,基质明显水肿,线粒体大部分或全部的嵴和膜融合或消失,空泡化明显,糖原数量明显减少。IPostC组心肌细胞胞浆酶漏出减少,说明IPostC可通过一定机制稳定心肌细胞膜的结构。组织MPO的活性可表示组织中PMN的数量和炎症损伤的程度。LIR后心肌组织MPO活性升高说明心肌组织中PMN增多,而IPostC可抑制PMN的活化和聚集,组织MPO活性降低。LIR后血液和心肌组织中SOD和MDA的变化提示我们,IPostC有抑制体内氧化应激反应和减轻心肌氧化损伤的作用。
在肢体反复多次的缺血-再灌注过程中,血液中内皮源性缓激肽、前列腺素I2(prostaglandin I2,PGI2)、一氧化氮(nitric oxide,NO)等可作为IPostC远隔细胞保护作用的触发器,激活细胞内蛋白激酶C(protein kinase C,PKC)、酪氨酸蛋白激酶(tyrosine protein kinase,TPK)及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等,促进终效应蛋白热休克蛋白(heat-shock protein,HSP)或ATP敏感性K+(KATP)通道磷酸化[6]。HSP控制肌动蛋白丝聚合,保证细胞骨架的完整。质膜KATP通道的开放,通过使动作电位3期复级加速而缩短动作电位时程和发生超极化,发挥心肌保护作用。此外,Sun等[7]在研究HSP72过度表达对心肌的保护作用时,检测到了锰超氧化物歧化酶(Mn-SOD)的表达增加。本实验中,血液和心肌组织中的SOD因再灌注引发的过氧化状态而过度消耗,而在IR+IPostC组,观察到了其活性的增加,与Sun等[7]的报道一致。SOD的表达增强,对自由基的清除作用加强,可能是IPostC发挥细胞保护作用的机制之一。关于肢体IPostC对远位器官保护作用的具体分子生物学机制,有待于进一步深入研究。
[1]赵利军,门秀丽,董淑云,等.L-精氨酸对大鼠肢体缺血再灌注后心肌损伤的影响[J].中国药理学通报,2008,24(6):827 -830.
[2]Zhang Y,Leng YF,Xue X,et al.Effects of penehyclidine hydrochloride in small intestinal damage caused by limb ischemia - reperfusion[J].World J Gastroenterol,2011,17(2):254-259.
[3]王 茜,邓凤君,林焕冰,等.cAMP信号分子在缺血后适应心肌保护机制中的作用[J].中国病理生理杂志,2011,27(8):1496 -1501.
[4]Skyschally A,Schulz R,Heusch G.Pathophysiology of myocardial infarction:protection by ischemia pre-and postconditioning[J].Herz,2008,33(2):88 -100.
[5]Men X,Han S,Gao J,et al.Taurine protects against lung damage following limb ischemia reperfusion in the rat by attenuating endoplasmic reticulum stress-induced apoptosis[J].Acta Orthop,2010,81(2):263 -267.
[6]Zhang QL,Sun YB,Bai B,et al.Effects of Salvia miltiorrhiza Bge.f.alba on neuronal regeneration following cerebral ischemia/reperfusion[J].Neural Regen Res,2010,5(14):1066-1070.
[7]Sun H,Guo T,Liu L,et al.Ischemic postconditioning inhibits apoptosis after acute myocardial infarction in pigs[J].Heart Surg Forum,2010,13(5):E305 - E310.

