HIF-1α在胃癌组织中的表达及其意义
(延安大学医学院,陕西延安 716000)
肿瘤细胞生长的无限性和浸润转移是肿瘤最重要的特征,也是肿瘤治疗失败导致死亡的重要原因。已有许多证据表明,肿瘤组织在有氧条件下生长缓慢,而在缺氧状态下增殖迅速。因此,肿瘤组织内是相对缺氧的。在这种缺氧状态下,肿瘤细胞不仅对放化疗的抗拒性增加,而且更具有侵袭性,易发生远处转移。其原因可能是肿瘤细胞为了适应低氧环境,在能量代谢、血管生成、糖酵解、凋亡、浸润和转移等方面产生了一系列的变化。而低氧诱导因子-1α(HIF-1α)处于肿瘤细胞缺氧的中枢位置,是启动这一系列代谢和生物学行为改变的重要因子[1]。为此,2008年1月~2009年10月,我们探讨了HIF-1α在胃癌组织中的表达及其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择延安大学附属医院经病理确诊的胃癌组织蜡块120份(胃癌组),其中患者男79例、女41例,年龄27 ~88(60.06 ±12.63)岁;组织类型:未分化和低分化82例,中分化和高分化38例;TNM分期(2003年美国癌症联合会第6版pTNM分期):Ⅰ+Ⅱ期48例、Ⅲ+Ⅳ期72例;浸润深度:T1+T239例、T3+T481例;有淋巴结转移66例,无淋巴结转移54例;有远处转移50例,无远处转移70例。所有患者术前未接受放疗及化疗。同期选择68份正常健康体检者胃黏膜组织(对照组),经病理证实为非胃癌胃黏膜。其中患者男45例、女23 例,年龄24~79(56.06 ±9.85)岁。两组性别、年龄具有可比性。
1.2 检测方法 采用免疫组织化学SP法进行HIF-1α检测。具体步骤:将石蜡包埋的标本于切片机上行4 μm连续切片,二甲苯脱蜡后,乙醇中水化,3%的过氧化氢消除内源性过氧化物酶,EDTA修复液修复,滴加HIF-1α一抗于4℃冰箱孵育过夜,PBS清洗,顺序滴加二抗及三抗孵育并清洗,然后滴加DAB显色、苏木精复染、盐酸乙醇水化,最后滴加中性树胶封片。本实验以PBS代替一抗作为阴性对照,阳性的乳腺癌切片作为阳性对照。染色结果判定:由病理科专科医生独立阅片,对照HE染色确定肿瘤细胞区域,于显微镜下计数。HIF-1α蛋白以胞质或胞核呈棕黄色细颗粒为阳性,在高倍镜下(400×)随机选择5个视野,每个视野计数200个细胞,共计1 000个,计算每张切片阳性细胞百分率,无阳性细胞为阴性(-),阳性细胞数<10%为弱阳性(+),10% ~50%为中度阳性(++),>50%为强阳性(+++)。
1.3 统计学方法 采用SPSS11.5统计软件,计数资料比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 HIF-1α在正常胃黏膜和胃癌组织中的表达HIF-1α阳性表达的黄色颗粒或棕黄色颗粒见于细胞核及胞质中,对照组胃黏膜组织中未见HIF-1α的阳性表达。见图1。胃癌组中,HIF-1α(-)35例、(+)14例、(++)41例、(+++)30例,总阳性表达率为70.83%(85/120),与对照组比较 P <0.01。
2.2 HIF-1α的表达与胃癌临床病理因素的关系见表1。

图1 HIF-1α在胃组织中的表达(SP×100)
3 讨论
胃癌的早期诊断率低、总体预后差,长期以来严重威胁着人民的生命健康。肿瘤组织微环境低氧是肿瘤发生恶性转化及转移的启动因子,也是其治疗效果差,易产生放、化疗耐受性的原因。HIF-1α是介导细胞对缺氧微环境进行适应性反应的关键性转录调控基因,是由HIF-1α及HIF-1β组成的异源性二聚体,HIF-1α是氧调节亚基,又是功能亚基,其蛋白水平和活性决定了HIF-1的活性;HIF-1β属结构亚基,在常氧和缺氧条件下均可表达,而HIF-1α在氧浓度正常时,虽然不断合成,但是很快被泛素蛋白酶体系所降解,其表达量维持在较低水平,因而很难检测到。当氧浓度降低时,HIF-1α的稳定性升高,其降解过程受到抑制,转位于核内与HIF-1β结合形成有活性的 HIF-1,转录、翻译水平则呈指数增加[2]。HIF-1作为转录因子具有广泛的靶基因谱,可调控 40 余种基因的表达[3],如 VEGF、EPO、糖酵解酶类及MDR等,其功能涉及到肿瘤血管生成、细胞增殖与凋亡调控、糖代谢、浸润转移等多方面,在肿瘤的发生、发展中起着重要作用,并且能使肿瘤细胞产生抗药性。
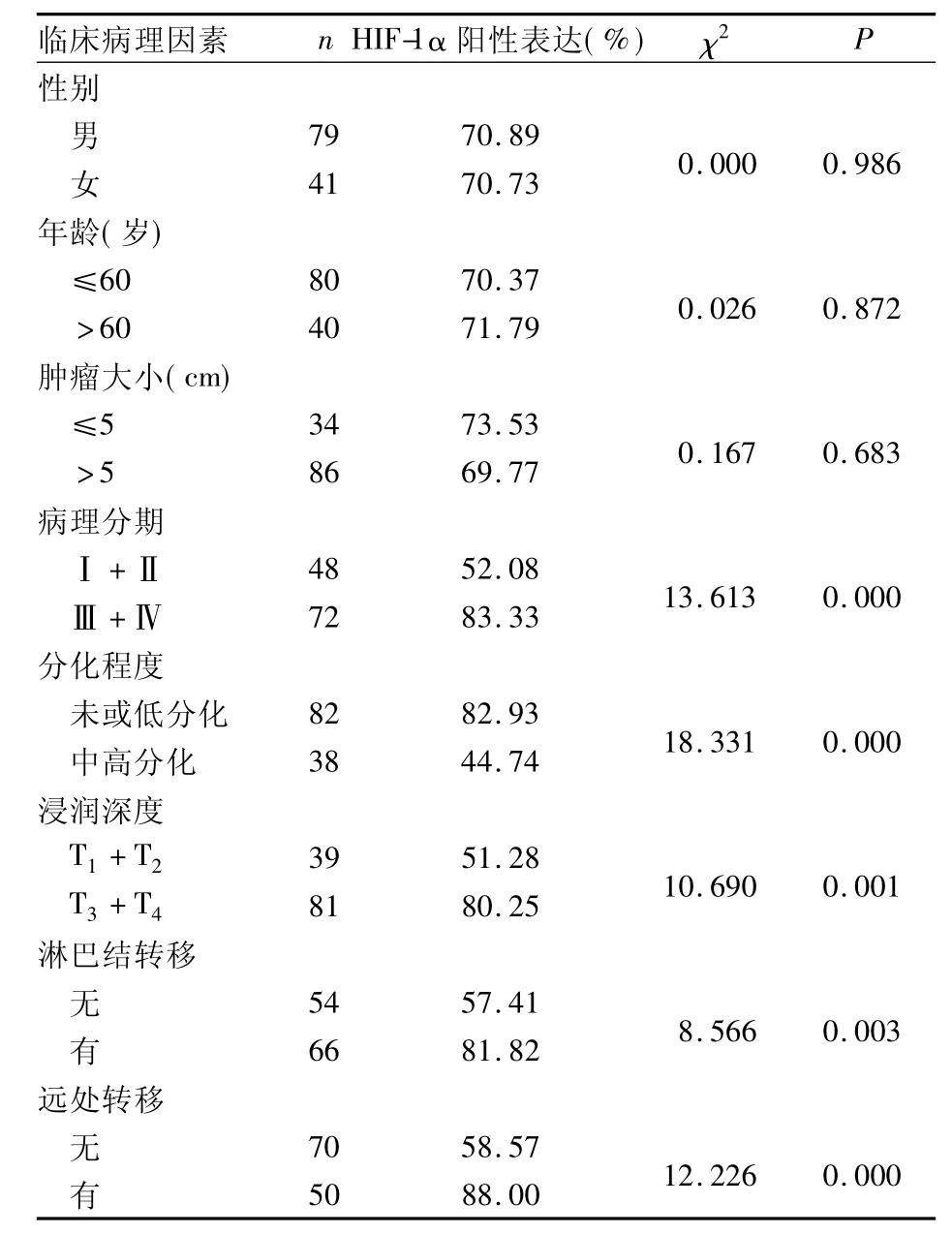
表1 胃癌组织中HIF-1α阳性表达与临床病理特征的关系
本研究应用免疫组化方法检测了HIF-1α在胃癌组织中的表达,结果显示,HIF-1α的表达见于肿瘤细胞核及细胞质中,总阳性表达率为70.83%,在正常组织中未见到表达,与Cabuk等[4]的研究结果一致,提示HIF-1α可能在胃癌的发生过程中起一定作用。此外,HIF-1α增加了p53蛋白的稳定性,通过p53介导的凋亡机制,使细胞对缺氧引起的死亡有更高的敏感性。Graeber等[5]研究证实,野生型p53的缺失与缺氧介导的凋亡明显减少有关。因此,HIF-1α可能通过p53的稳定性支持缺氧介导的凋亡。在早期肿瘤形成阶段,通过体细胞突变导致p53功能丧失和HIF-1α过表达,从而减少凋亡刺激肿瘤形成。HIF-1α在胃癌组织中的表达存在着显著的异质性,主要表现为随着胃癌分化程度的降低,其表达强度及阳性率逐渐升高,未或低分化组HIF-1α表达率明显高于中高分化组;在同一种胃癌组织内,分化较好的区域(如腺管样结构形成较多、癌细胞巢团较大等)HIF-1α的表达较弱,在分化较差的区域(如腺管样结构形成较少、癌细胞巢团小或呈弥漫分布等)其表达则较强。另外,在肿瘤坏死区周围或肿瘤近边缘区域,HIF-1α表达明显增多,与Zhong等[6]研究结果一致。由此可见,HIF-1α的表达与胃癌的演进、恶性程度高低有一定的关系。
肿瘤细胞的快速增殖必然导致肿瘤细胞处于缺氧状态而诱导HIF-1α表达,癌细胞可能通过产生过量HIF-1α的,使之适应这一缺氧环境。肿瘤细胞的快速增殖使得血管生长相对滞后,HIF-1α的表达诱导了VEGF的表达,导致肿瘤血管网的形成,这样不仅为肿瘤细胞生长带来了更多的氧和营养物质,更能为肿瘤的侵袭和远处转移带来了便利条件。研究发现,HIF-1α的表达与VEGF表达呈正相关,抑制HIF-1α的表达,肿瘤生长以及血管生成同时受抑制[4,7~9]。本研究发现,HIF-1α 的表达与肿瘤的浸润深度、TNM分期、淋巴结转移等密切相关,而这些因素恰恰是决定胃癌预后的主要指标。因此,检测HIF-1α的表达具有一定的临床意义。
[1]唐彬秩,屈艺,母得志.低氧诱导因子-1α:调节肿瘤生物学行为的关键因子[J].生命的化学,2009,29(2):184-188.
[2]Kallio PJ,Wilson WJ,O'Brien S,et al.Regulation of the hypoxiainducble transcription factor 1 alpha by the ubiquitin-proteasome pathway[J].J Biol Chem,1999,274(10):6519-6525.
[3]Semenza GL.HIF-1 and tumor progression:pathophysiology and therapeutics[J].Trends Mol Med,2002,8(4 Suppl):S62-S67.
[4]Cabuk D,Basaran G,Celikel C,et al.Vascular endothelial growth factor,hypoxia-inducible factor 1 alpha and CD34 expressions in early-stage gastric tumors:relationship with pathological factors and prognostic impact on survival[J].Oncology,2007,72(1-2):111-117.
[5]Graeber TG,Osmanian C,Jacks T,et al.Hypoxia-mediated selection of cells with diminished apoptotic potential in solid tumors[J].Nature,1996,379(6560):88-91.
[6]Zhong H,De Marzo AM,Laughner E,et al.Overexpression of hypoxia-inducible factor1 alpha in common human cancer and their metastases[J].Caner Res,1999,59(22):5830-5835.
[7]Oh SY,Kwon HC,Kim SH,et al.Clinicopathologic significance of HIF-1alpha,p53 and VEGF expression and preoperative serum VEGF level in gastric cancer[J].BMC Cancer,2008,8:123.
[8]Horree N,van Diest PJ,van der Groep P,et al.Hypoxia and angiogenesis in endometrioid endometrial carcinogenesis[J].Cell Oncol,2007,29(3):219-227.
[9]Urano N,Fujiwara Y,Doki Y,et al.Overexpression of hypoxia inducible factor-1α in gastric adenocarcinoma[J].Gastric Cancer,2006,9(1):44-49.

