HPV16 E7 siRNA表达载体对宫颈癌CaSki细胞生物学活性的影响
(1三峡大学分子生物研究所,湖北宜昌 443002;2三峡大学第二临床医学院;3湖北医药学院附属太和医院)
流行病学调查显示,高危型人乳头瘤病毒(HPV)16型感染与宫颈癌的发生有密切关系。其编码的E7蛋白与细胞转化和病毒复制的调控有关,能在宫颈癌组织内及细胞系持续表达,在维持转化组织恶性表型的过程中具有重要作用[1]。因此,以E7基因为靶点的宫颈癌基因治疗已成为研究热点。RNA干扰(RNAi)技术是一种封闭基因表达的有效方法,能通过小干扰RNA(siRNA)或小发夹RNA来介导RNAi作用[2]。2011年7月 ~2012年2月,我们探讨了HPV16 E7 siRNA表达载体对宫颈癌CaSki细胞生物学活性的影响。现报告如下。
1 材料与方法
1.1 材料 宫颈癌细胞株CaSki、载体pSilenceU6由本研究所保存。Trizol总RNA纯化试剂和LipofectamineTM2000购自 Invitrogen公司;限制性内切酶、T4连接酶及Taq DNA聚合酶均购自Fermentus公司。兔抗HPV16 E7单抗和β-acting鼠抗人多克隆抗体购自Santa cruz。RPMI 1640细胞培养基购自Sigma公司。EPICSXL-4流式细胞仪为Beckman Coulte公司产品,PCR引物合成及DNA测序由上海生工公司完成。GelLogic-200凝胶图像分析仪为美国Kodak公司产品。
1.2 方法
1.2.1 细胞培养及传代 将人宫颈癌CaSki细胞置于含10%小牛血清及1%青霉素(或链霉素)的RPMI 1640细胞培养基中,在5%CO2、37℃、80%湿度的细胞培养箱中传代培养。细胞传代方法:PBS润洗后,胰蛋白酶消化至轻拍细胞脱落;用培养液终止后转至15 mL离心管,800 r/min离心3 min,弃上清液;细胞用培养液重悬后,以1∶3的比例传代。
1.2.2 HPV16 E7特异性siRNA表达载体的构建利用 Ambion网站 siRNA Designer设计靶向HPV16 E7 siRNA靶序列,采用BLAST软件对选择的靶序列进行同源分析,从HPV16 E7 mRNA基因中选择一段19个碱基的E7特异性序列,设计1对63 bp的寡核苷酸,包括内切酶位点及茎环结构。HPV16 E7 siRNA靶序列上游引物:5'-GATCCGCAACAGTTACTGCGACGTTTCAAGAGAACGTCGCAGTAACTGTTGCTTTTTTGGAAA-3';下游引物:5'-AGCTTTTCCAAAAAAGCAACAGTTACTGCGACGTTCTCTTGAAACGTCGCAGTAACTGTTGCG-3'。对照序列中上游引物:5'-GATCCGTGACTAGCAACGTCGTACTTCAAGAGAGTACGACGTTGCTAGTCACTTTTTTGGAAA-3';下游引物:5'-AGCTTTTCCAAAAAAGTGACTAGCAACGTCGTACTCTCTTGAAGTACGACGTTGCTAGTCACG-3'。所得引物的cDNA片段克隆入经HindⅢ和BamHⅠ酶切的真核转录质粒载体pSilenceU6中。用分子克隆技术获得阳性重组质粒pSilenceU6 HPV16 E7(E7Si)以及乱码对照质粒pSilenceU6 HPV16 E7-ctl(Si)。
1.2.3 细胞转染及筛选 待CaSki细胞贴壁覆盖率70% ~90%时,将表达载体E7Si及空载体Si按LipofectamineTM2000试剂说明书分别进行转染。通过潮霉素(0.8 mg/mL)抗性筛选,转染20 d后分别得到抗性克隆细胞CaSki-E7Si及阴性对照CaSki-Si。
1.2.4 RT-PCR法检测HPV16 E7 mRNA的表达用0.8 mL Trizol试剂裂解细胞,转至无RNase的1.5 mL EP管中;加入160 μL氯仿,颠倒混匀,室温静置10 min,待两液相分层后,4℃ 12 000 r/min离心10 min,取上清液至新的EP管中;加异丙醇500 μL,颠倒混匀,室温静置10 min,4℃ 12 000 r/min离心10 min,弃上清液;加75%乙醇(DEPC水配制)1 mL,洗涤沉淀,4℃ 7 500 r/min离心5 min后,弃上清液并风干,用适量去RNase水溶解沉淀,获得细胞总RNA,经反转体系得到cDNA。再以此cDNA第1链为模板,以β-actin和HPV16 E7为引物进行PCR扩增。
1.2.5 流式细胞术鉴定克隆细胞HPV16 E7的表达 将在mRNA水平沉默较好的CaSki-E7Si以及空载的CaSki-Si细胞进行培养,待长到80% ~90%用胰酶消化分别收集细胞,各用3 mL PBS重悬,每种细胞分装到2个流式管中,每管各取1 mL再次用3.5 mL PBS 洗涤,800 r/min 离心 3 min,去上清;用0.1%TritonX-100-PBS室温处理10 min,PBS洗涤3次(2 000 r/min离心5 min),去上清;将HPV16 E7的抗体按1∶800稀释,每管中各加入100 μL,在室温下孵育30 min。用PBS洗涤3次(2 000 r/min离心5 min),将FITC标记的二抗按1∶500稀释,每管中加入100 μL,室温下避光孵育30 min。最后用PBS洗涤3次(2 000 r/min离心3 min),用500 μL的PBS重悬细胞上机检测。
1.2.6 细胞增殖的检测 分别收集处于对数生长期空载CaSki-Si和CaSki-E7Si的克隆细胞,胰蛋白酶消化后,用RPMI 1640培养液重悬,调整细胞密度为1×104/mL后接种于96孔板中,每孔100 μL。待细胞完全贴壁后,去培养液,加入100 μL MTT(200 μg/mL),置于37 ℃孵育4 h,去上清液,加入DMSO 200 μL/孔,待完全溶解后于570 nm波长处检测吸光度(OD)值,以此检测时间点作为0 h。用同样方法检测细胞培养24、48、72和96 h各时间点的OD值,以各时间点的OD值与0 h OD值的比值反映细胞生长速度。
1.2.7 流式细胞术检测细胞周期和化疗药物的敏感性 ①将空载CaSki-Si和CaSki-E7Si的克隆细胞分在6孔板中培养,待细胞长到70% ~80%用胰酶消化收集细胞,将收集的细胞存放于EP管中,用PBS混匀,2 500 r/min离心5 min,吸去上清废液,用80%的乙醇(PBS配制)4℃固定。次晨取出固定好的细胞,2 500 r/min离心5 min后吸去上清废液;再次加入PBS于EP管中混匀,2 500 r/min离心5 min后吸净废液,用500 μL含0.1%TritonX-100和50 μg/mL RNase的PBS混合液重悬细胞,然后加入0.5 mg/mL碘化丙锭90 μL,于37℃避光保温30 min;尼龙膜过滤,用流式细胞仪检测细胞周期分布情况。②将起始浓度为900 ng/mL顺铂(DDP)3倍梯度稀释3个浓度备用;待铺在6孔板中空载CaS-ki-Si和CaSki-E7Si的克隆细胞贴壁后,加入上述3个浓度的DDP培养液,再次培养48 h后收集细胞。按上述方法检测细胞周期。
1.2.8 统计学方法 采用SPSS13.0统计软件,计量资料以±s表示,结果比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 HPV16 E7 siRNA的构建 将用分子克隆技术成功筛选出的重组质粒pSilenceU6 HPV16 E7和乱码对照的pSilenceU6 HPV16 E7-ctl送上海生工测序。该重组质粒经DNA测序分析证实,重组质粒中插入的片段方向正确,碱基无突变。
2.2 克隆细胞株的鉴定 将获得的空载CaSki-Si和CaSki-E7Si的克隆细胞株放大培养后,在蛋白和mRNA水平上筛选稳定沉默HPV16 E7表达的细胞株。结果显示,在所得的阳性克隆株HPV16-E7Si中,HPV16-E7Si-1在mRNA(图1泳道3)和蛋白水平上(图2)的表达量均显著低于对照细胞株空载Si。

图1 mRNA水平鉴定HPV6 E7在克隆细胞株的表达
2.3 克隆细胞株活性的检测
2.3.1 沉默HPV16 E7基因对CaSki细胞增殖的影响 用MTT比色法检测克隆细胞株E7Si与对照Si的增殖速率。结果显示,从培养48 h开始,克隆细胞株的生长要明显慢于对照细胞Si(P<0.05),提示沉默HPV16 E7基因后抑制CaSki细胞增殖。见图3。
2.3.2 沉默HPV16 E7基因对CaSki细胞周期的影响 用流式细胞仪检测沉默HPV16 E7基因后对CaSki细胞周期的影响。结果发现,克隆细胞株E7Si凋亡峰比例明显增多(40.9%vs 7.03%,P <0.01)。
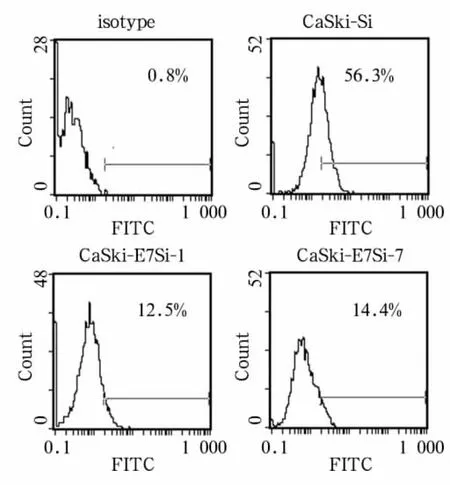
图2 流式细胞仪检测CaSki细胞中E7蛋白的沉默

图3 沉默HPV16 E7基因对CaSki细胞增殖的影响
2.3.3 沉默HPV16 E7基因后对DDP敏感性的影响 将起始浓度为900 ng/mL的DDP稀释后作用于克隆细胞E7Si和对照空载Si细胞,培养48 h后收集细胞,用流式细胞仪检测DDP对HPV16 E7基因沉默后细胞周期的影响。结果显示,克隆细胞株E7Si G0~1期细胞明显增多,阻止细胞于 DNA的合成前期,而对照Si则更多地是阻止细胞于合成期(S+G2+M)(P <0.05)。见表1、2。
表1 DDP对CaSki-E7Si细胞株细胞周期的影响(%,±s)

表1 DDP对CaSki-E7Si细胞株细胞周期的影响(%,±s)
注:与 CaSki-E7Si比较,*P <0.05
浓度 Sub G0~1 S G2+M CaSki-E7Si 40.9 ±7.11 31.0 ±3.88 5.2 ±0.64 12.5 ±1.06 DDP 900 ng/mL 5.8 ±1.73 53.0 ±6.03* 7.0 ±0.88 23.4 ±2.93*DDP 300 ng/mL 9.5 ±1.19 49.3 ±6.16* 8.0 ±1.20 21.6 ±2.79*DDP 100 ng/mL 17.1 ±1.14 36.7 ±4.59 8.1 ±1.01 17.4 ±2.08
3 讨论
宫颈癌是妇科常见恶性肿瘤之一,严重威胁妇女生殖健康和生命。研究表明,高危型HPV感染,尤其是16型和18型感染是导致宫颈癌发病的最主要因素[3,4],病毒早期基因E7可在宫颈癌组织中持续表达,并为癌组织恶性表型的维持所必需[3,5,6]。因此,抑制E7基因在宫颈癌中的过度表达,可以为宫颈癌的基因治疗提供新的线索。
表2 DDP对CaSki-Si细胞株细胞周期的影响(%,±s)

表2 DDP对CaSki-Si细胞株细胞周期的影响(%,±s)
注:与 CaSki-Si比较,*P <0.05
浓度 Sub G0~1 S G2+M CaSki-Si 7.0 ±0.58 57.5 ±7.19 6.3 ±0.84 14.6 ±1.83 DDP 900 ng/mL 6.5 ±0.61 13.6 ±2.70 35.8 ±4.48* 18.3 ±2.09 DDP 300 ng/mL 4.3 ±0.54 18.6 ±2.33 10.4 ±1.30 45.9 ±5.04*DDP 100 ng/mL 6.4 ±0.61 22.6 ±2.13 7.4 ±0.93 37.2 ±4.60*
目前RNAi技术已成为基因功能研究和抗病毒治疗的强有力工具[7,8]。本研究采用载体介导的RNAi技术观察其对宫颈癌CaSki细胞HPV16 E7基因的影响。本研究中,我们设计了一条HPV16 E7特异性Si和一条随机乱码Si作为对照,与其他核苷酸链无明显同源性,保证了该siRNA对E7基因mRNA的特异性。构建HPV早期基因E7的siRNA的真核载体,转染到CaSki细胞中,有效沉默靶基因E7的转录表达进而抑制细胞增殖,促进细胞凋亡。同时,转染的非特异siRNA对靶基因未见明显的抑制效应,进一步证实了siRNA的作用具有特异性。用脂质体直接转染的方法,简单易行,且 LipofectamineTM2000在多种细胞转染中均表现出稳定、高效、低毒的特点。上述研究结果初步表明,siRNA载入CaSki细胞的活性有可能成为治疗HPV相关肿瘤的一种新的手段,并为深入探讨E7编码基因在HPV相关肿瘤中的作用奠定了实验基础。
进一步研究发现,HPV16 E7 siRNA表达载体转染宫颈癌CaSki细胞后,凋亡明显增加;但是加用DDP作用于空载Si和HPV16 E7Si细胞株后,DDP将空载 Si的周期阻滞在 S~G2期,而将 HPV16 E7Si细胞大部分阻滞在 G0~1期,说明E7 siRNA表达载体在化疗药物的作用下能阻滞CaSki细胞由G1期进入S期。同时由生长曲线可以看出,HPV16 E7 siRNA表达载体可使CaSki细胞生长增殖减慢,而空载体却无此作用。说明E7 siRNA表达载体可抑制其细胞增殖。分析可能原因如下:①E7基因作为一种癌基因,其主要致癌机制为E7编码蛋白干扰视网膜母细胞瘤蛋白(pRb)与E2F的结合,使pRb-E2F复合物解离,E2F被游离,从而发挥其转录因子的作用,使细胞由G1期向S期转化,导致细胞调节失控,发生永生化[9];②DDP是铂的金属络合物,其主要靶点为DNA,破坏其复制而发挥细胞毒作用[10]。细胞通过2个限制点(G1/S期和G2/M期限制点)保证细胞的复制。且有研究表明,细胞周期的阻滞与细胞凋亡、分化密切相关。
综上所述,HPV16 E7 siRNA表达载体可通过有效抑制宫颈癌CaSki细胞E7基因的表达来调控肿瘤细胞周期,抑制肿瘤细胞的恶性增殖,从而部分逆转其恶性表型,并且增加了DDP的敏感性。因此,通过RNAi干扰联合化疗可为肿瘤治疗提供新的思路。
[1]Narisawa-Saito M,Kiyono T.Mechanisms of high-risk human papillomavirus-induced cervical carcinogenesis[J]. Nihon Rinsho,2009,67(1):53-61.
[2]Lee SK,Kumar P.Conditional RNAi:towards a silent gene therapy[J].Adv Drug Deliv Rev,2009,61(7-8):650-664.
[3]Sima N,Wang S,Wang W,et al.Antisense targeting human papillomavirus type 16 E6 and E7 genes contributes to apoptosis and senescence in SiHa cervical carcinoma cells[J].Gynecol Oncol,2007,106(2):299-304.
[4]江雨,李清,李健,等.闽南女性人乳头状瘤病毒感染流行病学调查分析[J].现代预防医学,2010,37(1):110-111.
[5]Wu TC.Therapeutic human papillomavirus DNA vaccination strategies to control cervical cancer[J].Eur J Immunol,2007,37(2):310-314.
[6]徐波,胡丽娜,顾美礼.人乳头状瘤病毒E6、E7原癌蛋白致癌的机制[J].国外医学:妇产科分册,2001,28(4):198-200.
[7]杨永林,黄祖瑚.RNAi的作用机制与抗病毒效应的研究进展[J].国外医学:病毒学分册,2003,10(5):135-138.
[8]牛晓宇,彭芝兰,王和.RNA干涉抑制宫颈癌 CaSki细胞株HPV16 E6 基因的研究[J].癌症,2004,23(11):1257-1262.
[9]Ledwaba T,Dlamini Z,Naicker S,et al.Molecular genetics of human cervical cancer:role of papillomavirus and the apoptotic cascade[J].Biol Chem,2004,385(8):671-682.
[10]Muggia FM.Recent updates in the clinical use of platinum compounds for the treatment of gynecologic cancers[J].Semin Oncol,2004,31(6 Suppl 14):17-24.

