黄芪多糖活化AMPK减轻游离脂肪酸对C2C12成肌细胞的细胞毒性*
宋 杰,李 静,胡阳黔,刘 坚,欧阳静萍△
(1湖北医药学院附属东风医院,2湖北医药学院,湖北 十堰 442000;3武汉大学医学院,湖北 武汉 430079)
2型糖尿病(diabetes mellitus,DM)和肥胖患者中存在脂代谢紊乱,甘油三酯、游离脂肪酸(free fatty acids,FFAs)和胆固醇均有升高。2001年美国糖尿病学会(ADA)年会上McGarry教授提出脂代谢障碍为DM及其并发症的原发病理生理改变,同时提出可将2型DM称作“糖脂病”,因此脂毒性理论越来越受到重视。脂毒性是指增高的循环游离脂肪酸浓度或增高的细胞内脂质含量的致糖尿病作用,骨骼肌是其主要作用部位之一[1]。本实验室毛先晴等[2]的研究中表明,黄芪多糖(Astragalus polysaccharide,APS)“APS治疗可明显改善高脂饮食诱导的胰岛素抵抗,而骨骼肌是胰岛素抵抗发生的重要部位。本研究旨在FFAs对骨骼肌细胞的毒性以及应用中药黄芪主要活性成分APS进行干预治疗,探讨APS对FFAs毒性的减轻作用及其可能机制。
材料和方法
1 主要试剂和仪器
C2C12成肌细胞(ATCC,批号 CRL-1771TM);低糖DMEM购自Sigma;胎牛血清购自Hyclone;优化水煎工艺从膜荚黄芪(上海药材公司)中提取APS(80~120 kD)(湖北中医学院药用植物鉴定教研室鉴定),临用前生理盐水配成12%水溶液供实验用[3];MTT购自 Sigma;AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)抗体购自Cell Sigaling Technology;磷酸化AMPK(phosphorylated AMPK,p-AMPK)抗体和磷酸化乙酰辅酶A羧化酶(phosphorylated acetyl-CoA carboxylase,p-ACC)抗体均购自Upstate;BCA Protein Assay Kit购自Pierce;蛋白内参照采用 β-actin,购自Abcam;Protein Detector Western blotting Kit LumiGLO System购自KPL;5-氨基咪唑-4-甲酰胺-1-β-D-呋喃核糖苷(5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside,AICAR)购自Toronto Research Chemicals;长链游离脂肪酸(2/1 oleate/palmitate)购自Sigma,在37℃水浴中用少量无水乙醇溶解后加入已过滤除菌的5%(质量分数)牛血清白蛋白(第Ⅴ组分,不含游离脂肪酸)溶液,充分混匀后加入低糖DMEM培养液中,长链脂肪酸终浓度为0.25 mmol/L,其中油酸和软脂酸的质量比为2∶1,无水乙醇终浓度为0.5%(体积分数)。
2 细胞传代和培养
采用小鼠成肌细胞C2C12,用含10%胎牛血清(fetal bovine serum,FBS)的低糖DMEM培养液,在5%CO2、37℃培养箱培养。
3 实验分组
取对数生长期的细胞,倒出培养液,用无菌PBS冲洗3次,0.25%胰酶消化,然后计数每个培养瓶的细胞密度,以1×109/L转入新的培养瓶,并如下分组:(1)对照组;(2)APS组;(3)AICAR组,AICAR为AMPK的特异性激动剂,此组作为AMPK活化的阳性对照组;(4)FFAs+APS组,经FFAs(0.25 mmol/L)[4-5]处理 24 h 后换成 APS(200 mg/L)作用 24 h;(5)FFAs组,经 FFAs(0.25 mmol/L)处理 24 h 后换成生理盐水(normal saline,NS)作用24 h(以与FFAs+APS对照)。
4 方法
4.1 MTT实验 (1)取生长良好的细胞,以2×107/L细胞悬液接种于96孔培养板中,每个实验组种8孔,每孔接种100 μL,培养12 h细胞贴壁后,吸弃培养液,按实验分组加入相应培养液100 μL继续培养。(2)在24 h时点的前4 h各取培养板1块,每孔加入5 mg/L MTT 50 μL,继续培养4 h后,吸弃上清液后向每孔加入20%DMSO 100μL,振荡后在酶标仪上以490 nm波长测吸光度A值。
4.2 Werstern bloting检测 将处理后的细胞,用PBS冲洗,冰上充分裂解后,置4℃超速离心机,离心,取上清液,用BCA蛋白定量试剂盒定量。煮沸5 min,SDS-PAGE分离蛋白后,转印到PVDF膜上,5%牛血清白蛋白封闭2 h,漂洗后加入Ⅰ抗于4℃孵育过夜,漂洗后再加入辣根过氧化物酶标记的鼠抗兔Ⅱ抗(1∶800稀释,KPL)室温孵育1 h,漂洗后ECL显色,用高清晰度彩色病理细胞测量程序的图形分析软件系统测出相对吸光度值。
4.3 AMP/ATP比值测定 取上述分组细胞倒出培养液,用无菌PBS冲洗3次,用0.25%胰酶消化,用无药物培养基吹打细胞,将细胞悬液1500 r/min离心10 min,弃去上清液再用PBS混悬漂洗2次,然后用0.5 mL蒸馏水将细胞沉淀混悬,移入1.0 mL匀浆器内,匀浆5 min,匀浆液移入1.5 mL离心管中,5000 r/min离心10 min,取上清液200 μL置于 -80℃待高效液相色谱法分析。色谱条件:Dikma公司ODS-3反相柱(250×4.6 mm),流动相为50 mmol/L磷酸钾缓冲液,调 pH至6.5,等比洗脱,流速1.2 mL/min,检测波长254 nm,柱温20℃,进样量20 μL。
4.4 透射电镜 C2C12细胞分对照组、FFAs组和FFAs+APS组,FFAs处理24 h分别换成NS和APS继续处理24 h,消化贴壁完好的C2C12细胞,用PBS洗2遍(离心、吹打,离心管内完成)。然后转入1.5 mL EP管内,用电镜专用的戊二醛固定2.5 h。经脱水、浸润、包埋、切片后电镜观察。
5 统计学处理
结 果
1 APS与FFAs对C2C12细胞存活率的影响
APS处理24 h后,FFAs+APS组细胞存活率明显高于FFAs组(P<0.01),见表1。
2 透射电镜观察
APS(200 mg/L)作用24 h,可显著减轻FFAs导致的线粒体肿胀、嵴消失、空泡化等损伤,见图1。
表1 APS干预对FFAs损伤C2C12细胞活性的影响Table 1.The effects of APS and FFAs on viability of C2C12 cells(A..n=8)

表1 APS干预对FFAs损伤C2C12细胞活性的影响Table 1.The effects of APS and FFAs on viability of C2C12 cells(A..n=8)
FFAs+APS:C2C12 cells were treated by FFAs for 24 h,and then treated by APS for another 24 h instead.**P <0.01 vs control group;△P <0.05 vs FFAs group(24 h,48 h).
Group 0 h 24 h 48 h Control 0.832 ±0.015 0.821 ±0.024 0.805 ±0.044 APS 0.821 ±0.077 0.833 ±0.019 0.798 ±0.053 FFAs 0.825 ±0.077 0.414 ±0.040** 0.223 ±0.041 FFAs+APS 0.845 ±0.069 0.430 ±0.029** 0.701 ±0.050△AICAR 0.829 ±0.015 0.817 ±0.042 0.799 ±0.035

Figure 1.The C2C12 cell ultrastructure(×17000).A:control group;B:FFAs group;C:FFAs+APS group;D:AICAR group;E:APS group.FFAs:free fatty acids;APS:Astragalus polysaccharide;AICAR:5-aminoimidazole-4-carboxamide-1-β-D- ribofuranoside.Arrows:vacuolar degeneration of mitochondria.图1 C2C12细胞电镜图
3 AMPK、p-AMPK和p-ACC的表达
图2显示,总AMPK表达各组间无显著差异(P>0.05);FFAs组p-AMPK及p-ACC表达较对照组显著降低(P<0.01);而FFAs+APS组p-AMPK较FFAs组显著增加(P<0.01),p-ACC表达较FFAs组显著增加(P<0.05)。
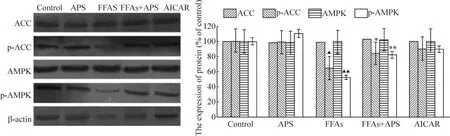
Figure 2.The expression of acetyl-CoA carboxylase(ACC),phosphorylated ACC(p-ACC),AMP-activated protein kinase(AMPK)and phosphorylated AMPK(p-AMPK)proteins..n=4.▲P<0.05,▲▲P<0.01 vs control group;*P<0.05,**P <0.01 vs FFAs group.图2 乙酰辅酶A羧化酶、磷酸化乙酰辅酶A羧化酶、腺苷酸活化蛋白激酶和磷酸化腺苷酸活化蛋白激酶蛋白的表达
4 C2C12细胞内AMP/ATP比值测定
表2显示,与 FFAs组比较,FFAs+APS组C2C12细胞经APS作用24 h后AMP/ATP比值显著增大(P<0.01)。
表2 APS干预对FFAs损伤C2C12细胞AMP/ATP比值的影响Table 2.The effects of APS and FFAs on AMP/ATP ratio of C2C12 cells(.n=8)
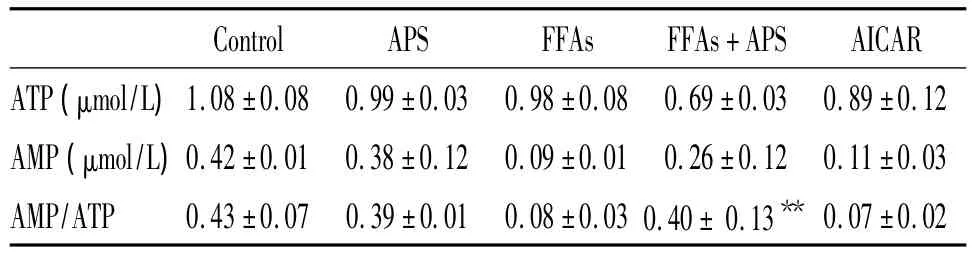
表2 APS干预对FFAs损伤C2C12细胞AMP/ATP比值的影响Table 2.The effects of APS and FFAs on AMP/ATP ratio of C2C12 cells(.n=8)
**P <0.01 vs FFAs group.
Control APS FFAs FFAs+APS AICAR ATP(μmol/L)1.08±0.08 0.99±0.03 0.98±0.08 0.69±0.03 0.89±0.12 AMP(μmol/L)0.42±0.01 0.38±0.12 0.09±0.01 0.26±0.12 0.11±0.03 AMP/ATP 0.43±0.07 0.39±0.01 0.08±0.030.40 ±0.13**0.07 ±0.02
讨 论
胰岛素抵抗是多种疾病发生的共同基础,特别是肥胖、2型糖尿病、高血脂和高血压等代谢综合征[4]。我们在前期研究中发现,无论是对STZ诱导的2型糖尿病动物模型,还是遗传性2型糖尿病模型(KKAy小鼠)或胰岛素抵抗模型,APS都具有增加胰岛素敏感性、改善糖耐量,降低血糖和血脂、减少肝脏脂肪沉积以及减轻体重等作用[6-8]。
在本研究中,MTT实验发现APS可以显著提高经高FFAs处理后的细胞的活性。由此证实,APS可以减轻高游离脂肪酸对骨骼肌细胞的毒性。
为进一步研究APS减轻FFAs细胞毒性的机制,我们通过电镜观察发现,APS可一定程度修复FFAs损伤小鼠成肌细胞C2C12线粒体。该结论与岳晓莉等[9]研究中提出的“黄芪多糖能够抑制线粒体膜电位崩解、保护线粒体形态”结论相似。
线粒体与能量代谢密切相关而AMPK是能量代谢的总开关。胰岛素抵抗状态下AMPK活性被抑制,AMPK的活化可以改善胰岛素抵抗,降低甘油三酯和 FFAs含量,减轻脂毒性[10-11]。本实验发现APS可以显著增加 FFAs损伤 C2C12细胞中 p-AMPK(AMPK活化状态)表达及 p-ACC表达。ACC为脂肪酸氧化中的关键酶,p-ACC为ACC失活状态,p-ACC增加可促进细胞脂肪酸氧化。这表明APS可以通过活化AMPK进而使ACC失活,促进细胞内脂肪酸分解,减少脂肪酸蓄积,减轻高游离脂肪酸对细胞的毒性作用。
为进一步明确APS活化AMPK的机制,我们测定了AMP/ATP比值:与干预前相比,APS可以在干预24 h后增加细胞内AMP/ATP比值。AMP/ATP比值增加,可以促进AMPK活化[12]。这可能与APS修复损伤线粒体有关。
综上所述,APS可以减轻FFAs对骨骼肌细胞的毒性。本研究为APS成为减轻FFAs毒性、改善胰岛素抵抗的药物提供了理论基础。
[1]Sivitz WI.Lipotoxicity and glucotoxicity in type 2 diabetes.Effects on development and progression[J].Postgrad Med,2001,109(4):55 -59,63 -64.
[2]毛先晴,欧阳静萍.黄芪多糖对饮食诱导小鼠肝脏胰岛素抵抗的预防作用[J].中国病理生理杂志,2007,23(11):2222-2225.
[3]倪 艳,苏 强,刘 霞,等.黄芪多糖水煎提取工艺的优化试验研究[J].中国中药杂志,1998,23(5):284-286.
[4]Grishko V,Rachek L,Musiyenko S,et al.Involvement of mtDNA damage in free fatty acid - induced apoptosis[J].Free Radic Biol Med,2005,38(6):755 -762.
[5]宋光耀,高 宇,周 宇,等.高饱和脂肪酸、高不饱和脂肪酸、高糖不同饮食诱导高血压伴胰岛素抵抗大鼠的研究[J].中国病理生理杂志,2006,22(11):2270-2273.
[6]Wu Y,Ou-yang JP,Wu K,et al.Hypoglycemic effect of Astragalus polysaccharide and its effect on PTP1B[J].Acta Pharmacol Sin,2005,26(3):345-352.
[7]Wu K,Ouyang J,Wu Y,et al.Insulin sensitization and anti-obesity effects of astragalus polysaccharide on high fat diet- fed C57BL/6J mice[J].FASEB J,2006,20(5):A1146.
[8]Mao XQ,Wu Y,Wu K,et al.Astragalus polysaccharide reduces hepatic endoplasmic reticulum stress and restores glucose homeostasis in a diabetic KKAy mouse model[J].Acta Pharmacol Sin,2007,28(12):1947-1956.
[9]岳晓莉,李 萍,刘 欣,等.黄芪多糖对过氧化氢刺激皮肤成纤维细胞中线粒体和溶酶体的保护作用[J].中国病理生理杂志,2008,24(4):777-782.
[10]Favero CB,Mandell JW.A pharmacological activator of AMP-activated protein kinase(AMPK)induces astrocyte stellation[J].Brain Res,2007,1168:1 -10.
[11]Horie T,Ono K,Nagao K,et al.Oxidative stress induces GLUT4 translocation by activation of PI3-K/Akt and dual AMPK kinase in cardiac myocytes[J].J Cell Physiol,2008,215(3):733-742.
[12]Uotani S,Abe T,Yamaguchi Y.Leptin activates AMP -activated protein kinase in hepatic cells via a JAK2-dependent pathway[J].Biochem Biophys Res Commun,2006,351(1):171-175.

