Smad4对小鼠眼睑发育的影响
刘 瑛,顾欣祖,LU Michael,DING Chuanqing
(1中山大学中山眼科中心,国家重点眼科学实验室,广东 广州 510060;2Department of Ophthalmology and Doheny Eye Institute;3Department of Cell and Neurobiology,Keck School of Medicine,University of Southern California,Los Angeles,CA 90033,USA)
哺乳类动物其眼睑的发育源自表皮外胚层及其下的眼周中胚层,包括眼睑特质化、生长、闭合及重开4个连续的过程。小鼠眼睑的特质化始于E9.0,此时转录因子Foxl2表达,确定眼睑相对于眼球的位置[1]。在E11.5,背侧及腹侧的眼周外胚层内陷,形成所谓的眼睑褶(eyelid fold),此后到E15.5,两侧的眼睑褶开始相向生长,形成上下睑。在E15.5左右,上下睑缘的外表皮层开始向角膜方向延伸,最终于E16.5左右汇合并融合。上下睑在生后12 d左右开始分离,大约2 d 后眼睑重新睁开[2-3]。
眼睑的闭合和重开是所有哺乳类动物的必经之路,眼睑的正常闭合与开放对于角结膜的发育及维持眼表的健康至关重要,当眼睑的生长或融合发生缺陷时,便可出现眼睑在出生时保持开放状态(eye open at birth,EOB),眼睑的闭合涉及到很多基因和信号通路的调控,这些因素的破坏或改变可能都会引起EOB的发生[4]。我们通过对Smad4条件性基因敲除小鼠的研究发现,该基因敲除鼠除了具有小眼球的表型之外也出现了EOB的表型,因此我们进行了更进一步的研究,试图更深入探讨Smad4对眼睑闭合的影响及其可能的调控机制。我们所采用的Smad4条件性基因敲除鼠借助Cre/LoxP系统,通过Pax6引导的Cre转基因表达产生的Cre重组酶介导靶基因Smad4两侧的LoxP间发生切除反应,从而获得特定于眼部某些组织包括眼睑的Smad4的敲除,以便观察Smad4对于某些特定组织器官发育的影响。
材料和方法
1 动物
所用动物遵循眼及视觉科学研究动物使用声明。Smad4fl/fl小鼠由美国南加州大学Dr.Xun Xu实验室提供,Pax6启动子控制下的Le-Cre转基因小鼠来自美国华盛顿大学Dr.David Beebe实验室,ROSA26报告基因小鼠R26R品系购自Jackson。Le-Cre的小鼠与 Smad4fl/fl小鼠交配产生 Le-Cre/Smad4fl/+小鼠,Le-Cre;Smad4fl/+小鼠继而再与Smad4fl/fl小鼠交配产生 Le-Cre/Smad4fl/fl小鼠,即我们所需要的条件性Smad4基因敲除小鼠——Smad4 CKO小鼠。Smad4fl/fl小鼠作为对照,即Smad4野生鼠(Smad4 WT)。胎龄以阴部栓子的检查为基础确定,该日中午12点为孕0.5,记为E0.5。
2 方法
2.1 组织学检查 于解剖显微镜下获取适当胎龄的小鼠胚胎观察其眼睑变化并拍照,随后于4%多聚甲醛中4℃固定过夜。梯度乙醇脱水,石蜡包埋,切片7.5 μm厚,常规HE染色观察形态学。
2.2 免疫组化 石蜡切片常规脱蜡至水,10 mmol/L枸橼酸钠缓冲溶液(pH6.0)微波抗原修复,3%甲醇-过氧化氢溶液室温下孵育10 min阻断内源性过氧化物酶,5%BSA/0.1%Triton X-100室温阻断30 min,抗小鼠 I抗[Smad4、phalloidin(Invitrogen);表皮生长因子受体(epidermal growth factor receptor,EGFR,1∶100),c - Jun(1∶100)、p - c - Jun(1∶100,Cell Signaling)]4℃过夜孵育;再用荧光Ⅱ抗(Jackson Immunoresearch)或者 Histostain SP Broad Spectrum(HRP)试剂盒(Invitrogen)并以DAB(Zymed)显色。
2.3 肌动蛋白的检测 铺片及切片染色采用E15.5眼睑组织或切片,与荧光I抗Alexa Fluor 568 phalloidin(Invitrogen)4℃过夜孵育,封片后镜检。
2.4 BrdU标记 (1)配制 BrdU溶液10 g/L,取特定孕期小鼠,称重,按100 μg BrdU/g BW腹腔注射,1 h后解剖显微镜下取胚胎,Carnoy(30%氯仿,10%冰醋酸,60%甲醛)固定液固定过夜;(2)切片经二甲苯与梯度乙醇脱蜡至水,PBST浸洗;(3)3%过氧化氢室温孵育10 min,PBST浸洗3次,每次5 min;(4)20 mg/L的蛋白酶K于37℃消化18~20 min,PBST浸洗3次,每次5 min;(5)1 mol/L HCl中37℃变性45 min,PBST浸洗3次,每次5 min;(6)Cas block阻断液孵育30 min,PBST浸洗3次,每次5 min;(7)抗BrdU I抗室温孵育1 h,PBST洗3次,每次5 min;(8)余步骤同常规免疫组化。
2.5 TUNEL染色 (1)石蜡切片脱蜡至水;(2)蛋白酶K室温下孵育10 min;PBST洗2次每次5 min;(3)取100 μL标记液用于阴性对照,按1∶9取标记液和酶液混匀成TUNEL反应液,切片以反应液37℃水浴温箱避光孵育1 h;PBST洗3次,每次5 min;(4)DAPI工作液孵育3~5 min,PBST洗3次,每次5 min;(5)透明封片剂封片,荧光显微镜下观察并照相。
结 果
1 Le-Cre条件性Smad4基因敲除鼠眼睑上皮的延伸受损
在E14.5,两者都表现为同样的眼睑开放及外形,无明显的形态学差别,见图1 A1、B1。从E15.5后,两者眼睑表型出现显著差别。在野生型小鼠胚,上下睑缘出现突起,并从突起处开始向相对方向延伸移行,并最终融合,见图 1 C1、E1、G1、G2。相比之下,变异型小鼠自始至终其睑缘上皮未见延伸,上下睑缘也一直未见闭合,眼表一直处于暴露状态,见图1 D1、F1、H1、J1。该结果也暗示变异小鼠的 EOB表型是因为眼睑未能闭合造成,而不是过早的眼睑开放。
在E14.5左右的野生鼠胚,眼睑上皮仅由1层基底细胞构成,见图1 A2,在E15.5左右因为基底细胞的增殖和分化而形成多层结构,此后上下眼睑的上皮层自其尖端相对移行,两上皮层在眼表中央相遇而最后融合在一起,见图1 C2、E2、G2、I2。E14.5的变异鼠胚眼睑的形态学与同龄野生鼠胚相比并无显著差异,见图1 B2,而且在E15.5其眼睑上皮也增厚而形成多层结构,但其眼睑上皮层一直未出现延伸,直到出生,其眼睑始终处于开放状态,见图1 D2、F2、H2、J2。

Figure 1.Histological and morphological changes of embryonic eyelids in Smad4 CKO mice(HE,×200).A1,A2:in wild-type embryos at E14.5,upper and lower eyelids kept seperated,and the eyelid epithelium comprised a single layer of basal cells;B1,B2:mutant eyelids at E14.5 appeared similar to wild-type eyelids;C1,C2:at E15.5,eyelid epithelium in wild-type embryos became multilayered and the eyelid epithelial sheet started to extend from both top and bottom eyelid tips;D1,D2:at E15.5,eyelid epithelium in mutant embryos became multilayered but epithelial sheet didn't extend;E1,E2:at E16.0,the eyelid epithelial sheet in wild-type embryos continued to extend,meet and cover the ocular surface;F1,F2:at E16.0,no extension of epithelial sheet was observed;G1,G2:at E16.5,top and bottom eyelids almost fused;H1,H2:no migration of eyelid epithelium was observed;I1,I2:eyelid closure in wild - type newborn;J1,J2:eyelids remained open in mutant newborn.图1 变异小鼠胚胎眼睑的组织形态学改变
2 Le-Cre条件性Smad4基因敲除鼠眼睑上皮细胞内肌动蛋白束形成受损
结果显示在野生型眼睑上皮中观察到明显的F肌动蛋白束,位于眼睑上皮层的进行缘,呈环形包绕眼睑边界,见图2 A、B。相反,在变异型其眼睑上皮前缘未能检测到此种F肌动蛋白纤维,见图2 C、D。眼睑冰冻切片的phalloidin染色也显示,野生型在其眼睑上皮层的各层细胞内均有显著的F肌动蛋白染色,见图2 E,而在变异型中很少有该肌动蛋白的装配,见图2 F。这些结果显示在Smad4基因敲除鼠胚中,眼睑未能闭合是因为眼睑上皮内肌动蛋白束的装配缺陷所致。
3 Smad4为c-Jun磷酸化及EGFR核转位所必需
E15.5的野生小鼠胚眼睑,c-Jun染色存在于睑缘细胞胞核,见图3 A,p-c-Jun染色亦呈强阳性,见图3 C,而变异小鼠有着类似的c-Jun染色模式,见图3 B,但p-c-Jun染色明显变弱,而且染色细胞显著减少,仅有少数靠近睑结膜的细胞染色阳性,见图3 D。EGFR染色显示,在Smad4野生小鼠,EGFR主要存在于睑缘细胞细胞核内,见图3 E,而在Smad4变异小鼠,EGFR染色出现在睑缘细胞的核周胞浆,见图3 F。我们推测,Smad4在c-Jun的完全活化中起了重要的作用,Smad4的缺失导致其磷酸化过程受损,而无法发挥其足够的转录因子功能;同时受损的还有 EGFR的核转位,因此可能Smad4在EGF信号通路中也发挥了一定的作用。
4 Le-Cre条件性Smad4基因敲除鼠眼睑闭合不能与细胞增殖或凋亡无关
在E15.5,TUNEL标记的凋亡细胞在野生型和变异小鼠眼睑睑缘无明显差别,见图4A、B、C、D,E14.5的BrdU标记在两者间也相似,见图3 E、F,因此可推测Smad4的缺失导致的眼睑闭合不能不涉及细胞增殖的减少或细胞死亡的增加。

Figure 2.Absence of F - actin surrounding the mutant eyelids.A,B:whole mount phalloidin staining of eyelids from a wild-type embryo at E15.5 showed F-actin bundles(white arrowheads)projecting latitudinally around the edge of the eyelids(black arrows);C,D:the F-actin bundles were not present in the eyelids of the Smad4 CKO mutant;E:phalloidin intensely interacted with F-actin in the eyelid epithelium(arrowheads)of the wild-type embryo;F:F-actin bundles were not detected in the eyelid epithelium of the mutant embryo.Scale bar:100 μm.图2 肌动蛋白在变异眼睑的缺失
讨 论
胚胎发育中眼睑的闭合通过上皮细胞移行来实现,而眼睑上皮细胞形态的改变,以及眼睑上皮内肌动蛋白应力纤维和丝足的形成这些都是上皮细胞移行的关键特征[5]。上皮移行一旦受损,将会导致EOB的发生。

Figure 3.Immunohistochemical staining of eyelids(×400).A,B:strong nuclear staining for c-Jun in the eyelids of wild-type(A)and mutant(B)embryos at E15.5,no difference was observed;C,D:staining for embryo:in the Smad4 wild-type embryo,strong nuclear staining was observed in majority of epithelial cells in eyelids(C),but only a few cells were stained in Smad4 CKO embryo;E,F:staining for EGFR:in the wild - type embryo,staining was found in the nuclei.Perinuclear staining was observed in the eyelid of mutant embryos with weaker immunoreactivity.Scale bar:100 μm.图3 眼睑免疫组化染色
基因敲除技术的发展为人们探寻眼睑闭合的机制提供了一个良好的工具,借此也发现了很多基因敲除鼠可导致EOB表型,如纤维生长因子10(fiber growth factor 10,FGF10)及其受体 FGFR2(fiber growth factor receptor 2)、激活素 β -B、MEK激酶1(MEKK1)、c-Jun N末端激酶(c-Jun N-terminal protein kinase,JNK)、c- Jun、EGFR 家族成员的 HB-EGF(heparin-binding EGF-like growth factor)和转化生长因子 α(transforming growth factor α,TGF-α)及其受体EGFR(epidermal growth factor receptor)、叉头转录因子 Foxc1及 Foxc2、骨形态形成蛋白(bone morphogenetic protein,BMP)I型受体、BMP 相关的 R - Smads、Wnt拮抗剂 Dkk2 等[4,6-21],这些信号分子基本上归属于3个信号通路:TGFβ/激活素-MEKK1-JNK/p38信号通路、TGFα/EGFR-ERK信号通路及经典的BMP信号通路,因此目前已经明确胚胎眼睑闭合至少需要3个信号通路的调控,涉及到众多的基因,这些基因或信号通路的破坏或改变都可能会引起EOB的发生,普遍认为FGF10是眼睑发育的始动因素,通过调控激活素 β-B、TGFα/HB-EGF以及BMP信号通路来控制眼睑上皮的增生和移行,从而确保眼睑的适当发育[4]。
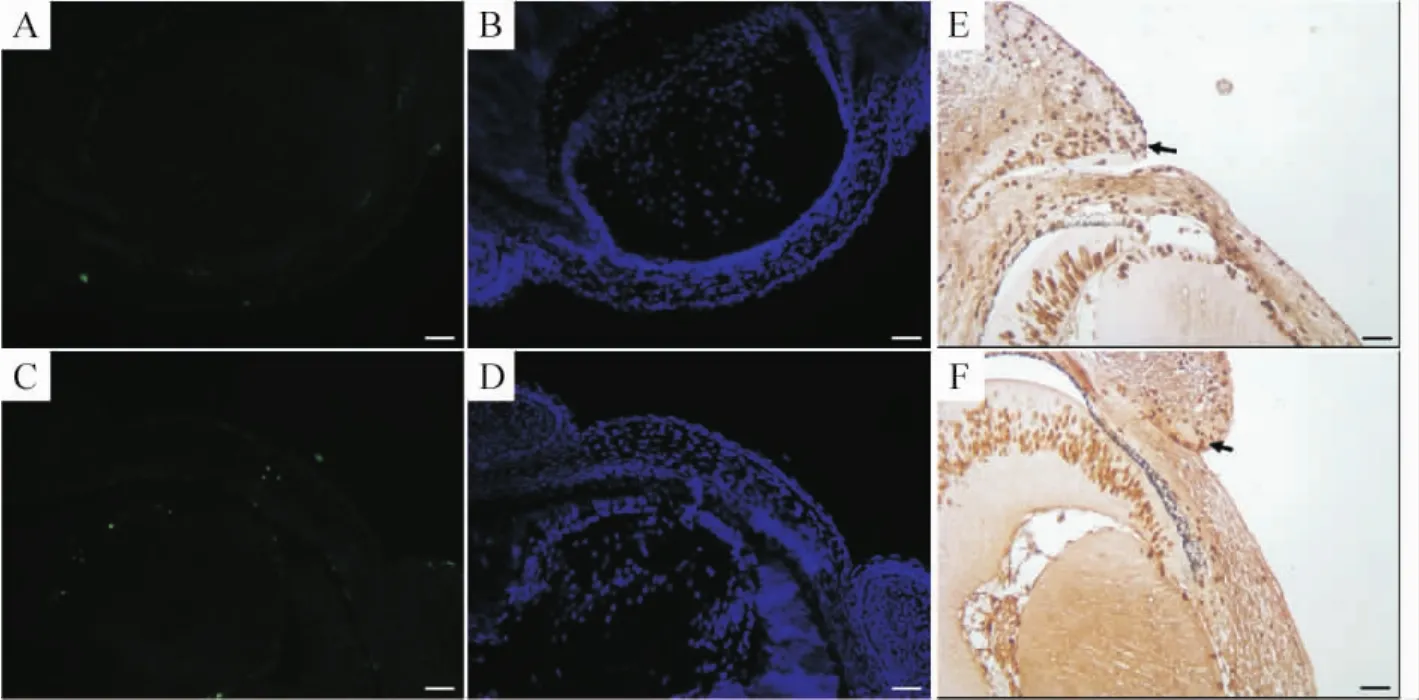
Figure 4.TUNEL staining and BrdU labeling of eyelids(×400).TUNEL staining in the eyelid epithelium of Smad4 wild-type(A,B)and CKO(C,D)embryos at E15.0 showed no difference in the number of apoptotic cells.BrdU labeling in the eyelid epithelium of Smad4 wild-type(E)and CKO(F)embryos at E14.5 also showed no difference in the number of BrdU-labeled cells.Scale bar:100 μm.图4 眼睑凋亡染色及BrdU标记
有研究表明,在眼睑发育过程中,眼睑间质内的FGF10向眼睑外胚层发出信号,后者增殖并动员表皮生长因子(epidermal growth factor,EGF)和激活素(activin)信号通路,而后再激活ERK或MEKK1-JNK信号级联通路,从而控制细胞骨架的重组,如诱导肌动蛋白丝形成肌动蛋白束像压力纤维(stress fiber),这种纤维在推动上皮层的运动中起主要作用,因此在眼睑的融合过程中,肌动蛋白重组是眼睑融合过程中细胞迁移所必需而且关键的一个细胞活动[4-5]。我们的结果提示在 Smad4基因敲除鼠胚中,眼睑未能闭合是因为眼睑上皮内肌动蛋白束的装配缺陷所致。
c-Jun是眼睑闭合的关键调控因素,其磷酸化不仅为BMPs信号通路和TGFβ/激活素-MEKK1-JNK信号通路所必需,而且对于TGFα/EGFR-ERK信号通路的激活有诱导作用,在眼睑闭合的分子机制中不可或缺[4-7]。Huang 等[4]在他们最新的研究中发现,FGF调控的BMP信号通路在眼睑闭合中发挥必需的作用,他们的结果提示BMPs通过经典的R-Smad/Smad4通路,与激活素 β-B通路共同促进c-Jun的最大磷酸化并介导磷酸化p-c-Jun的核转位,同时该信号通路还激活了眼睑闭合所必需的转录因子Foxc1和Foxc2的表达,从而调控眼睑发育的闭合过程。他们还认为FGF调控的TGF α通路与BMP信号通路之间也存在偶合,且激活素 β-B,TGFα/HB -EGF,音猬因子(Sonic Hedgehog,Shh)以及BMP信号通路形成了一个复杂的调控网络,确保睑缘上皮细胞的适当迁移和融合。
与Huang等的研究类似,我们也在Le-Cre特异性Smad4基因敲除鼠中观察到了EOB表型,这种EOB表型并非是眼睑的过早开放,也与细胞增殖或细胞凋亡的异常无关,而是Smad4在眼睑上皮细胞失活后,眼睑上皮细胞肌动蛋白束合成缺陷,上皮细胞移行受影响,从而导致了眼睑融合缺陷。我们也发现Smad4对c-Jun磷酸化有影响,但并不影响c-Jun本身的核表达。与Huang等发现p-c-Jun在Smad4变异小鼠眼睑上皮细胞核周表达不同,我们发现虽然磷酸化c-Jun的表达明显降低,阳性细胞数减少,但其表达仍存在于少数细胞核内,这意味着磷酸化c-Jun的核转位并未受到影响,仅Smad4失活不足以完全抑制c-Jun磷酸化,应该存在其它信号通路调控c-Jun的磷酸化,这与Zhang等[21]的研究结果相似,他们认为c-Jun的磷酸化和功能部分依赖于激活素β-B的非Smads依赖信号通路,同时也与眼睑融合受多个信号通路调控相吻合。我们还观察到EGFR在Smad4变异小鼠眼睑上皮的表达发生改变,Smad4失活后,EGFR未能出现在核内,而是位于核周胞浆,且表达减弱。有研究发现,在眼周皮肤的移行中,EGF家族成员通过激活ERK信号通路而促进眼周皮肤的移行,而EGF级联上游的c-Jun 磷酸化可上调 EGFR - ERK 通路[5,21];Li等[6]及Zenz等[7]的研究又表明,c-Jun在表皮的失活可影响EGFR信号通路的激活,因此我们推测Smad4的失活可能也同时影响了EGFR信号通路,亦或与c-Jun磷酸化改变有关,而且Smad4可能不止在控制眼睑闭合的某一个信号通路中起信号转导作用,而是介入了多个信号通路,从而调控肌动蛋白应力纤维的装配和眼睑上皮的移行。
眼睑发育的调控是一个相当复杂的过程,涉及众多信号通路,构成一个复杂的网络,需要进一步的研究来完全阐明这些通路的功能及相互作用,这些研究不但有利于我们对眼睑融合更全面的认识,而且对于我们理解其它依赖于上皮融合的形态学发生如神经管、视裂、晶体泡及颚架也大有裨益,同时对于寻找上皮性损伤的修复机制及治疗手段有所借鉴。
[1]Swindell EC,Liu C,Shah R,et al.Eye formation in the absence of retina[J].Dev Biol,2008,322(1):56 -64.
[2]Findlater GS,McDougall RD,Kaufman MH.Eyelid development,fusion and subsequent reopening in the mouse[J].J Anat,1993,183(Pt 1):121 -129.
[3]Kaufman MH.The atlas of mouse development[M].1st ed.London:Academic Press,2002.525.
[4]Huang J,Dattilo LK,Rajagopal R,et al.FGF -regulated BMP signaling is required for eyelid closure and to specify conjunctival epithelial cell fate[J].Development,2009,136(10):1741-1750.
[5]Xia Y,Kao WWY.The signaling pathways in tissue morphogenesis:a lesson from mice with eye-open at birth phenotype[J].Biochem Pharmacol,2004,68(6):997 -1001.
[6]Li G,Gustafson-Brown C,Hanks SK,et al.c-Jun is essential for organization of the epidermal leading edge[J].Dev Cell,2003,4(6):865 -877.
[7]Zenz R,Scheuch H,Martin P,et al.c-Jun regulates eyelid closure and skin tumor development through EGFR signaling[J].Dev Cell,2003,4(6):879 -889.
[8]Gage PJ,Qian M,Wu D,et al.The canonical Wnt signaling antagonist DKK2 is an essential effector of PITX2 function during normal eye development[J].Dev Biol,2008,317(1):310-324.
[9]Kidson SH,Kume T,Deng K,et al.The forkhead/winged-helix gene,Mf1,is necessary for the normal development of the cornea and formation of the anterior chamber in the mouse eye[J].Dev Biol,1999,211(2):306-322.
[10]Kume T,Deng KY,Winfrey V,et al.The forkhead/winged helix gene Mf1 is disrupted in the pleiotropic mouse mutation congenital hydrocephalus[J].Cell,1998,93(6):985-996.
[11]Li C,Guo H,Xu X,et al.Fibroblast growth factor receptor 2(Fgf2)plays an important role in eyelid and skin formation and patterning[J].Dev Dyn,2001,222(3):471-483.
[12]Luetteke NC,Qiu TH,Peiffer RL,et al.TGF alpha deficiency results in hair follicle and eye abnomalities in targeted and waved -1 mice[J].Cell,1993,73(2):263 -278.
[13]Luetteke NC,Phillips HK,Qiu TH,et al.The mouse waved-2 phenotype results from a point mutation in the EGF receptor tyrosine kinase[J].Genes Dev,1994,8(4):399-413.
[14]Miettinen PJ,Berger JE,Meneses J,et al.Epithelial immaturity and multiorgan failure in mice lacking epidermal growth factor receptor[J].Nature,1995,376(6536):337-341.
[15]Mine N,Iwamoto R,Mekada E.HB-EGF promotes epithelial cell migration in eyelid development[J].Development,2005,132(19):4317 -4326.
[16]Smith RS,Zabaleta A,Kume T,et al.Haploinsufficiency of the transcription factors FOXC1 and FOXC2 results in aberrant ocular development[J].Hum Mol Genet,2000,9(7):1021-1032.
[17]Takatori A,Geh E,Chen L,et al.Differential transmission of MEKK1 morphogenetic signals by JNK1 and JNK2[J].Development,2008,135(1):23 - 32.
[18]Tao H,Shimizu M,Kusumoto R,et al.A dual role of FGF10 in proliferation and coordinated migration of epithelial leading edge cells during mouse eyelid development[J].Development,2005,132(14):3217 -3230.
[19]Vassalli A,Matzuk MM,Gardner HA,et al.Activin/inhibin βB subunit gene disruption leads to defects in eyelid development and female reproduction[J].Genes Dev,1994,8(4):414-427.
[20]Weston CR,Wong A,Hall JP,et al.The c-Jun NH2-terminal kinase is essential for epidermal growth factor expression during epidermal morphogenesis[J].Proc Natl Acad Sci USA,2004,101(39):14114-14119.
[21]Zhang L,Wang W,Hayashi Y,et al.A role for MEK kinase 1 in TGF-beta/activin-induced epithelium movement and embryonic eyelid closure[J].EMBO J,2003,22(17):4443-4454.

