小鼠早期完整胚胎诱导子宫内膜白血病抑制因子和整合素β3表达并提高子宫容受性*
李婷婷, 方 丛, 贾 磊, 岳超敏
(中山大学附属第六医院生殖医学研究中心,广东 广州 510655)
1000-4718(2012)02-0193-08
2011-08-17
2011-12-14
国家自然科学基金资助项目(No.81070495);广东省自然科学基金资助项目(No.9151018201000018)
△通讯作者 Tel:020-38048013;E-mail:qingqingwenyuan@126.com
·论著·
小鼠早期完整胚胎诱导子宫内膜白血病抑制因子和整合素β3表达并提高子宫容受性*
李婷婷, 方 丛△, 贾 磊, 岳超敏
(中山大学附属第六医院生殖医学研究中心,广东 广州 510655)
目的探讨小鼠早期胚胎诱导子宫内膜容受性改变的空间结构,确定胚胎各个部分能否引起子宫内膜容受性中白血病抑制因子(LIF)和整合素β3改变。方法选用6~8周昆明雌鼠,体外实验分为子宫内膜培养前组、子宫内膜单纯培养组、子宫内膜全胚胎共培养组、子宫内膜卵裂球共培养组、子宫内膜透明带共培养组,各组培养2 d后收集子宫内膜行下一步检测;体内实验分为胚胎移植前组、单纯培养液移植组、全胚胎移植组、卵裂球移植组、透明带移植组及正常妊娠未干预组,移植后2 d收集子宫内膜行下一步检测。荧光定量PCR检测整合素β3和LIF mRNA表达;免疫组织化学及Western blotting检测整合素β3和LIF的蛋白表达部位及表达水平。结果体外实验子宫内膜全胚胎共培养组中子宫内膜的整合素β3和LIF表达显著高于其它组,体内实验正常妊娠未干预组的整合素β3和LIF表达显著高于其它组。结论完整胚胎可显著提升小鼠孕早期子宫内膜容受性因子整合素β3和LIF的表达,而单纯透明带或卵裂球则不能明显增加整合素β3和LIF的表达。早期胚胎诱导子宫内膜容受性可能需要完整胚胎结构的存在。
胚胎; 整合素β3; 白血病抑制因子; 子宫内膜容受性
自1978 年世界首例试管婴儿在英国诞生以来,在30多年来,人类辅助生殖技术取得了突飞猛进的发展,有各种理念的革新和技术进步,然而目前辅助生殖技术的成功率仍不能达到人们期望值,部分患者反复多次体外受精-胚胎移植(invitrofertilization-embyro transfer,IVF-ET)仍不能成功妊娠。胚胎植入是一个极其复杂的过程,需要正常发育胚胎和有良好容受性子宫内膜的共同作用,以及二者同步发育和分子水平的对话[1],胚胎种植受多方面因素控制,包括胚胎质量、子宫内膜容受性、胚胎移植技术等[1],其中因子宫内膜容受性差而致的胚胎种植失败占失败因素的60%[2]。国外学者研究发现患者子宫内膜上皮与植入前胚胎共培养可促使胚胎正常发育并提高胚胎与子宫内膜上皮间分子层面对话,从而提高IVF-ET成功率[3-4],此技术对反复IVF-ET失败的助孕患者尤其有宜[3,5],并且Wakuda等[6]小鼠体内实验推测胚胎亦能诱导子宫内膜容受性增加。综上,提高妊娠率的关键在于如何提高子宫内膜容受性。目前认为子宫内膜容受性生物标志有细胞因子、黏附分子、生长因子、脂类等[2],其中最具代表因子有白血病抑制因子(leukaemia-inhibitory factor,LIF)和整合素β3。虽证实早期胚胎与着床期子宫内膜共培养可提高子宫内膜容受性,从而提升妊娠率,但其具体机制尚未明朗,并且亦不清楚具体是胚胎哪一部分发挥了主要作用。本研究旨在通过体内外实验探讨胚胎的各部分包括透明带、卵裂球及完整胚胎在诱导子宫内膜容受性中的作用,以期为临床所用。
材 料 和 方 法
1材料
1.1动物 清洁级昆明小鼠,6~8周,体重25~35g,由中山大学动物中心提供,实验动物合格证号为0083643。
1.2主要仪器和试剂 孕马血清促性腺激素(pregnant mare serum gonadotrophin,PMSG) 和人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG) (宁波激素制品厂);扫描电镜系统(Quanta200)、解剖镜及倒置显微镜 (Nikon)、 二氧化碳孵箱 (Thermo Forma)、Mini-Protein电泳系统(Bio-Rad)、ABI 3900台式高通量DNA合成仪(ABI),ABI 7500全自动荧光定量PCR仪(ABI)、RNA提取试剂盒(Bio-Rad)、RT-PCR 试剂盒(Toyobo)、荧光定量PCR试剂盒(Toyobo);DMEM/F12 (1∶1)培养基(Sigma)、M2培养基(Sigma)、FBS (Gibco) 、雌二醇(estradiol,E2) 及孕激素(progestogen,P4) (Sigma) 、胰岛素 (Sigma) 、表皮生长因子(epidermal growth factor,EGF)(Promega) 、acidic Tyrode’s solution (Sigma);PVDF膜(Millipore)、整合素β3Ⅰ抗、LIF Ⅰ抗、β-actin、Ⅱ抗(Santa Cruz);其它试剂除国产分析纯主要购自Sigma。
2方法
2.1小鼠促排卵 制备输精管结扎公鼠;小鼠腹腔注射孕马血清促性腺激素10 U,46~48 h后注射人绒毛膜促性腺激素10 U,造成超排卵,然后雌雄按2∶1合笼,次晨检查阴拴,发现阴栓为妊娠第1 d;一部分与正常公鼠合笼以获得2细胞胚胎,一部分与绝育公鼠合笼以获得假孕和代孕母鼠。
2.2小鼠子宫内膜和胚胎获取及共培养 母鼠与正常公鼠合笼见栓后第2 d上午在无菌条件下迅速取出小鼠输卵管,收集2细胞期胚胎,对胚胎进行相应处理,利用acidic Tyrode’s solution消化透明带获无透明带卵裂球,显微机械操作吸出卵裂球获空透明带,无菌条件下取出子宫内膜,挤压法[7]获得子宫内膜,剪成2 mm左右的小段,即随即分为以下5组:(1)第2 d的子宫内膜;(2)单独子宫内膜;(3)完整胚胎+子宫内膜;(4)无透明带卵裂球+子宫内膜;(5)空透明带+子宫内膜,每组10例标本。子宫内膜与胚胎各部分共培养:共培养条件类似谭冬梅等[8]的研究,并在此基础上进行了改善,将子宫内膜、胚胎处理后随机共培养于约30 μL微滴的培养液中[DMEM/F12 (1∶1) + 200 mL/L FBS,添加 17.5 nmol/L胰岛素、63.5 nmol/L P4、7.14 nmol/L E2、20 μg/L EGF],在 37 ℃、饱和湿度、5%CO2浓度培养箱内,每天观察胚胎发育,2 d后取出子宫内膜行荧光定量PCR、免疫组织化学、Western blotting和扫描电镜检测,每组10例标本。
2.3体内移植 正常妊娠小鼠第2 d上午在无菌条件下迅速取出输卵管,收集2细胞期胚胎,对胚胎进行相应处理,利用acidic Tyrode’s solution消化透明带,获无透明带卵裂球,显微机械操作吸出卵裂球获空透明带,分别移植入代孕母鼠输卵管子宫连接部内,随机分为以下6组:(1)假孕母鼠第2 d子宫;(2)移植5 μL培养液;(3)移植完整胚胎;(4)移植无透明带卵裂球;(5)移植空透明带;(6)与正常公鼠合笼后正常妊娠,每只代孕母鼠每侧宫角移植3枚胚胎或每侧移植5 μL培养液,每组10例标本。于孕第4 d取子宫组织行荧光定量PCR、免疫组织化学、Western blotting和扫描电镜检测。
2.4子宫内膜容受性检测 子宫内膜组织一部分直接置入10%甲醛液中,行免疫组织化学检测容受性标志物LIF和整合素β3的表达量;一部分置入电镜标本前固定液(2.5%戊二醛+2%多聚甲醛+0.1 mol/L PBS)中,行扫描电镜检测容受性标志物胞饮突;一部分置于-80℃,待行荧光定量PCR和Western blotting检测LIF和整合素β3的表达量。
2.4.1扫描电镜 子宫内膜离体后立即用PBS冲洗干净,置于前固定液,4 ℃冰箱中固定4 h后,50%、70%、80%、90%、100%乙醇脱水;100%丙酮15 min;醋酸戊异酯过渡液过夜,临界点干燥后离子溅射镀膜,贴板上机观察胞饮突的形成及发育情况。
2.4.2免疫组化 子宫内膜标本经10%甲醛固定,常规石蜡包埋切片,切片烘干后梯度乙醇脱蜡,EDTA抗原修复,山羊血清(SP9001试剂A)封闭,Ⅰ抗4 ℃孵育过夜,滴加生物素标记山羊抗兔IgG(SP9001试剂B),滴加辣根酶标记链霉卵白素工作液(SP9001试剂C),DAB显色,苏木素复染。每张切片随机选取5个高倍视野(×400), Image-Pro Plus 6.0分析着色区域积分吸光度值。阳性对照取生殖内分泌正常的30岁妇女黄体生成素(luteinizing hormone,LH)峰后7 d子宫内膜的切片,阴性对照以PBS代替Ⅰ抗。每组实验均设置阳性及阴性对照。
2.4.3实时荧光定量PCR 采用总RNA提取试剂盒(Bio-Rad)提取总RNA(参照试剂盒说明提取),逆转录试剂盒(Bio-Rad)进行逆转录;SYBR Green 荧光定量 PCR 试剂盒(Bio-Rad) 在 ABI7300 上进行整合素β3和LIF mRNA 定量分析,引物和实验条件具体见表1,以 GAPDH为内参照基因,检测重复3次。
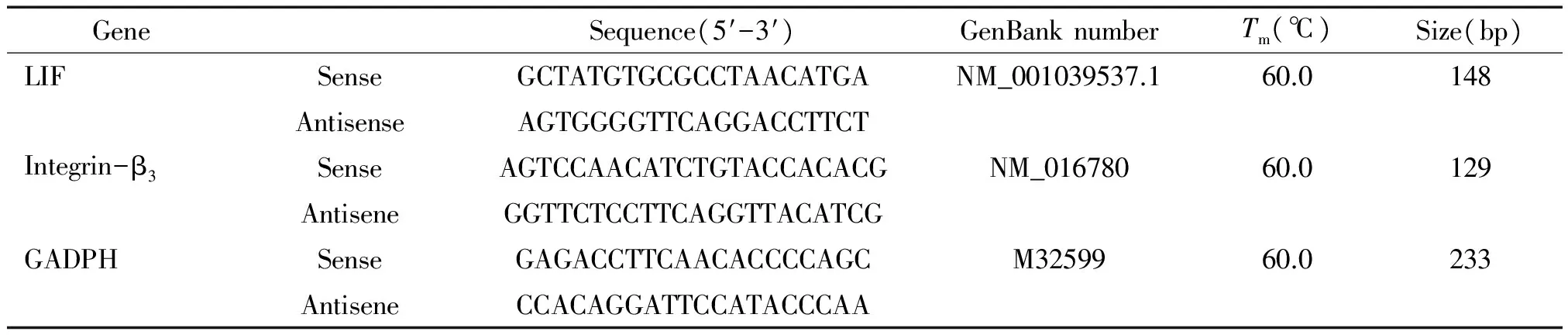
表1 定量分析引物与主要参数
2.4.4Western blotting 总蛋白提取试剂盒提取总蛋白,BCA法(Merck) 检测蛋白浓度;7.5%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE) 凝胶电泳;80 V、2 h,转膜2 h;5%脱脂牛奶封闭液封闭1 h;Ⅰ抗4 ℃过夜;Ⅱ抗室温孵育1 h;TBS 液清洗;ECL化学发光,X光片显影定影;并用 ImageJ软件计算各条带的积分吸光度值。
3统计学处理
结 果
1子宫内膜组织形态学
所有标本均采用HE染色鉴定子宫内膜及完整性,体内实验组子宫结构完整,子宫内膜腺体和上皮细胞结构清晰完整;体外实验通过挤压法获得的子宫内膜结构完整,腺体和上皮细胞清晰可见,经过体外培养2 d后组织结构变得松散,但整体仍完整,见图1。

Figure 1. The HE staining of endometrium. A: HE staining of uterus(×100); B: HE staining of endometrium obtained by squeezing method(×100); C: HE staining of endometrium culturedinvitrofor 2 d(×200).
图1子宫内膜苏木素-伊红染色
2子宫内膜容受性形态
随机选取各组标本,扫描电镜观察形态学变化,种植窗时期(交配后3.5 d)均有胞饮突的出现,交配后1.5 d(1.5dpc)胞饮突基本仍未发育,见图2。表明所选检测时间为种植窗时期,同时证明子宫内膜在体外培养仍能类似于体内继续发生形态学和功能学变化。
Figure 2. Scanning electron microscopy (SEM) photomicrographs of endometrium. A: endometrium obtained by squeezing method(×100);B: endometrium cocultured with embryoinvitrofor 2 d(×3 000);C: endometrium of 1.5dpc(×3 000).
图2子宫内膜扫描电镜
3免疫组织化学结果
体内实验各组小鼠子宫上皮细胞和腺细胞在见栓后第4 d均有整合素β3和LIF表达,以正常见栓无干预组表达显著高于其余5组,差异有统计学意义(P<0.05),其余5组组间整合素β3和LIF表达无显著差异。体外实验发现全胚胎子宫内膜共培养组中子宫上皮细胞和腺细胞在体外培养2 d后整合素β3和LIF表达显著高于其余4组,差异有统计学意义(P<0.05),其余4组组间整合素β3和LIF表达无显著差异,见图3。
4荧光定量PCR结果
体内实验各组小鼠在见栓后第4 d均有整合素β3和LIF mRNA表达,以正常见栓无干预组表达显著高于其余5组,有统计学意义(P<0.05),其余5组组间整合素β3和LIF表达无显著差异。体外实验发现全胚胎子宫内膜共培养组中在体外培养2 d后整合素β3和LIF表达显著高于其余4组,差异有统计学意义(P<0.05),其余4组组间整合素β3和LIF表达无显著差异,见图4。
5Westernblotting结果
体内实验中各组小鼠在见栓后第4 d均有整合素β3和LIF的表达,以正常见栓无干预组表达显著高于其余5组,差异有统计学意义(P<0.05),其余5组组间整合素β3和LIF表达无显著差异。体外实验发现全胚胎子宫内膜共培养组中在体外培养2 d后整合素β3和LIF表达显著高于其余4组,差异有统计学意义(P<0.05),其余4组组间整合素β3和LIF表达无显著差异,见图5。
讨 论
胚胎植入是一个复杂的过程,需要发育良好的胚胎和具有容受性的子宫内膜,以及二者之间的同步发育和分子对话[1]。目前对于子宫内膜容受性的研究多是集中在对一些容受性标志因子的发现和检测上,现已知的子宫内膜容受性标志分子有细胞因子、黏附分子、生长因子、脂类等[2],Nikas等[9-10]认为胞饮突的出现是子宫内膜容受性状态的形态学标志,根据胞饮突在时间和形态上的特征性,通过观察胞饮突,可以更精确地确定植入窗开始和持续的时间,协助判断子宫内膜接受性,具有准确、直观和相对方便的优点,对于辅助生殖技术具有重要的指导意义[10]。在这项实验中1.5dpc时扫描电镜结果显示基本无胞饮突的发育,说明种植窗还未开启,孕4 d和共培养2 d后的子宫内膜胞饮突发育,种植窗开启,该变化符合实验的预测时间。观察胞饮突的出现说明因子检测是在胚胎种植窗,避免了时间选择的错误。胚胎与子宫内膜存在“分子对话”机制,其参与的分子与子宫内膜容受性相关标志物基本一致。对胚胎与子宫内膜分子层面对话的深入研究将有助于提高反复失败IVF-ET患者妊娠成功率,然而目前对胚胎诱导子宫内膜容受性提升的具体机制研究甚少,尚无关于各胚胎组分对子宫内膜容受性的影响,胚胎共培养可引起子宫内膜容受性的增加,而与子宫内膜直接接触的是透明带,透明带是否在诱导子宫内膜容受性方面起作用? Fujiwara等[11]就曾提出“透明带是否给母体内在信号,使其识别发育中的胚胎”的问题,并提出疑问:具体是胚胎的哪一部分参与了子宫内膜容受性的主要诱导过程?
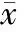
图3免疫组织化学染色
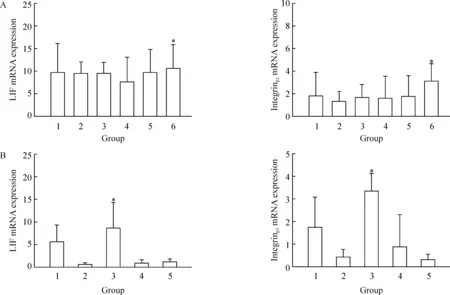
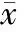
图4实时定量RT-PCR检测胚胎各部分对子宫内膜容受性因子LIF、整合素β3mRNA水平的诱导作用
这项研究是医学领域第一次探索早期胚胎诱导子宫内膜容受性的空间结构,并通过小鼠的体内和体外实验两个途径共同验证。收集2细胞期胚胎后分别体内移植透明带、卵裂球、完整胚胎以及培养液后,孕第4 d检测容受性因子的表达,发现有手术操作孕第4 d的表达并不高于孕第2 d,孕第4 d各组之间的表达也没有差异,但正常见阴道栓后无手术操作组的表达显著高于各组,可能原因有:(1)个体之间差异过大;(2)采用水合氯醛麻醉和开腹手术移植对小鼠的子宫和整个机体的影响较大,仅仅经过2 d子宫内膜容受性因子的表达也可能会受到影响,影响子宫内膜容受性或种植窗正常时期、正常量的表达及开启;(3)体内移植双侧宫角各3枚,移植胚胎数量较少,不足以引起明显的分子对话使小鼠子宫内膜容受性因子表达增加。
胚胎与子宫内膜体外共培养使得分子对话机制更加利于研究,体外实验避免了明显的个体差异,研究证实早期胚胎与子宫内膜上皮共培养可提高IVF-ET成功率[3-5],Horcajadas等[12]发现,行IVF-ET患者的胚胎与自身子宫内膜上皮细胞共培养可改变子宫内膜上皮细胞100余基因的改变,说明胚胎可诱导影响子宫内膜发生相应变化以及引起子宫内膜容受性的增加。除了基础实验,在人类IVF-ET中,有学者报道通过2次移植提高反复失败患者的临床妊娠率的研究也表明胚胎与内膜之间存在相互诱导作用[13-15]。本实验中培养后空白对照与见栓后2 d的表达无明显差异,共培养2 d后,胚胎共培养组子宫内膜LIF和整合素β3表达高于透明带共培养组、卵裂球共培养组及空白组,此结果的可能原因有:(1) 体外共培养中子宫内膜组织在培养2 d后仍具有子宫内膜容受性,但HE切片显示结构已变得松散,部分组织细胞可能已经坏死、凋亡,正常功能的行使可能也受影响,同时说明即使有组织细胞的凋亡,但共培养对子宫内膜的诱导作用弥补了凋亡坏死所致缺少量;(2) 胚胎操作可能对胚胎、卵裂球、透明带的损伤使其功能受损,如Kurokawa等[16]发现,ICSI后胚胎因子改变与IVF不同,曾提出ICSI安全性的问题;(3) 所用小鼠为正常小鼠,小鼠的繁殖能力较强,且并无着床障碍等病理状态,体内移植的各组和体外共培养各组对子宫内膜的诱导作用不够明显;(4)完整胚胎可以诱导子宫内膜容受性,透明带与卵裂球不能单独完成分子对话功能,既往研究也证明了胚胎与子宫内膜共培养可促进早期胚胎的优质胚胎率和囊胚形成率[17],同时王丽等[18]的研究在细胞实验上证实胚胎与子宫内膜上皮细胞共培养可提高子宫内膜上皮细胞容受性分子的表达。
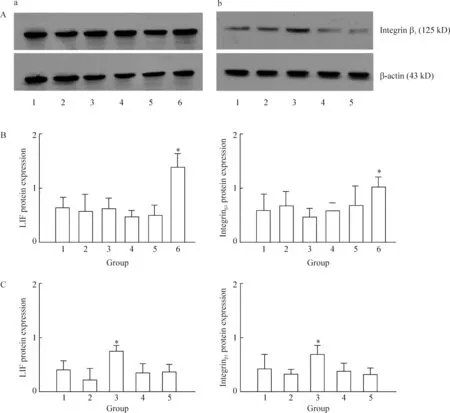
图5Westernblotting检测胚胎各部分对子宫内膜容受性因子LIF和整合素β3蛋白水平的诱导作用
综上,这项小鼠动物实验证实,对于正常生殖功能小鼠,胚胎完成与子宫内膜的分子对话需要完整的空间结构,然而单纯卵裂球和透明带不能明显地体现分子对话的功能,对于着床障碍、免疫性不孕等病理状态以及人类和其它物种在胚胎与子宫内膜相互作用的生理基础仍需继续探讨研究。
[1] Simon C,Martin JC,Pellicer A,et al.Paracrine regulators of implantation[J].Baillieres Best Pract Res Clin Obstet Gynaeco,2000,14(5):815-826.
[2] Hanna A,Ariel R.Endometrial receptivity markers,the journey to successful embryo implantation[J].Hum Reprod Update,2006,12(6):731 - 746.
[3] Spandorfer SD,Soslow R,Clark R,et al.Histologic characteristics of the endometrium predicts success when utilizing autologous endometrial coculture in patients with IVF failure[J].J Assist Reprod Genet,2006,23(4):185-189.
[4] Mercader A,Mercader A,Garcia-Velasco JA,et al.Clinical experience and perinatal outcome of blastocyst transfer after coculture of human embryos with human endometrial epithelial cells:a 5-year follow-up study[J].Fertil Steril,2003,80(5):1162-1168.
[5] Eyheremendy V,Raffo FGE,Papayannis M,et al.Beneficial effect of autologous endometrial cell coculture in patients with repeated implantation failure[J].Fertil Steril,2010,93(3):769-773.
[6] Wakuda K,Takakura K,Nakanishi K,et al.Embryo-dependent induction of uterine receptivity in the mouse endometrium[J].J Reprod Fertil,1999,115(2):315-324.
[7] 谭 毅,顾美礼,王智彪.完整分离围着床期小鼠子宫内膜方法的建立[J].中国实验动物学报,2001,9(1):40-44.
[8] 谭冬梅,谭 毅,赵劼,等.立体着床模型——小鼠囊胚与子宫内膜的共培养[J].第四军医大学学报,2005,26(15):1359-1362.
[9] Nikas G,Drakakis P,Loutradis D,et al.Uterine pinopodes as markers of the ‘nidation window’ in cycling women receiving exogenous oestradiol and progesterone[J].Hum Reprod,1995,10(5):1208-1213.
[10]Nikas G.Endometrial receptivity:changes in cell-surface morphology[J].Semin Reprod Med,2000,18(3):229-235.
[11]Fujiwara H, Araki Y, Toshimori K.Is the zona pellucida an intrinsic source of signals activating maternal recognition of the developing mammalian embryo?[J].Reprod Immunol,2009,81(1):1-8.
[12]Horcajadas JA,Catalano R,Gadea B,et al.The human embryo-endometrial dialogue:Impact of a single blastocyst in the gene expression pattern of endometrial epithelial cells[J].Fertil Steril,2005,84(Suppl 1):60-61.
[13]Achache H,Revel A.Endometrial receptivity markers,the journey to successful embryo implantation[J].Hum Reprod Update,2006,12(6):731-746.
[14]Almog B,Levin I,Wagman I,et al.Interval double transfer improves treatment success in patients with repeated IVF/ET failures[J].J Assist Reprod Genet,2008,25(8):353-357.
[15]Machtinger R,Dor J,Margolin M,et al.Sequential transfer of day 3 embryos and blastocysts after previous IVF failures despite adequate ovarian response[J].Reprod Biomed Online,2006,13(3):376-379.
[16]Kurokawa M, Fissore RA.ICSI-generated mouse zygotes exhibit altered calcium oscillations,inositol 1,4,5-trisphosphate receptor-1 down-regulation,and embryo development[J].Mol Hum Reprod,2003,9(9):523-533.
[17]陈悦州,原 玮,任永生.子宫内膜上皮细胞与小鼠胚胎共培养对小鼠胚胎早期发育的影响[J].郧阳医学院学报,2006,25(6):340-342.
[18]王 丽,周剑萍,张 炜,等.胚胎因素对体外子宫内膜整合素β3的调节[J].中国免疫学杂志,2006,22(1):58-60.
Mouseearlyintegralembryoinducesexpressionofendometrialintegrinβ3andleukaemia-inhibitoryfactor,andimprovesuterinereceptivityinmice
LI Ting-ting, FANG Cong, JIA Lei, YUE Chao-min
(CenterforReproductiveMedicine,TheSixthAffiliatedHospitalofSunYat-senUniversity,Guangzhou510655,China.E-mail:qingqingwenyuan@126.com)
AIM: To investigate the changes of endometrial receptivity under the effect of mouse embryo bothinvitroandinvivo, and to figure out which part of the embryo induces the change.METHODSScanning electron microscope was applied to observe the pinpode formation on day 4 endometrium bothinvitroandinvivo. The expression of integrin β3and leukaemia-inhibitory factor(LIF) on day 2 pregnant mouse endometrium , day 4 endometrium after co-culture for 2 d with day 2 embryo , blastomere and zona pellucida as well as control groupinvitrowere detected by the methods of fluorescent quantitative PCR, immunohistochemistry and Western blotting. The same tests were conducted in theinvivopart of the experiment with the integral embryo or different parts of the embryo being transferred to pseudopregnant mouse uterus. On day 4 of the pregnancy, the endometrium was extracted to carry out the tests.RESULTSAfter co-cultured for 2 d with whole embryo, the experssion of integrin β3and LIF was higher than that in any other group in theinvitropart. The expression of integrin β3and LIF on day 4 of normal pregnancy was higher than that in any other group in theinvivoexperiments.CONCLUSIONMouse embryo as a whole is able to induce better endometrial receptivity, while any separated part of embryo, such as blastomere or zona pellucida, couldn’t.
Embryo; Integrin β3; Leukaemia-inhibitory factor; Endometrial receptivity
R321.2
A
10.3969/j.issn.1000-4718.2012.02.001

