神经生长因子通过TrkANGFR信号途径促进肝细胞增殖*
李俊峰, 舒建昌, 陈莲香, 朱海燕, 吕 霞
(1 暨南大学附属第一医院消化科,广东 广州510630;2 暨南大学附属第四医院 消化科,广东 广州510175)
肝纤维化是肝损伤-修复和细胞外基质(extracellular matrix,ECM)过度沉积的病理过程。肝细胞损伤和肝星状细胞(hepatic stellate cells,HSCs)活化是这一过程的中心环节[1]。改善肝细胞损伤、抑制肝细胞凋亡,诱导活化的HSCs 凋亡,可逆转肝纤维化[2-4]。神 经 生 长 因 子(nerve growth factor,NGF)/p75NTR神经内分泌信号肽途径调控肝星状细胞分化、增殖和凋亡,参与肝损伤-修复过程[5-7]。但是NGF 对肝细胞作用研究较少,本研究旨在探讨外源性重组人NGF-β 对肝细胞的作用。
材 料 和 方 法
1 材料
1.1 细胞株 人正常肝细胞株L02 购自中科院上海细胞生物研究所。
1.2 试剂及抗体 DMEM 培养基、0.25%含EDTA胰蛋白酶(Gibco)、胎牛血清(Gibco)、重组人NGF -β(R&D),兔抗神经生长因子抗体(rabbit anti-nerve growth factor,anti-NGF)、兔抗神经营养素受体p75抗体(rabbit anti - neurotrophin receptor p75,anti -p75NTR)、兔抗神经生长因子受体TrkA 抗体(rabbit anti-tyrosine kinases receptor A,anti-TrkANGFR)(武汉博士德公司),3,3'-[1 -(苯氨酰基)-3,4 -四氮唑]-二(4 -甲氧基-6 -硝基)苯磺酸钠{2,3 -bis(2 -methoxy - 4 -nitro - 5 -sulfophenyl)-5 -[(phenylamino)carbonyl]-2H -tetrazolium hydroxide,XTT}(BBI),吩嗪硫酸甲酯(phenazine methosulfate,PMS)(Sigma),Annexin V - FITC/propidium iodide(PI)凋亡试剂盒(南京凯基公司),即用型快捷免疫组化MaxVisionTM试剂盒、DAB 显色试剂盒(福州迈新生物技术开发有限公司),Trizol、Taq DNA polymerase(Invitrogen),SYBR PrimeScript PCR 试剂盒(TaKaRa)。
2 方法
2.1 细胞培养 L02 细胞株接种在加有1 ×105U/L青霉素、100 mg/L 链霉素、10%胎牛血清DMEM培养液中,37℃、5%CO2、饱和湿度培养箱中培养。根据倒置显微镜下细胞生长情况进行换液,注意监测培养基的pH 值,在细胞生长融合度达到80% ~90%时,0.25%含EDTA 胰蛋白酶消化传代,选对数生长期细胞进行实验。
2.2 免疫细胞化学染色法检测L02 细胞NGF、TrkANGFR和p75NTR蛋白的表达 每孔接种细胞1 ×105于6 孔板内的盖玻片上,孵育24 h 后,弃培养液,分别加入浓度为100 μg/L NGF-β 的培养液1 mL,同时设立不加试剂为对照组,继续培养24 h,PBS 冲洗3 次,每次3 min。加入2 mL 冷丙酮固定10 min,PBS冲洗细胞爬片3 min,重复3 次。3% H2O2阻断内源性过氧化物酶,室温孵育10 min,PBS 冲洗3 min,重复3 次,每张爬片滴加正常非免疫动物血清封闭非特异性抗原,湿盒内室温孵育10 min,滴加兔抗人多克隆抗体(anti - NGF、anti - TrkANGFR和anti -p75NTR),4 ℃孵育过夜。PBS 冲洗3 次,每次3 min,滴加即用型MaxVisionTM试剂,室温下孵育10 ~15 min,PBS 冲洗3 次,每次3 min。DAB 显色试剂显色,自来水冲洗终止显色,苏木素复染1 min,梯度酒精脱水,二甲苯透明,中性树胶封片。光镜观察并拍片,以胞膜或胞浆棕色颗粒表达为阳性。
随机选取细胞爬片中的不同部位5 个高倍镜视野(×200),显微镜下通过AxioVision 图像采集系统在同等条件下采集图片。利用图像分析软件Image-Pro Plus 6.0 计算每个视野阳性表达细胞的平均吸光度值(average absorbance,AA)。每个视野阳性表达细胞的AA 等于视野阳性表达的积分吸光度值(integral absorbance,IA)/视野内细胞数。
2.3 荧光定量PCR 检测NGF、TrkANGFR和p75NTRmRNA 表达 每瓶接种细胞1 ×106于25 cm2培养瓶中,培养24 h 后,弃上清,分别加入含NGF - β(100 μg/L)的培养液4 mL,以不加试剂组为对照,继续培养24 h 后,收集所有细胞。Trizol 试剂提取细胞总RNA,采用Oligo (dT)引物和随机引物进行逆转录,以cDNA 为模板进行荧光定量PCR。NGF 上游引物5' - GACTCACAGGAGCAAGCGGT -3',下游引物5'-CTGTGGCGGTGGTCTTATCC-3',扩增片段长 度 107 bp; p75NTR上 游 引 物 5' -CTCGCGATTTCAAACCTGGA -3',下游引物5'-TTGTGGGTGGCTTTACAGCTC-3',扩增片段长度108 bp;TrkANGFR上 游 引 物 5' - ACCCTCTGTACCCCCGATCT - 3',下游引物5' - TCGATGTAGCTTGCTGCCAA-3',扩增片段长度102 bp;内参照β -actin 上游引物5'-GCGCGGCTACAGCTTCA -3',下游引物5' - TCTCCTTAATGTCACGCACGAT -3’,扩增片段长度59 bp。PCR 反应条件:93 ℃3 min,93℃30 s,55 ℃45 s,72 ℃45 s,循环40 次,重复3 次。
2.4 XTT 法检测NGF-β 对L02 细胞增殖的影响
调整细胞浓度,以每孔5×103接种于96 孔培养板中,每组设4 个复孔,孵育24 h 后,弃去上清,分别加入含不同浓度梯度(12.5、25、50、100、200、400、800、1 600 μg/L)的NGF-β 培养液100 μL,设不加NGF -β 对照,继续培养24 h,每孔加入50 μL XTT 比色液,避光孵育4 h,在主波长为490 nm、参考波长为630 nm 的连续光谱酶标仪上检测各孔吸光度(A 值)。
2.5 XTT 法检测anti-NGF、anti-TrkANGFR和antip75NTR对NGF-β 诱导的L02 细胞增殖的影响 接种细胞5 ×103于96 孔培养板中,每组设4 个复孔,孵育24 h,弃去上清,加入NGF(100 μg/L)孵育15 min 后,分别加入anti-NGF、anti-TrkANGFR和anti -p75NTR培养液(浓度为100 μg/L),设不加药组为阴性对照,只加NGF - β 为阳性对照,继续培养24 h后,每孔加入50 μL XTT 比色液,避光孵育4 h,在主波长为490 nm、参考波长为630 nm 的连续光谱酶标仪上检测各孔吸光度(A 值)。
2.6 流式细胞仪(Annexin V - FITC/PI 法)检测NGF-β 对L02 细胞凋亡的影响 每孔接种1 ×106于6 孔板中,培养24 h,弃上清,分别加入不同浓度梯度(25、50、100、200、400 μg/L)的NGF - β 培养液,设不加NGF -β 组为对照,继续孵育24 h,收集所有细胞,1 000 r/min 离心弃上清,加入200 μL 结合缓冲液悬浮细胞,加入Annexin V-FITC 和PI 各2 μL,室温避光孵育15 min,流式细胞仪(BD FACSAria)检测L02 细胞凋亡情况,重复3 次。
2.7 流式细胞仪(PI 法)检测NGF -β 对L02 细胞周期的影响 每孔接种细胞1 ×106,于6 孔板中,培养24 h 后,分别加入不同浓度梯度(0、12.5、25、50、100、200 μg/L)的NGF -β,放置培养箱中继续孵育24 h 后,收集所有细胞,70%冷乙醇4 ℃固定,离心弃乙醇,加入200 μL PI 染液,混匀,过滤,流式细胞仪检测细胞周期,重复3 次。
3 统计学处理
结 果
1 L02 细胞NGF、TrkANGFR 和p75NTR 蛋白及mRNA 表达
L02 细胞表达NGF、TrkANGFR、p75NTR蛋白,外源性NGF-β 处理24 h 后的L02 细胞与未加药组比较,细胞胞浆、细胞核和细胞膜上出现较多的棕色颗粒,NGF 阳性表达的平均吸光度值(0.3880 ±0.0270 vs 0.2595 ±0.0241,P <0.05)和TrkANGFR蛋白阳性表达的平均吸光度值(0.3849 ±0.0194 vs 0.3110 ±0.0254,P <0.05)明显增大,与对照组比较差异有统计学意义;p75NTR蛋白阳性表达的平均吸光度值(0.2887 ±0.0759 vs 0.2524 ±0.0378,P >0.05)略有增大,与对照组比较差异无统计学意义,见图1。
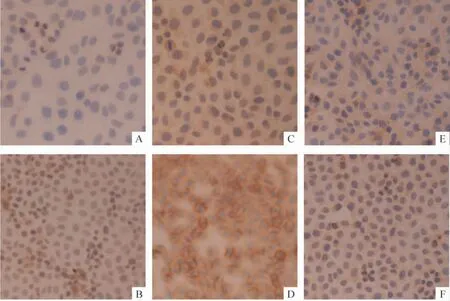
Figure 1. NGF,TrkANGFR and p75NTR protein expression in L02 cells(immunocytochemistry,×200).A,C,E:control;B,D,F:TGFβ.A,B:NGF;C,D:TrkANGFR;E,F:p75NTR.图1 NGF-β 对L02 细胞NGF、TrkANGFR和p75NTR蛋白表达的影响
L02 细胞表达NGF、p75NTR和TrkANGFRmRNA,外源性NGF - β 上调了L02 细胞表达NGF mRNA(0.3550 ±0.2140 vs 0.2140 ±0.0135,P <0.01)和TrkANGFRmRNA (0.1586 ± 0.0289 vs 0.0644 ±0.0084,P <0.01),与对照组比较差异有统计学意义;p75NTRmRNA (0.0130 ± 0.0034 vs 0.0063 ±0.0005,P >0.05)的表达差异无统计学意义,见表1。
表1 荧光定量RT-PCR 检测NGF、TrkANGFR 和p75NTR mRNA 的表达Table 1. NGF,TrkANGFR and p75NTR mRNA expression in L02 cells detected by fluorescent quantitative PCR (±s.n=3)

表1 荧光定量RT-PCR 检测NGF、TrkANGFR 和p75NTR mRNA 的表达Table 1. NGF,TrkANGFR and p75NTR mRNA expression in L02 cells detected by fluorescent quantitative PCR (±s.n=3)
**P <0.01 vs control.
Group NGF TrkANGFR p75 NTR±0.0005 NGF 0.3550±0.0070**0.1586±0.0289**Control 0.2140±0.0135 0.0644±0.0084 0.0063 0.0130±0.0034
2 外源性NGF-β 对L02 细胞增殖的作用
外源性NGF -β 促进L02 细胞增殖,呈剂量依赖性,表现为倒立U 形曲线。25 ~200 μg/L 浓度范围内与对照组比较差异有统计学意义(P <0.05),25 μg/L 时增殖作用最强;400 ~1 600 μg/L 浓度范围内对L02 细胞增殖的作用与对照组比较差异无统计学意义(P >0.05),见图2。
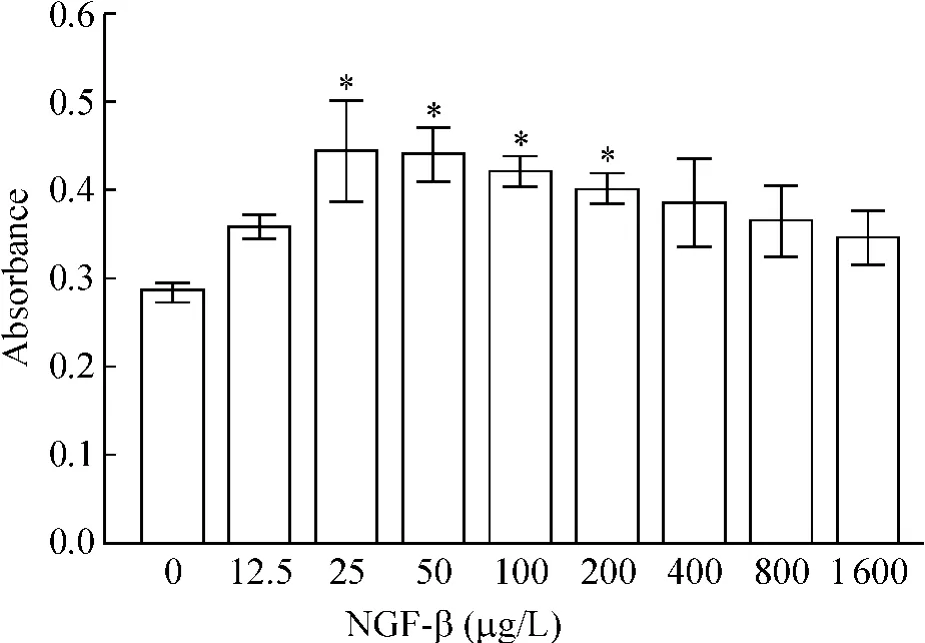
Figure 2. Effect of NGF-β on L02 cell proliferation at different concentrations (XTT assay). ±s. n =4. * P <0.05 vs control(0 μg/L).图2 XTT 比色法检测不同浓度NGF-β 对L02 细胞增殖的作用
3 Anti-NGF、anti-TrkANGFR 和anti-p75NTR 对NGF-β 诱导的L02 细胞增殖的作用
Anti-NGF 和anti-TrkANGFR抑制NGF -β 诱导的L02 细胞增殖,与对照组比较差异有统计学意义(P <0.05);anti-p75NTR不影响NGF-β 诱导的L02细胞增殖,与阳性对照组比较差异无统计学意义(P>0.05),见图3。
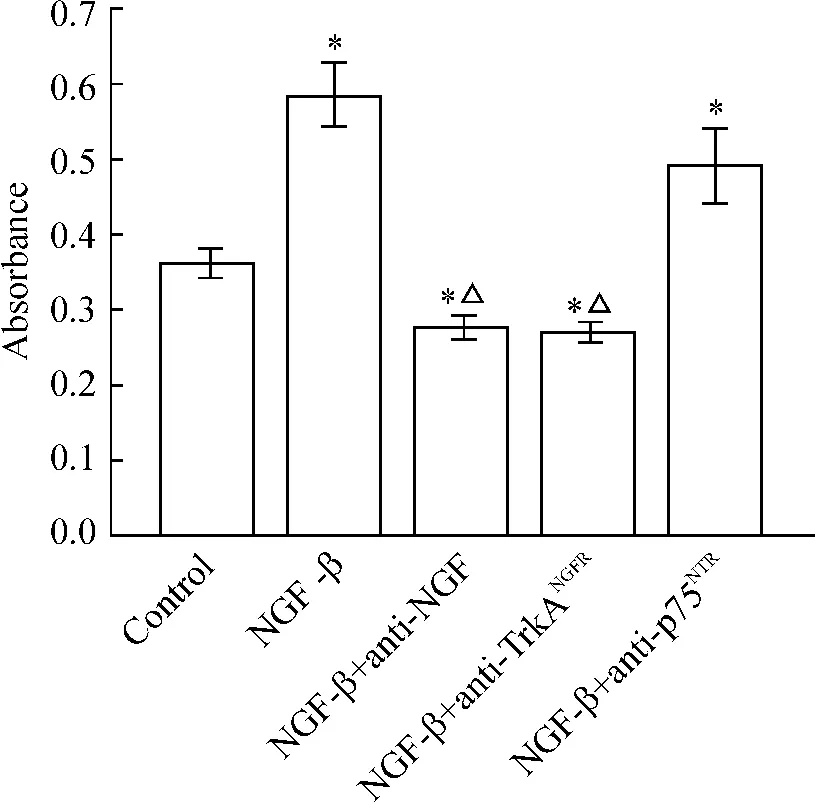
Figure 3. Effects of anti - NGF,anti - TrkANGFR and anti -p75NTR on NGF - β induced L02 cell proliferation(XTT assay). ±s. n =4. * P <0.05 vs control;△P<0.05 vs NGF-β.图3 Anti-NGF、anti-TrkANGFR和anti-p75NTR对NGFβ 诱导的L02 细胞增殖的影响
4 NGF-β 对L02 细胞凋亡的影响
外源性NGF -β 对L02 细胞有抗凋亡趋势,浓度50 μg/L 抗细胞凋亡的作用最强(1.2 ±0.2 vs 1.9±0.7),但与对照组比较差异无统计学意义(P >0.05),见图4。
5 NGF-β 对L02 细胞周期的影响
NGF-β 作用于L02 细胞周期的S 期,呈剂量依赖性,浓度为25 μg/L 作用最强(25.60% ±0.32%vs 21.10% ±0.30%),与对照组比较差异有统计学意义(P <0.01),200 μg/L 抑制L02 细胞分化(18.40% ±0.40% vs 21.10% ±0.30%),与对照组比较差异有统计学意义(P <0.01),见图5。
讨 论
NGF 是神经营养因子家族中重要的成员,是神经细胞及非神经细胞发育、增殖、分化和生存的重要因子。NGF 结合高亲和受体TrkANGFR激活细胞分裂素活化蛋白激酶(mitogen - activated protein kinase,MAPK)、磷脂酰肌醇-3 激酶(phosphatidylinositol-3 kinase,PI3K)级联引起细胞分化和存活。NGF 结合低亲和受体p75NTR,依赖募集到p75NTR细胞内结构域的因子不同,促进细胞生存、分化或凋亡[8]。肝细胞增殖时神经营养因子(neurotrophins,NTs)mRNA 和蛋白水平表达明显增高,NTs 可能对肝细胞增殖起重要作用[9-10],Gigliozzi 等[11]研究发现外源性NGF 刺激胆管上皮细胞增殖。

Figure 4. The effect of NGF-β on apoptosis of L02 cells at different concentrations (flow cytometry assay). A:control (0 μg/L)B:25 μg/L;C:50 μg/L;D:100 μg/L;E:200 μg/L;F:400 μg/L. x¯±s.n=3.图4 流式细胞仪检测NGF-β 对L02 细胞凋亡的作用
本研究采用免疫细胞化学及荧光定量PCR 技术,发现增殖的肝细胞表达NGF 和TrkANGFR,弱表达p75NTR;外源性NGF -β 促进L02 细胞表达NGF 和TrkANGFR,与以前学者提出正常或损伤的肝细胞不表达TrkANGFR相矛盾,可能与细胞处在不同周期有关[10,12-13]。NGF 主要位于肝细胞的细胞质和细胞核,TrkANGFR和p75NTR主要位于细胞膜和细胞质。外源性NGF-β 对肝细胞的作用呈双峰模式,调控细胞周期的S 期,低剂量(25 ~200 μg/L)促进L02 细胞增殖,抗肝细胞凋亡,呈剂量依赖性,与不加NGF-β 组比较差异有统计学意义,25 μg/L 增殖作用最强,高剂量(400 ~1 600 μg/L)抑制L02 细胞增殖;增殖曲线呈倒立的U 字形,与Kemp 等[14]研究认为低剂量NGF 促进感觉神经元轴突生长,高剂量抑制轴突生长一致,可能机制是NGF 的生物学效应与膜受体相对比值有关,NGF 低浓度时先结合TrkANGFR受体,高浓度时TrkANGFR受体饱和,增加了NGF与p75NTR结合,从而抑制细胞增殖。中和抗体anti -NGF 抑制外源性NGF -β 诱导的L02 细胞增殖,可能原因是anti-NGF 中和了L02 细胞自身分泌的和外源性NGF;中和抗体anti - TrkANGFR阻碍NGF 与TrkANGFR结合,从而抑制细胞内信号通路,抑制肝细胞的增殖;中和抗体anti -p75NTR与p75NTR细胞外域结合,阻止NGF 与p75NTR结合,抑制NGF/p75NTR信号途径,细胞凋亡减少;因此NGF 可能通过NGF/TrkANGFR信号通路,调控L02 细胞的增殖和分化。外源性NGF-β 能够上调L02 细胞表达内源性NGF,可能是启动了内分泌的级联反应,与促进L02 细胞增殖有关,增殖的L02 细胞分泌更多的NGF,确切机制需进一步研究。
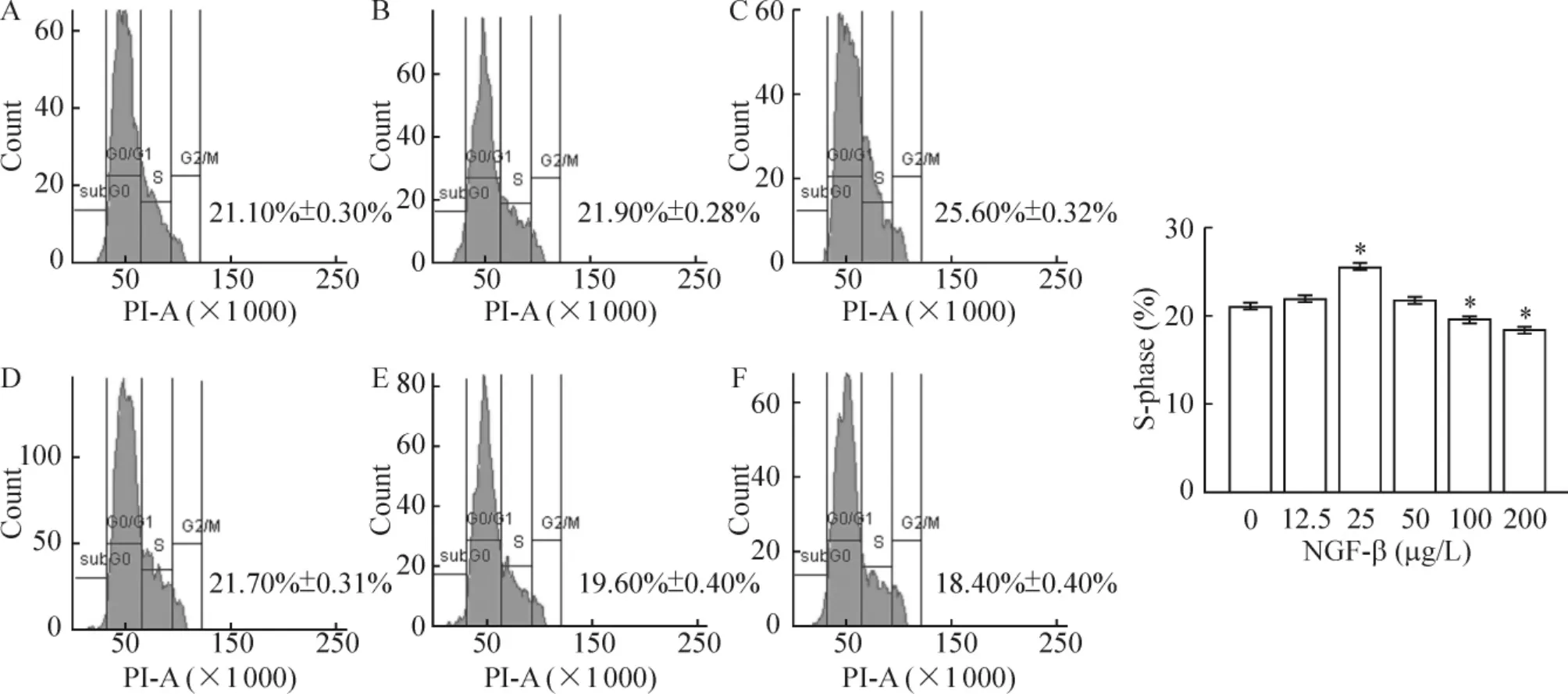
Figure 5. Effect of NGF-β on cell cycle of L-02 cells (flow cytometry assay). A:control (0 μg/L);B:12.5 μg/L;C:25 μg/L;D:50 μg/L;E:100 μg/L;F:200 μg/L. x¯±s.n=3. * P <0.05 vs control.图5 NGF-β 对L02 细胞细胞周期的影响
本研究发现增殖的L02 细胞分泌NGF,表达受体TrkANGFR和p75NTR;外源性NGF -β 上调NGF 和TrkANGFR蛋白的表达,促进肝细胞分化、增殖,为预防和治疗肝纤维化提供新的靶点。
[1] Friedman SL. Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655 - 1669.
[2] 潘 勤,李定国,杜学良,等.生长抑素及奥曲肽的肝细胞保护作用及其机制研究[J]. 中国病理生理杂志,2008,24(4):730 -733.
[3] 刘晓兵,郭晓红,刘立新,等.siRNA 沉默Smad3 对肝星状细胞增殖与凋亡的影响及其机制研究[J]. 中国病理生理杂志,2011,27(7):1376 -1381.
[4] Elsharkawy AM,Oakley F,Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis[J].Apoptosis,2005,10(5):927 -939.
[5] Kendall TJ,Hennedige S,Aucott RL,et al.p75 neurotrophin receptor signaling regulates hepatic myofibroblast proliferation and apoptosis in recovery from rodent liver fibrosis[J]. Hepatology,2009,49(3):901 -910.
[6] Passino MA,Adams RA,Sikorski SL,et al. Regulation of hepatic stellate cell differentiation by the neurotrophin receptor p75NTR[J]. Science,2007,315(5820):1853 -1856.
[7] Trim N,Morgan S,Evans M,et al. Hepatic stellate cells express the low affinity nerve growth factor receptor p75 and undergo apoptosis in response to nerve growth factor stimulation[J]. Am J Pathol,2000,156(4):1235 -1243.
[8] Bredesen DE,Rabizadeh S. p75NTRand apoptosis:Trkdependent and Trk-independent effects[J]. Trend Neurosci,1997,20(7):287 -290.
[9] Nemoto K,Miyata S,Nemoto F,et al. Gene expression of neurotrophins and their receptors in lead nitrate-induced rat liver hyperplasia[J].Biochem Biophys Res Commun,2000,275 (2):472 -476.
[10] Oakley F,Trim N,Constandinou CM,et al. Hepatocytes express nerve growth factor during liver injury:evidence for paracrine regulation of hepatic stellate cell apoptosis[J]. Am J Pathol,2003,163(5):1849 -1858.
[11] Gigliozzi A,Alpini G,Baroni GS,et al. Nerve growth factor modulates the proliferative capacity of the intrahepatic biliary epithelium in experimental cholestasis[J].Gastroenterology,2004,127(4):1198 -1209.
[12] Tokusashi Y,Asai K,Tamakawa S,et al. Expression of NGF in hepatocellular carcinoma cells with its receptors in non- tumor cell components[J]. Int J Cancer,2005,114(1):39 -45.
[13] Urdiales JL,Becker E,Andrieu M,et al. Cell cycle phase-specific surface expression of nerve growth factor receptors TrkA and p75NTR[J]. J Neurosci,1998,18(17):6767 -6775.
[14] Kemp SW,Webb AA,Dhaliwal S,et al. Dose and duration of nerve growth factor (NGF)administration determine the extent of behavioral recovery following peripheral nerve injury in the rat[J].Exp Neurol,2011,229 (2):460 -470.

