辛伐他汀对去卵巢大鼠骨痂骨保护素表达的影响*
王建卫, 李 杭, 潘志军
(浙江大学医学院附属第二医院骨科,浙江杭州310009)
近期的许多研究表明他汀类药物具有促成骨作用[1-3]。我们的前期研究也证实了降脂药-辛伐他汀(simvastatin,SVS)局部注射能促进去势大鼠骨折愈合的质量[4],但他汀类药物对骨代谢的确切机制目前尚缺乏深入的研究。
骨保护蛋白(osteoprotegerin,OPG)作为一种最近发现的可溶性肿瘤坏死因子受体超家族成员,被认为对骨代谢起着重要作用。OPG是一种由成骨/基质细胞、血管内皮细胞等分泌的蛋白多糖,其通过与破骨细胞分化因子(osteoprotegerin ligand/receptor activator of nuclear factor kappa B ligand,OPGL/RANKL)竞争性结合,阻止OPGL/RANKL与破骨细胞及其前体细胞膜上的受体RANK(receptor activator of nuclear factor kappa B)相结合,从而阻断OPGL/RANKL对破骨细胞各阶段产生的作用,达到抑制骨吸收的作用[5]。已有研究表明白细胞介素(interleukin,IL)、肿瘤坏死因子 β(tumor necrosis factor β,TNF-β)、1,25 二羟基维生素 D3[1,25(OH)-D3]、骨形态发生蛋白 2(bone morphogenetic protein 2,BMP-2)、转化生长因子 β(transforming growth factor β,TGF-β)、雌激素等均能刺激成骨细胞OPG mRNA及其蛋白的表达[6-7]。虽然已有少量研究表明他汀类药物也可影响体外培养人成骨细胞或人体血液中的OPG表达水平[8-10],但目前尚缺乏体内组织学水平的研究结果。我们在前期研究的基础上,对骨折标本进一步研究,以了解去势及辛伐他汀对新生骨痂OPG表达情况的影响,为他汀类成骨作用的机制研究提供更多的证据。
材料和方法
1 动物
2月龄雌性SD大鼠(清洁级,购自浙江大学实验动物中心),初始体重178~201 g,饲养于清洁级动物房,23℃恒温,昼夜12 h。大鼠饲料含钙0.46%,含磷0.38%,自由进食自来水。
2 去势
大鼠随机分成OVX组(n=60)和假手术(sham)组(n=30)。按以往方法对大鼠行去势术[11]。术后喂养于原环境。为了减少OVX后大鼠体重的增加,对OVX组大鼠实行饮食控制(即给予和sham组大鼠等量的食物)。
术后12周,各取10只大鼠,全麻后测量右侧胫骨骨矿物含量(bone mineral density,BMD)。本实验使用双能X线吸收仪(dual-energy X-ray absorptiometer,DEXA,LUNAR Radiation),应用其配套的小动物模式进行BMD的测量,测量电压为76 kV,电流为150 μA。该仪器的准确率为0.3%,组间变异系数(CV)为1.3%。
3 骨折内固定模型
所有大鼠分成sham+vehicle组(n=30)、OVX+vehicle组(n=30)和OVX+SVS组(n=30),进一步用以建立骨折内固定模型。全麻后,在右胫骨近1/3处用骨刀平整切断胫骨,尽量不折断同侧腓骨,为稳定骨折端,用直径0.5 mm的消毒牙科钢丝(上海医用缝针厂)经胫骨结节插入,对骨折端行髓内固定,缝合切口,术后抗炎3 d(青霉素8×105U,im,每天2次)。
4 给药
骨折端皮下注射SVS或空白溶剂(vehicle),骨折手术当天注射1次,骨折后连续5 d,每天2次。按文献方法配制5%SVS溶液[1],即SVS溶解于含2%二甲亚砜和0.1%小牛血清白蛋白的PBS溶液中。每次注射5 mg·kg-1的SVS或相应体积(约30~50 μL)的vehicle溶剂。本实验的注射方法参照文献方法进行[1]。为了避免局部反复注射对骨折愈合的干扰,本实验中的局部注射是指邻近骨折端的皮下注射,而不是向骨痂内的直接注射。注射针头直径为0.4 mm,注射器最大刻度为250 μL,最小刻度为10 μL(上海医用激光仪器有限公司)。注射过程中避免对骨痂的干扰。
5 组织学分析
骨折后1、2、4周每组各取5只用作组织学分析。处死大鼠后连同骨痂周围骨膜取下右侧胫骨。抽出髓内钉,切取包含骨痂的骨段,4%多聚甲醛(pH 7.4)室温下固定24 h,EDTA 液(0.5 mol/L,pH 7.4)脱钙3~5周,每5~7 d更换新鲜脱钙液至能被细针轻松插入。PBS液冲洗,乙醇梯度脱水,石蜡包埋。纵向5μm切片,固定于经0.01% 多聚赖氨酸表面处理的载玻片上,60℃烘干过夜。
脱钙组织切片予增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(武汉博士德生物工程有限公司)和OPG抗体(sc-8468)(Santa Cruz Biotechnology)免疫组化染色,每周取5个标本,每个标本1张切片,每张切片4个高倍(×400)视野。计算每个视野下所有细胞中PCNA阳性细胞占有率(分成36个单元格计数),计算4个视野的平均值比较。对OPG免疫组化结果进行半定量分析。每张切片按染色强度记分为:弱:1;中:2;强:3。按染色范围记分为:1:<25%;2:25%~50%;3:>50%。上述评分相加所得值分级为:+:2.0 ~3.0;++:3.0 ~4.5;+++:4.5 ~6.0。
6 统计学处理
本实验为成组设计。用SPSS 11.5统计软件进行统计学分析。BMD及PCNA阳性率数据以均数±标准差(±s)表示,行方差分析。对于OPG染色情况行多组完全随机设计资料的Mann-Whitney秩和检验。以P<0.05为差异有统计学意义。
结 果
OVX后12周,sham组和OVX组胫骨BMD有显著差异[分别为(0.241 ±0.010)g/cm2和(0.219 ±0.005)g/cm2,P<0.01]。
骨折后OVX+vehicle组和OVX+SVS组分别有4只和3只大鼠死亡。无1例发生骨折端感染。3组大鼠间体重没有显著差异。
PCNA免疫组化阳性细胞呈棕黄色,定位在细胞核中,阴性细胞呈蓝色。结果显示OVX+vehicle组骨折后1、2、4周PCNA阳性率较sham+vehicle组分别下降17.3%、32.1%和26.1%(P<0.01);OVX+SVS组骨折后1、2、4周 PCNA 阳性率较 OVX+vehicle组分别增加60.1%、67.7%和67.7%(P <0.01),见图1、表1。该结果提示去势可影响骨折愈合过程中骨痂的细胞增殖,而SVS可促进骨痂细胞增殖,与我们前期的生物力学及形态学研究结果相一致[3]。
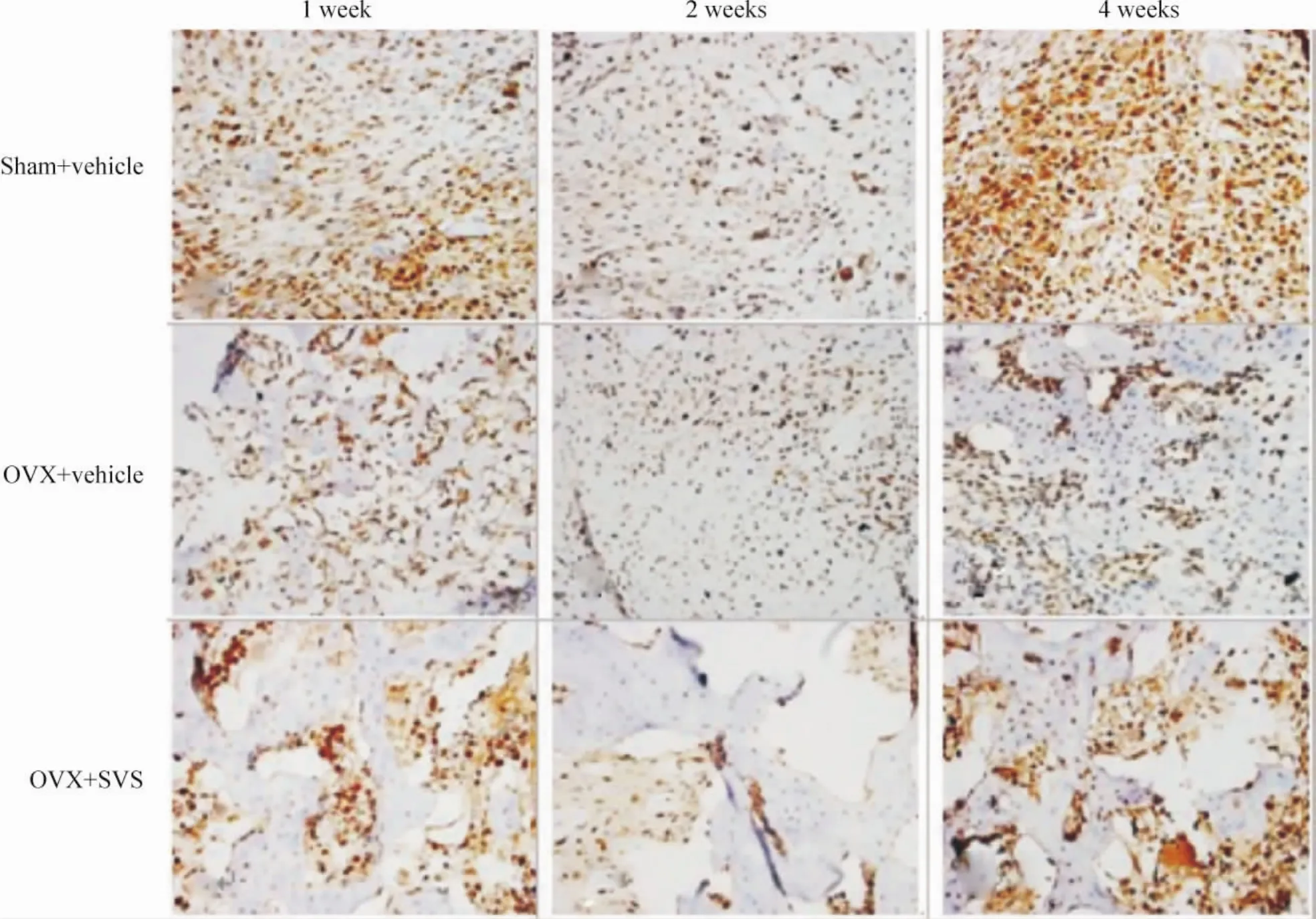
Figure 1.PCNA immunohistochemical staining of bone callus(×400).图1 骨折后各周骨痂PCNA免疫组化染色
表1 骨痂PCNA免疫组化染色阳性率比较Table 1.Comparison of PCNA positive staining(%.±s.n=5)

表1 骨痂PCNA免疫组化染色阳性率比较Table 1.Comparison of PCNA positive staining(%.±s.n=5)
△△P<0.01 vs sham+vehicle group;##P<0.01 vs OVX+vehicle group.
Group 1 week 2 weeks 4 weeks Sham+vehicle 48.51 ±4.12 53.45 ±5.68 22.80 ±2.16 OVX+vehicle 40.10 ±1.64△△ 41.10 ±1.43△△ 16.84 ±2.14△△OVX+SVS 64.21 ±4.89## 68.93 ±0.64## 28.24 ±1.67##
OPG阳性染色呈棕黄色,主要表达在成骨细胞和软骨细胞中,在骨基质中也有弥漫性黄染。半定量结果显示OVX+vehicle组OPG表达水平最低,sham+vehicle组最高,而OVX+SVS组的OPG表达水平介于2组之间,见图2、表2。OVX+SVS组与OVX+vehicle组间在骨折后各周均有极显著差异(P<0.01),OVX+vehicle组与sham+vehicle组间在骨折后1、2周也有显著差异(P<0.05)。该结果表明去势可明显减少新生骨OPG的表达,而SVS可部分阻止因去势引起的OPG分泌减少。
讨 论
本研究从动物体内组织学水平研究了去势及辛伐他汀局部应用对大鼠骨痂OPG表达的影响。
辛伐他汀口服后,绝大部分沉积在肝脏,仅5%分布在血液中[12],在骨骼中的浓度则更低,如此低的浓度极易受到很多因素的干扰从而造成临床结果的变异。同时,在正常骨骼中,由于骨重建单位相对较少,他汀类药物的骨骼作用受到一定的限制,而在骨折愈合过程中,骨重建单位大大增加,因此,骨骼对药物反应的表现将被放大。在本实验中,辛伐他汀通过局部微量注射器被注射于骨折端皮下。这样可通过局部简单扩散作用增加骨折端的药物浓度,该浓度将远比通过整体给药所能达到的骨折端浓度高。
PCNA是一个分子量为37 kD的蛋白,特异地表达于细胞增殖周期的S期。在肿瘤病理学检查中常用于判断肿瘤的良恶性。在骨折愈合过程中,PCNA的表达强度可以反映骨痂中的细胞增殖情况。本实验发现去势组骨痂PCNA表达较空白对照组低,而实验组较去势组高,差异均有显著性。该结果从另一角度证明了去势可影响大鼠骨折愈合的质量,而辛伐他汀局部注射可促进去势大鼠的骨折愈合。
骨量的维持依赖于骨形成过程与骨吸收过程之间的动态平衡,任何影响骨代谢的因素均通过调节这一动态平衡而发挥作用。抗骨质疏松药根据其作用机制可分为促成骨类药物和抗骨吸收药物,目前治疗骨质疏松的大多数药物,如雌激素、双膦酸盐类化合物、降钙素、选择性雌激素受体调节剂等,主要通过抑制骨吸收防止骨量丢失,而刺激新骨形成的药物为数很少。他汀类药物自最初被Mundy等[1]发现具有促成骨作用以来,随后的很多研究均表明他汀类药物可直接刺激成骨细胞BMP-2的表达[13-14],从而直接促进成骨细胞的成骨作用。因而他汀类药物被认为是一种具有直接促成骨作用的潜在抗骨质疏松药物。
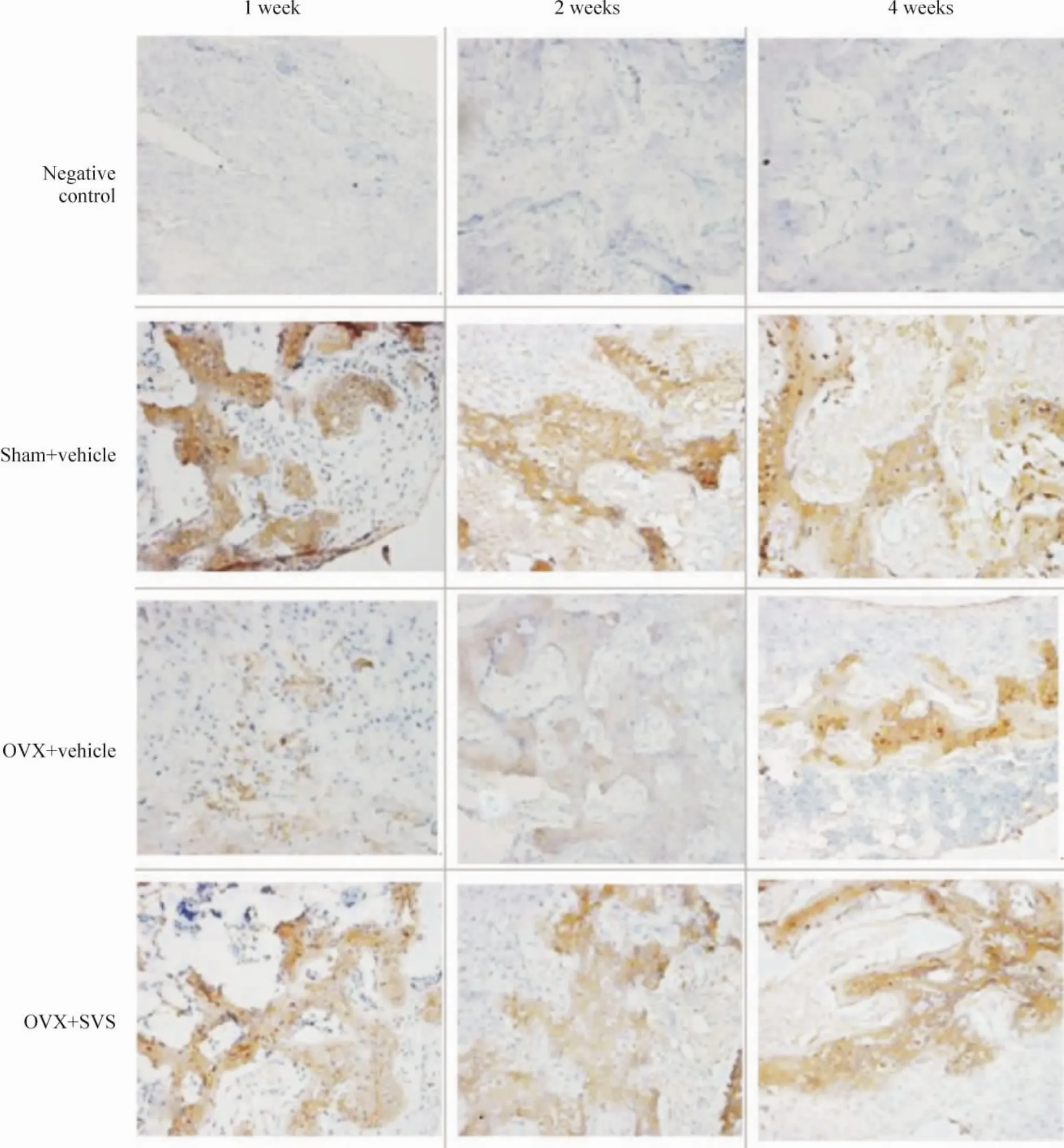
Figure 2.OPG immunohistochemical staining of bone callus(×400).图2 骨折后各周骨痂OPG免疫组化染色
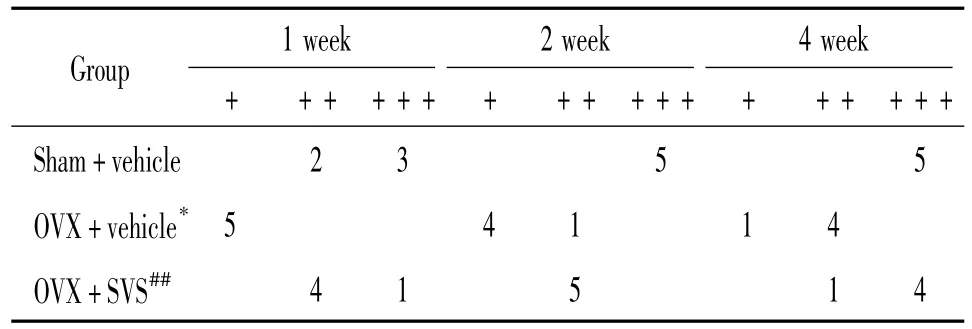
表2 骨痂OPG免疫组化阳性染色半定量分析Table 2.Semiquantitative analysis of OPG
OPG是成骨细胞分泌的一种新的TNF受体超家族成员,是成骨细胞调节破骨细胞分化及其活性的重要物质。OPG对可竞争性结合RANKL,从而抑制RANKL与破骨细胞及其细胞上RANK相结合,最终起到抑制破骨细胞增殖和分化。本实验发现,去势可使大鼠骨痂OPG表达减少,该结果从反面提示了雌激素通过OPG发挥抑制破骨细胞的作用机制,与以往的实验相一致[6]。同时,本实验还发现辛伐他汀可使去势大鼠骨痂OPG表达增加,提示他汀类药物不仅能刺激成骨细胞表达BMP-2,直接促进成骨细胞增殖分化,同时还通过刺激成骨细胞表达OPG间接抑制破骨细胞的增殖分化。
当然,本实验尚存在一些不足之处。首先,我们未能对破骨细胞的数量和功能作直接或间接的检测;其次,我们也未能对成骨细胞表达的其它因子,如BMP-2、RANKL等予以检测。尽管如此,结合目前已有的对于OPG骨调节作用的认识,本研究提示他汀类药物还具有间接抑制破骨细胞的作用。
[1] Mundy G,Garrett R,Harris S,et al.Stimulation of bone formation in vitro and in rodents by statins[J].Science,1999,286(5446):1946-1949.
[2] Montagnani A,Gonnelli S,Cepollaro C,et al.Effect of simvastatin treatment on bone mineral density and bone turnover in hypercholesterolemic postmenopausal women:a 1-year longitudinal study[J].Bone,2003,32(4):427-433.
[3] Pauly S,Luttosch F,Morawski M,et al.Simvastatin locally applied from a biodegradable coating of osteosynthetic implants improves fracture healing comparable to BMP-2 application[J].Bone,2009,45(3):505-511.
[4] 王建卫,徐少文,杨迪生.辛伐他汀局部注射对大鼠骨质疏松性骨折愈合的影响[J].中国病理生理杂志,2009,25(2):377-382.
[5] Suda T,Takahashi N,Udagawa N,et al.Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families[J].Endocr Rev,1999,20(3):345-357.
[6] Hofbauer LC,Dunstan CR,Spelsberg TC,et al.Osteoprotegerin production by human osteoblast lineage cells is stimulated by vitamin D,bone morphogenetic protein 2,and cytokines[J].Biochem Biophys Res Commun,1998,250(3):776-781.
[7] Hofbauer LC,Khosla S,Dunstan CR,et al.Estrogen stimulates gene expression and protein production of osteoprotegerin in human osteoblastic cells[J].Endocrinology,1999,140(9):4367-4370.
[8] Viereck V,Gründker C,Blaschke S,et al.Atorvastatin stimulates the production of osteoprotegerin by human osteoblasts[J].J Cell Biochem,2005,96(6):1244-1253.
[9] Nezami N,Safa J,Eftekhar-Sadat AT,et al.Lovastatin raises serum osteoprotegerin level in people with type 2 diabetic nephropathy[J].Clin Biochem,2010,43(16-17):1294-1299.
[10] Stein SH,Dean IN,Rawal SY,et al.Statins regulate interleukin-1β-induced RANKL and osteoprotegerin production by human gingival fibroblasts[J].J Periodontal Res,2011,46(4):483-490.
[11] Wang JW,Li W,Xu SW,et al.Osteoporosis influences the middle and late periods of fracture healing in a rat osteoporostic model[J].Chin J Traumatol,2005,8(2):111-116.
[12] Blum CB.Comparison of properties of four inhibitors of 3-hydroxy-3-methylglutaryl-coenzyme A reductase[J].Am J Cardiol,1994,73(14):3D-11D.
[13] Ohnaka K,Shimoda S,Nawata H,et al.Pitavastatin enhanced BMP-2 and osteocalcin expression by inhibition of Rho-associated kinase in human osteoblasts[J].Biochem Biophys Res Commun,2001,287(2):337-342.
[14] Maeda T,Matsunuma A,Kurahashi I,et al.Induction of osteoblast differentiation indices by statins in MC3T3-E1 cells[J].J Cell Biochem,2004,92(3):458-471.

