Zfp521在大鼠骨髓间充质干细胞向神经元分化过程中的表达变化及意义*
韩 瑞,周 燕,王舒阳,张广宇,彭 越,王翠琴,鲁晶晶,彭 涛,贾延劼△
(郑州大学第一附属医院1神经内科,2放射科,河南 郑州 450052)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能的多能成体干细胞,可以向神经细胞分化[1-2]。诱导MSCs分化为神经细胞,有可能在神经系统疾病的治疗和修复中提供新的可行性方法,但MSCs的分化机制及影响因素等问题研究尚不清楚[3-4]。Kamiya 等[5]研究发现,锌指蛋白521(zinc finger protein 521,Zfp521)是胚胎干细胞神经分化的关键因子之一,其作为早期的神经核蛋白,在胚胎干细胞分化为神经细胞中发挥重要的激活和促进作用。Zfp521能否在骨髓间质干细胞中表达,及Zfp521是否在MSCs的神经分化过程中发挥作用尚未有报道。本研究通过体外诱导大鼠MSCs分化为神经细胞,观察Zfp521在MSCs的表达情况及诱导前、后Zfp521的表达变化,探讨Zfp521在MSCs神经分化中的作用及意义。
材料和方法
1 动物
SPF级Wistar大鼠,鼠龄8~12周,雌雄不限,体质量150~200 g,由河南省实验动物中心提供,许可证号为SCXK(豫)2005-0001。常规从大鼠股骨中分离提取MSCs[6],连续传代10代以上的细胞置于液氮中冻存备用。
2 主要试剂
DMEM液体培养基、胎牛血清购自Gibco;神经元特异性烯醇化酶(neuron-specific enolase,NSE,sc-15343)、微管相关蛋白2(microtubule-associated protein 2,MAP-2,sc-20172)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP,sc - 9065)、Zfp521(sc-84808)兔抗多克隆抗体均购自 Santa Cruz;Cy3标记山羊抗兔IgG(H+L)购自上海碧云天公司;AEC显色试剂盒购自北京中杉金桥公司;大鼠Rn-Zfp521-siRNA(SI01690976)、阴性对照 siRNA、转染试剂 HiPerFect、RNeasy Mini试剂盒、QIAGEN® OneStep RT-PCR试剂盒均为Qiagen产品;凝聚胺、多聚赖氨酸购自Sigma;其它生化试剂均为进口分装或国产分析纯。所用引物由上海生工基因技术有限公司根据设计合成,见表1。
3 主要方法
3.1 细胞培养及实验分组 取培养第10代以上的MSCs复苏,按照2×106cells/well的比例接种于24孔细胞培养板,置于37℃、5%CO2培养箱内培养,待细胞融合率为50% ~70%时进行转染,根据转染不同,选择同时点同一培养板MSCs随机分为3组:未转染组、转染组(转染Rn-Zfp521-siRNA)和阴性对照组(转染negative control siRNA)。

表1 引物序列Table 1.Primer sequence
3.2 大鼠MSCs转染 按照Qiagen公司的操作说明书,细胞融合度达50% ~70%时,每孔加入1.1 mL完全培养基(DMEM培养基+10%胎牛血清+青、链霉素),放置于37℃、5%CO2培养箱内孵育。同时,分别取300 ng siRNA(Rn-Zfp521-siRNA、negative control siRNA),溶于 100 μL DMEM 培养基中,再加入HiPerFect转染试剂6 μL,混匀,室温孵育10 min后,将转染复合物均匀滴入含MSCs的孔内,使siRNA终浓度达到20 nmol/L,放置于37℃、5%CO2培养箱内孵育。未转染组MSCs不进行转染,其它培养条件同各转染组。转染后在倒置荧光显微镜下观察Alexa Fluor 488标记的转染组、Cy3标记的阴性对照组MSCs荧光表达情况,评价细胞转染效率。RT-PCR法进一步检测转染后各组MSCs中Zfp521表达变化。
3.3 体外诱导MSCs分化为神经细胞 参照我们的方法[7],待培养孔板内细胞融合率达50% ~70%,取诱导组进行诱导。去除DMEM完全培养基,DHanks液清洗3次,加入预诱导液(DMEM培养基+10%胎牛血清+1 mmol/L β-巯基乙醇)置于37℃、5%CO2条件下培养24 h。预诱导后,去除预诱导液,加入诱导液(DMEM培养基,10 mmol/L β-巯基乙醇),37℃、5%CO2条件下培养5 h。
3.4 免疫细胞化学染色法 将各组细胞用PBS清洗之后,迅速经4%多聚甲醛、4℃固定过夜,0.2%Triton X-100处理10 min,并用封闭液封闭1 h。然后分别用 NSE 抗体(1.0 mg/L)、MAP-2抗体(1.0 mg/L)、GFAP 抗体(1.0 mg/L)及 Zfp521 抗体(1.0 mg/L)4℃孵育24 h。用PBS洗3遍后,用Cy3标记山羊抗兔IgG(1∶200)或AEC显色试剂盒在室温下进行染色标记、观察。细胞图像通过显微镜用×20摄取。每组独立的实验都会采集超过30个区域的细胞。而且,在明视野下所采集的每幅图像都尽量包含相同的细胞数目。采用双人双盲随机记数阳性细胞,计算阳性细胞百分比例。
3.5 Western blotting 分别收集各组细胞,PBS液漂洗1遍,按照1×106加入100 μL双去污裂解液(10 mmol/L pH 6.8 Tris - H Cl,1%SDS,1%TritonX-100,100 mg/L PMSF,100 mg/L 抑肽酶)的比例充分裂解细胞,4℃ 12000 r/min离心10min,保留上清,-80℃贮存备用,以BCA法测定总蛋白浓度。SDS-PAGE采用5%浓缩胶、8%分离胶,上样量为100 μg,电压90V恒压18 min跑到浓缩分离交界处,更改电压为120V,继续电泳55min。电泳结束后取出凝胶转移至同等大小的硝酸纤维素膜上。转移后的硝酸纤维素膜置于封闭液(含5%脱脂奶粉的TBST溶液)4℃过夜,加入兔抗Zfp521多克隆抗体(1∶200),室温处理2 h,TBST 漂洗10 min×3 次;辣根过氧化物酶联抗兔IgG(1∶5000)室温处理2 h,PBST漂洗10 min×3次;ECL显色液中反应至条带清晰。
3.6 RT-PCR 采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定并计算提取的总RNA含量及浓度。参照Qiagen® OneStep RT-PCR试剂盒实验操作说明进行RT-PCR,总反应体积 50.0 μL,其中 5 × Qiagen OneStep RT - PCR Buffer 10.0 μL,dNTP Mix 2.0 μL,Qiagen OneStep RT- PCR Enzyme Mix 2.0 μL,5 × Q - Solution 10.0 μL,RNase inhibitor 10 U,RNA 1.0 μg,引物 0.6 μmol/L。扩增条件为:50℃逆转录30min,95℃ 15 min,94℃ 1 min,55℃ 1 min,72℃ 1 min,30~35个循环,72℃ 10 min。GAPDH扩增条件:94℃预变性1 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,72 ℃ 10 min。然后,取 RT -PCR 产物10.0 μL,加上样缓冲液 2.0 μL,在2%琼脂糖凝胶上电泳,70 V 40 min,凝胶图像成像系统拍摄保存实验结果,凝胶图像分析系统(GelPro Analyzer 3.0)分析,计算待测基因与内参照GAPDH平均灰度值的比值,比较各组间待测基因/GAPDH比值的大小。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据用均数±标准差()表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 大鼠MSCs转染
转染后各组细胞形态变化不显著,仅见少数细胞脱落、胞体收缩呈球形或梭形。转染组和阴性对照组转染72 h后荧光表达最强,阴性对照组评价转染效率为83.5% ±2.6%,转染组转染效率为84.1%±2.3%,见图1。RT-PCR结果显示转染组Zfp521表达较未转染组及对照组减少(P<0.05),见图2。

Figure 1.Alexa Fluor 488-labeled transfected group and Cy3-labeled negative control group(72 h after transfection,×200).A,B:transfection group;C,D:negative control group.A,C:inverted microscope;B,D:fluorescent microscope.图1 Alexa Fluor 488标记的转染组和Cy3标记的阴性对照siRNA转染

Figure 2.The expression of Zfp521 mRNA 72 h after transfection.1:non - transfection group;2:transfection group;3:negative control group.*P < 0.05 vs other groups.图2 转染72 h后Zfp521 mRNA的表达
2 β-巯基乙醇体外诱导MSCs分化为神经细胞
2.1 细胞形态学变化 诱导2 h后各组MSCs开始出现少数细胞胞体收缩呈圆形、锥形,细胞突起细长,诱导5h后,多数细胞胞体收缩呈圆形、锥形,细胞突起细长,交织成网,形成较典型的神经细胞结构。少量细胞脱落、死亡。转染组细胞诱导后细胞形态变化更加明显,未转染组和对照组类似。
2.2 诱导后神经细胞鉴定 免疫组织化学结果显示,转染组 NSE、MAP-2的阳性细胞比率分别为83.6% ±1.4%,85.4% ±1.2%,显著高于未转染组和对照组(P<0.05),但各组GFAP表达率均小于1%,见图3、表 2。Western blotting结果显示 NSE、MAP-2蛋白表达高于其它2组(P<0.05),见图4。RT-PCR显示转染组 NSE mRNA、MAP-2 mRNA表达显著高于其它2组(P<0.05),见图5。
3 Zfp521在MSCs中表达及神经分化中的变化
免疫组织化学结果显示,Zfp521在各组MSCs均有表达,诱导5 h后各组Zfp521表达均明显下降,差异显著(P<0.01),见图6、表3。Western blotting结果显示,蛋白大小为148 kD处可见Zfp521蛋白表达,诱导5 h后Zfp521表达量显著下降(P<0.01),见图7。RT-PCR显示诱导5 h后MSCs Zfp521 mRNA表达显著低于MSCs(P<0.01),见图8。

Figure 3.The expression of NSE and MAP -2 in β -mercaptoethanol-induced differentiation of MSCs into neurons 5 h after induction(×200).A,B,C:the expression of NSE;D,E,F:the expression of MAP -2;A,D:non-transfection group;B,E:transfection group;C,F:negative control group.图3 β-巯基乙醇诱导各组MSCs分化为神经细胞后NSE和MAP-2的表达
表2 β-巯基乙醇诱导5 h各组NSE和MAP-2的表达Table 2.The expression of NSE and MAP-25 h after induction by β-mercaptoethanol(%..n=10)

表2 β-巯基乙醇诱导5 h各组NSE和MAP-2的表达Table 2.The expression of NSE and MAP-25 h after induction by β-mercaptoethanol(%..n=10)
*P <0.05 vs other groups.
Group NSE MAP-2 GFAP Non-transfection 75.7 ±1.0 78.4 ±1.8 <1 Transfection 83.6 ±1.4* 85.4 ±1.2* <1 Negative control 74.3 ±0.9 77.1 ±1.5 <1

Figure 4.The expression of NSE and MAP-2 proteins 5 h after induction.1:non - transfection group;2:transfection group;3:negative control group.*P < 0.05 vs other groups.图4 NSE和MAP-2蛋白的表达

Figure 5.The expression of NSE and MAP-2 mRNA 5 h after induction..n=10.1:non-transfection group;2:transfection group;3:negative control group.*P<0.05 vs other groups.图5 NSE和MAP-2 mRNA的表达
讨 论

Figure 6.The expression of Zfp521 before and after induction(×200).A,B,C:before induction;D,E,F:after induction;A,D:non - transfection group;B,E:transfection group;C,F:negative control group.图6 诱导前后Zfp521的表达
表3 各组细胞诱导前后Zfp521的表达Table 3.The expression of zfp521 in each group before and after induction(%..n=10)
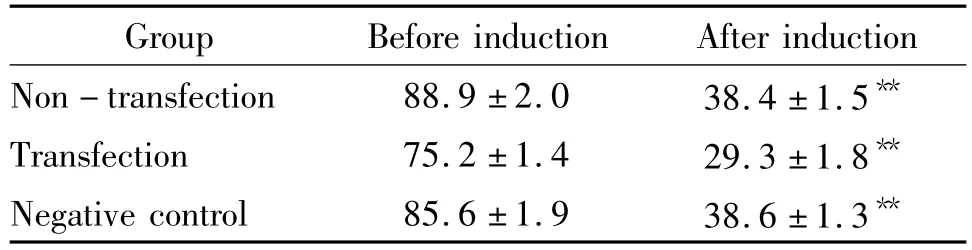
表3 各组细胞诱导前后Zfp521的表达Table 3.The expression of zfp521 in each group before and after induction(%..n=10)
**P <0.01 vs before induction.
Group Before induction After induction Non - transfection 88.9 ±2.0 38.4 ±1.5**Transfection 75.2 ±1.4 29.3 ±1.8**Negative control 85.6 ±1.9 38.6 ±1.3**
Zfp521属于C2H2型家族锌指蛋白,由1311个氨基酸序列组成,其内穿插着30个Krüppel样锌指结构域,在氨基酸末端,一种13-A元件连接到核重塑和组蛋白去乙酰化复合物(nucleosome remodelling and histone deacetylase,NuRD)中并在几个转录共抑制物中相对保守[8-10]。Zfp521广泛存在于肌肉、心脏、脾、胰、肾、淋巴结、胸腺及胎儿肝组织,在脑组织内Zfp521含量也十分丰富,尤其在小脑[11-13]。它在鼠的类同源物,Evi/Zfp521,在造血祖细胞、神经干细胞、小脑颗粒层原始神经细胞及发育中的纹状体中含量均为丰富[9],Zfp521在发育中及成熟神经干细胞中高表达提示在中枢神经系统的个体发育及特殊功能调节方面发挥了重要作用[14]。但 Zfp521在MSCs中是否表达尚未有报道,本研究通过对两组细胞中Zfp521表达量进行检测,发现大鼠MSCs可表达 Zfp521,且表达率可达 88.9% ±2.0%,提示Zfp521在骨髓间质干细胞的发育和维持上发挥了重要作用。
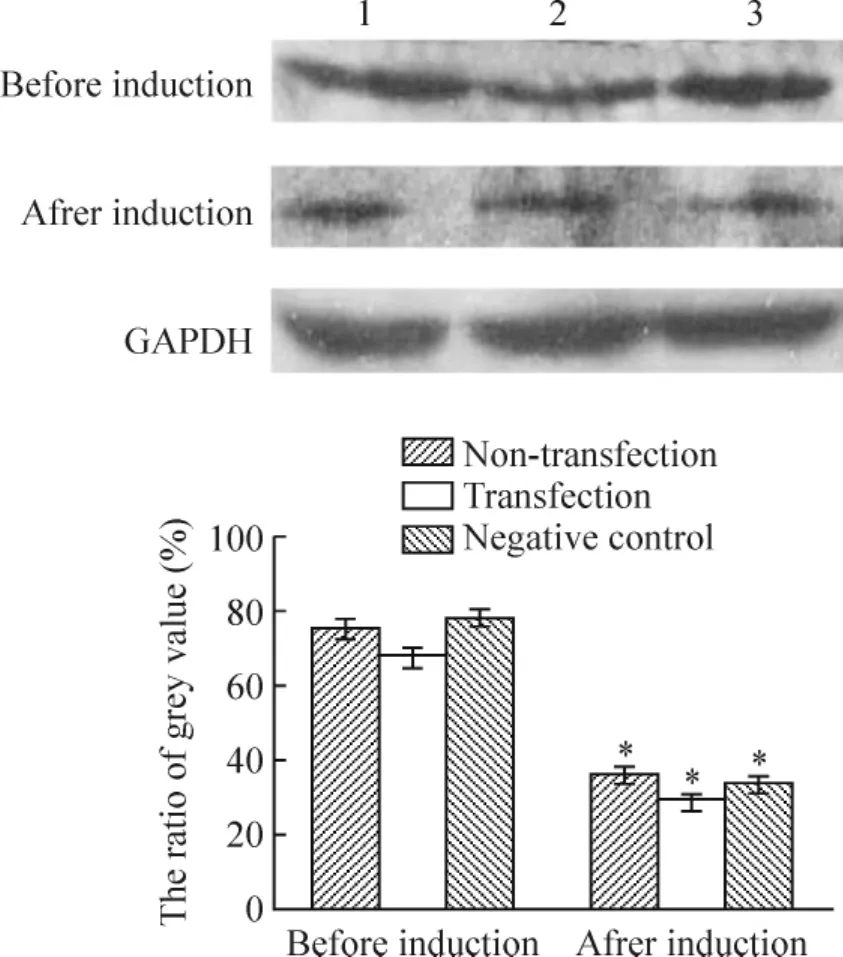
Figure 7.The expression of Zfp521 protein before and after induction..n=10.1:non-transfection group;2:transfection group;3:negative control group.*P <0.05 vs before induction.图7 诱导前后Zfp521蛋白的表达

Figure 8.The expression of Zfp521 mRNA before and after induction..n=10.1:non-transfection group;2:transfection group;3:negative control group.*P <0.05 vs before induction.图8 诱导前后Zfp521 mRNA的表达
进一步研究发现,Zfp521作为转录因子,不仅可以特异性结合DNA和RNA,还能与DNA-RNA杂交双链分子以及其它锌指蛋白或自身结合,与基因表达调控、细胞分化、胚胎发育、干细胞调节及肿瘤形成有密切关系[8]。Kamiya 等[5]研究发现,在胚胎干细胞中,Zfp521作为早期的神经核蛋白,具有有效的神经分化激活作用,尤其在促进外胚层祖细胞向神经外胚层转化中发挥重要激活作用,通过建立的过表达Zfp521模型中,发现Sox1、Sox3及Pax6基因表达增加,而Oct6或Fgf5基因表达未有增加,提示Zfp521在促进干细胞神经分化中是通过激活早期神经外胚层基因,而不是抑制非神经相关基因的表达。研究发现[5],在神经分化抑制因子骨形态发生蛋白4(bone morphogenetic proteins 4,BMP4)存在状态下,强制表达Zfp521也可使胚胎干细胞进行神经分化。Zfp521可与其共激活物 p300(p300 coactivator)结合,激活早期神经相关基因,处于外胚层状态的胚胎干细胞分化为神经外胚层祖细胞,进而分化为神经祖细胞,也可通过减少神经相关抑制因子促进神经分化。研究发现,在一些未成熟细胞的分化过程中Zfp521的表达量逐渐下降[15]。但在骨髓间质干细胞的神经分化过程中Zfp521的表达变化尚未有报道。本研究通过检测MSCs诱导分化前后两组细胞Zfp521的表达量,免疫组织化学法检测诱导前MSCs中Zfp521表达率为88.9% ±2.0%,分化为神经细胞后Zfp521的表达明显下降,表达率为38.4% ±1.5%,抑制Zfp521表达可提高MSCs的神经分化效率,RT-PCR及Western blotting法检测显示有同样的结果,提示Zfp521在MSCs的神经分化过程中可能发挥了重要调控作用。其可能的作用机制为:一方面,Zfp521可能通过其N-端13-AA基序连接到NuRD复合物,募集NuRD蛋白,并与其它转录因子反应,作用于靶基因,在转录和翻译水平上调控基因的表达[13]。另一方面,Zfp521是骨形态发生蛋白(bone morphogenetic proteins,BMP)信号转导通路中的一个分子,BMP通路在细胞分化、发育过程中发挥重要作用[8,16],在 BMP2 和 BMP4 途径中,Zfp521 与转录因子SMAD-1、SMAD-4结合形成复合物,进入细胞核作用于靶基因,对干细胞增殖及分化发挥重要的调控作用[16]。抑制Zfp521可能减弱了BMP的抑制作用,从而促进神经分化。
综上所述,通过本研究发现,骨髓间质干细胞中Zfp521表达量较高,诱导MSCs分化为神经细胞后,Zfp521表达量明显下降,抑制Zfp521可促进神经细胞的分化,提示Zfp521在MSCs诱导分化为神经细胞过程中可能发挥重要调控作用。但Zfp521在MSCs神经分化过程中具体作用机制尚不明确,有待于进一步研究。
[1]Uccelli A,Laroni A,Freedman MS.Mesenchymal stem cells for the treatment of multiple sclerosis and other neurological diseases[J].Lancet Neurol,2011,10(7):649-656.
[2]Jia Y,Sun J,Zhou Y,et al.Effects of Notch-1 signalling pathway on differentiation of marrow mesenchymal stem cells into neurons in vitro[J].Neuroreport,2007,18(14):1443-1447.
[3]陈柏龄,陈东平,张志坚,等.Ang-1基因修饰的骨髓间质干细胞移植治疗脑梗死的实验研究[J].中国病理生理杂志,2009,25(2):241 -247.
[4]景黎君,贾永林,鲁晶晶,等.MicroRNA-9-1慢病毒载体的构建及其对小鼠骨髓间质干细胞诱导分化为神经细胞的影响[J].中国病理生理杂志,2011,27(2):326-331.
[5]Kamiya D,Banno S,Sasai N,et al.Intrinsic transition of embryonic stem-cell differentiation into neural progenitors[J].Nature,2011,470(7335):503 -509.
[6]叶伟标,邓宇斌,叶美红,等.慢病毒载体介导HIF-1α基因修饰骨髓间质干细胞促进脑缺血大鼠的神经功能恢复[J].中国病理生理杂志,2010,26(2):256-261.
[7]Jing L,Jia Y,Lu J,et al.MicroRNA -9 promotes differentiation of mouse bone mesenchymal stem cells into neurons by Notch singaling[J].Neuroreport,2011,22(5):206-211.
[8]Hesse E,Kiviranta R,Wu M,et al.Zinc finger protein 521,a new player in bone formation[J].Ann N Y Acad Sci,2010,1192(1):32 -37.
[9]Bond HM,Mesuraca M,Amodio N,et al.Early hematopoietic zinc finger protein-zinc finger protein 521:A candidate regulator of diverse immature cells[J].Int J Biochem Cell Biol,2008,40(5):848 -854.
[10]La Rocca R,Fulciniti M,Lakshmikanth T,et al.Early hematopoietic zinc finger protein prevents tumor cells[J].J Immunol,2009,182(8):4529 -4537.
[11]Bond HM,Mesuraca M,Carbone E,et al.Early hematopoietic zinc finger protein(EHZF),the human homolog to mouse Evi3,is highly expressed in primitive human hematopoietic cells[J].Blood,2004,103(6):2062-2071.
[12]Warming S,Liu P,Suzuki T,et al.Evi3,a common retroviral integration site in murine B -cell lymphoma,encodes an EBFAZ - related Krüppel- like zinc finger protein[J].Blood,2003,101(5):1934-1940.
[13]Warming S,Rachel RA,Jenkins NA,et al.Zfp423 is required for normal cerebellar development[J].Mol Cell Biol,2006,26(18):6913 -6922.
[14]Garcia - Dominquez M,Poquet C,Garel S,et al.Ebf gene function is required for coupling neuronal differentiation and cell cycle exit[J].Development,2003,130(24):6013-6025.
[15]Matsubara E,Sakai I,Yamanouchi J,et al.The role of zinc finger protein 521/early hematopoietic zinc finger protein in erythroid cell differentiation[J].J Biol Chem,2009,284(6):3480 -3487.
[16]Ku M,Howard S,Ni W,et al.OAZ regulates bone morphogenetic protein signaling through Smad6 activation[J].J Biol Chem,2006,281(8):5277-5287.

