PI3K信号通路对哮喘小鼠调节性T细胞与Th17失衡的调控作用*
聂 颖,张维溪, 崇 蕾,王 婷, 李昌崇
(温州医学院附属育英儿童医院呼吸科,浙江 温州 325027)
T淋巴细胞在支气管哮喘(简称哮喘)气道炎症中发挥着核心作用。调节性T细胞(regulatory T cells,Treg)和辅助性 T 细胞 17(T helper 17 cells,Th17)是来源于共同初始T细胞的两类辅助性T细胞,它们在分化和功能上均有相互抑制作用,促炎作用的Th17和抑炎作用的Treg细胞的失衡可以诱导哮喘等免疫性疾病的发生[1-2]。磷酯酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)是一类特异性催化磷酯醇(phosphatidylinositol,PI)3位羟基磷酸化,产生肌醇酯质产物的激酶。研究表明,PI3K参与哮喘的慢性气道炎症过程,在哮喘T细胞的活化、分化及细胞因子的产生中发挥着重要作用[3-4]。本实验通过建立BALB/c哮喘小鼠模型,体外培养T细胞,在细胞水平研究PI3K信号能否影响Treg/Th17失衡,并检测Treg/Th17分化的特异性转录因子Foxp3和RORγt,及特异性分泌因子白细胞介素(interleukin,IL)-10、IL-17的表达变化,探讨PI3K信号通路是否参与Treg/Th17失衡的调节。
材料和方法
1 主要试剂
鸡卵清蛋白(ovalbumin,OVA,Sigma),植物血凝素(phytohemagglutinin,PHA,Sigma);白细胞介素 2(Cinterleukin-2,IL-2)(上海华新生物技术有限公司);红细胞裂解液(Solarbio);RPMI-1640(Gibco);胎牛血清(杭州四季青公司);尼龙毛(Kisker);流式主要抗体:兔抗小鼠 CD4T细胞 -FITC(eBioscience);兔抗小鼠CD25T细胞-PE(eBioscience);IL-10 ELISA kit(R&D Systems);IL-17 ELISA kit(R&D Systems);Trizol(Invitrogen);逆转录-聚合酶链反应(RT-PCR)试剂盒(Fermentas);引物(上海基康公司合成);PI3K抑制剂LY294002(Sigma)。
2 动物
SPF级雄性BALB/c小鼠,4~6周,体重18~22 g,均购自上海斯莱克实验动物有限公司,饲养于温州医学院SPF级实验动物中心。
3 哮喘动物模型的建立[5]
第1 d和第13 d经小鼠腹腔注射0.01%OVA/Al(OH)3混合液 0.1 mL[内含 OVA 10 μg 和Al(OH)3凝胶20 mg]致敏,第25 d至第32 d,每天将小鼠置于5 L密闭容器中,以1%OVA生理盐水溶液雾化激发,使小鼠暴露在OVA气雾中45 min,由喷射雾化器雾化。对照组小鼠,以生理盐水代替OVA。于末次激发后12 h内颈椎脱臼处死,取脾脏以备T细胞培养所用。
4 小鼠脾脏原代T细胞的分离及纯度和存活率的检测
无菌分离对照组和哮喘组BALB/c小鼠脾脏细胞,200目尼龙膜过滤。加入红细胞裂解液破红,PBS液洗涤2次,用含10%胎牛血清的RPMI-1640培养基重悬细胞,接种25 cm2培养瓶中培养2 h,除去贴壁细胞,调整细胞浓度为1×1011/L,加入尼龙毛柱中孵育60 min,除去与尼龙毛结合的B淋巴细胞,收集T淋巴细胞。采用流式细胞仪检验尼龙毛柱分选后T细胞的纯度。以0.4%台盼蓝对T细胞进行染色,观察细胞存活率,细胞存活率按下式计算:细胞存活率(%)=(染色阴性细胞数/细胞总数)×100%。
5 T细胞分组培养及干预
分别将对照组和哮喘组BALB/c小鼠的T淋巴细胞用含10%胎牛血清(FCS)的RPMI-1640培养基重悬,调整T细胞浓度(1×109/L),分别铺于24孔,各为1 mL的细胞悬液,置于37℃、5%CO2孵箱中培养,按以下2组方案进行体外干预:对照组(A组)分为2个亚组:空白对照组 A1(对照组T淋巴细胞+PBS 5 μL),PI3K抑制剂对照组A2(对照组T淋巴细胞+LY29400220 μmol/L);哮喘组(B组)继续分为4个亚组:哮喘组B1(哮喘组T淋巴细胞+PBS 5 μL),5 μmol/L PI3K 抑制剂组 B2(哮喘组 T淋巴细胞 +LY2940025 μmol/L),10 μmol/L PI3K抑制剂组B3(哮喘组T淋巴细胞+LY29400210 μmol/L),20 μmol/L PI3K 抑制剂组B4(哮喘组T淋巴细胞 +LY29400220 μmol/L),各组均加入 10 mg/L PHA和1×106U/L IL-2与细胞共培养6 h后,实验组各孔按上述分组加入干预剂,空白对照组加入等体积培养液,72 h后收获细胞。
6 Treg细胞比例的测定
收集 A1、A2、B1、B2、B3、B4 各组的细胞 1 ×106个,PBS洗涤1次,各管分别加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD4单克隆抗体20 μL,藻红蛋白(PE)标记的CD8单克隆抗体20 μL,避光孵育30 min,PBS洗2次。用流式细胞仪检测,每个样品测定10000个细胞,分析CD4和CD8的双阳性细胞数来确定各检测管中Treg细胞的表达比例。
7 各组T细胞上清液中IL-10和IL-17水平的检测
采用酶联免疫吸附反应(ELISA)法检测,具体操作严格按照试剂盒说明书进行。
8 各组T细胞中转录因子Foxp3和RORγt mRNA表达水平的检测
采用RT-PCR法检测。细胞匀浆并用Trizol法抽提RNA,继之根据试剂盒说明书进行逆转录反应,然后进行Foxp3、RORγt和β-actin产物扩增。PCR反应体系总体积25 μL,将反应物94℃预变性5 min后,94℃ 30 s,72℃ 1 min,循环32次,72℃ 10 min,见表1。用Gel-Pro Analyzer 4.0软件进行图像分析,计算目的产物荧光强度与β-actin产物荧光强度比值,作为Foxp3和RORγt mRNA的相对表达量。

表1 各对引物序列及扩增条件Table 1.Primer sequence and amplification conditions
9 统计学处理
应用SPSS 16.0统计软件进行分析。计量资料用均数±标准差()表示。采用单因素方差分析对各组进行分析,方差齐性者采用SNK法进行多重比较;方差不齐性者采用Dunnett's T3;相关性分析采用Spearman分析,以P<0.05为差异有统计学意义。
结 果
1 小鼠脾脏细胞分选后T细胞的纯度和存活率
流式细胞仪分析结果显示,运用尼龙毛柱法分离后获得的T细胞,纯度达到(74.12±3.08)%,T细胞的存活率分别为(92.82±3.21)%,其中1次结果见图1。
多年来的退田还湖是值得肯定的。尽管如此,武昌湖周边圩区仍然是主要农耕区,提高圩区防洪能力是治水主要措施。为什么不能继续退田还湖?既然洪涝威胁性大,不如退地求湖,改变利用方式,以退为进。

Figure 1.Purity of T cells in splenocytes after separation.A:negative control;B:T cell ratio in splenocytes.图1 脾脏T细胞的纯度分析
2 各组中Treg细胞比例的变化
Treg细胞比例B1组[(3.57±0.35)%]显著低于A1组[(8.93±0.74)%](P<0.01);A2组[(14.73±1.75)%]显著高于A1组(P<0.05);B3组[(5.63±0.46)%]和B4组[(7.08±0.40)%]显著高于 B1组(均 P<0.01);B2组[(4.53±0.40)%]与 B1组比较,差异无统计学意义(P>0.05),见表2、图2 ~4。
表2 各组T细胞中CD4+CD25+Treg细胞百分比Table 2.The percentage of CD4+CD25+Treg from each group(%..n=4)
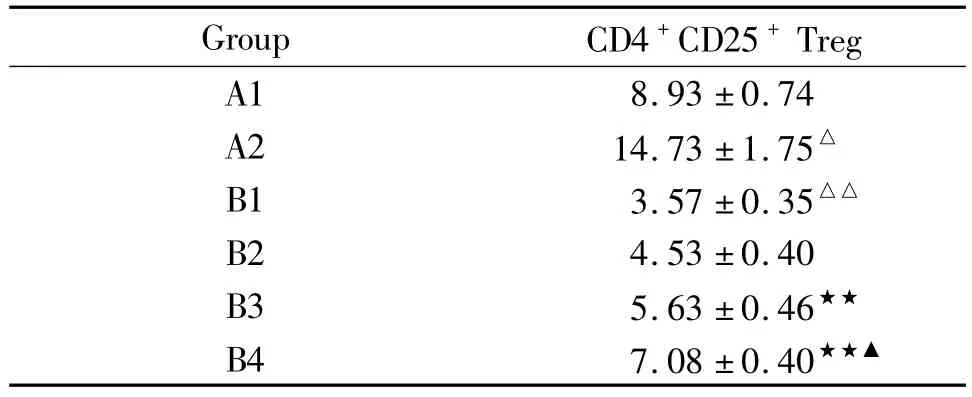
表2 各组T细胞中CD4+CD25+Treg细胞百分比Table 2.The percentage of CD4+CD25+Treg from each group(%..n=4)
△P<0.05,△△P <0.01 vs A1 group;★★P <0.01 vs B1 group;▲P <0.05 vs B3 group.A1:T cells from normal mice;A2:PI3K inhibitor-treated T cells from normal mice;B1:T cells from asthma mice;B2:5 μmol/L PI3K inhibitor-treated T cells from asthma group;B3:10 μmol/L PI3K inhibitor-treated T cells from asthma group;B4:20 μmol/L PI3K inhibitor-treated T cells from asthma group.
Group CD4+CD25+Treg A1 8.93±0.74 A2 14.73±1.75△B1 3.57 ±0.35△△B2 4.53±0.40 B3 5.63 ±0.46★★B4 7.08±0.40★★▲
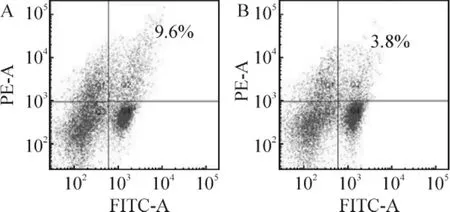
Figure 2.Flow cytometric analysis of CD4+CD25+Treg from blank control group and asthma group.A:A1 group;B:B1 group.A1:T cells from normal mice;B1:T cells from normal mice.图2 空白对照组与哮喘组CD4+CD25+Treg细胞流式分析图
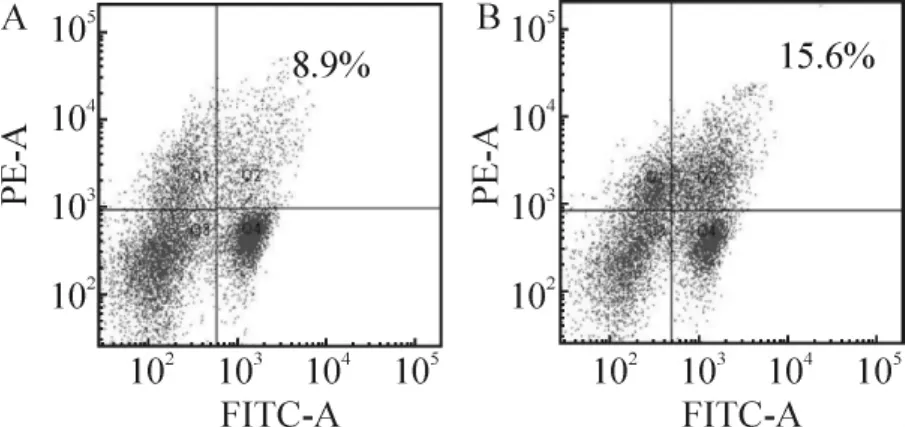
Figure 3.Flow cytometric analysis of CD4+CD25+Treg from blank control group and PI3K inhibitor control group.A:A1 group;B:A2 group.A1:T cells from normal mice;A2:PI3K inhibitor-treated T cells from normal mice.图3 空白对照组与PI3K抑制剂对照组CD4+CD25+Treg细胞流式分析图
3 各组中T细胞上清液中IL-10和IL-17的含量变化
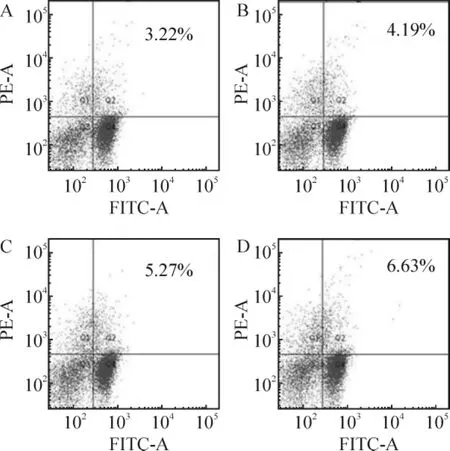
Figure 4.Flow cytometric analysis of CD4+CD25+Treg from different groups.A:B1 group;B:B2 group;C:B3 group;D:B4 group;B1:T cells from asthma mice;B2:5 μmol/L PI3K inhibitor-treated T cells from asthma group;B3:10 μmol/L PI3K inhibitor-treated T cells from asthma group;B4:20 μmol/L PI3K inhibitortreated T cells from asthma group.图4 哮喘各干预组CD4+CD25+Treg细胞流式分析图
IL-17水平B1组[(51.01±3.33)ng/L]显著高于A1组[(19.65±1.74)ng/L](P<0.01);A2组[(12.29±1.34)ng/L]显著低于A1组(P<0.01);B2组[(43.56±1.72)ng/L]、B3组[(32.36±1.78)ng/L]和 B4组[(26.92±1.38)ng/L]显著低于 B1组(均P<0.01),且呈药物浓度依赖性下降;与之相反,IL-10水平B1组[(12.46±1.65)ng/L]显著低于A1组[(57.47±1.72)ng/L](P<0.01);A2组[(71.36±5.42)ng/L]显著高于 A1组(P<0.01);B2组[(21.23±3.86)ng/L]、B3组[(35.73±4.53)ng/L]和 B4组[(38.73±6.11)ng/L]显著高于 B1组(均P<0.01);且呈药物浓度依赖性增高,见表3。
表3 各组T细胞上清液中IL-10和IL-17的水平Table 3.Levels of IL-10 and IL-17 in T cells from different groups(ng/L..n=8)
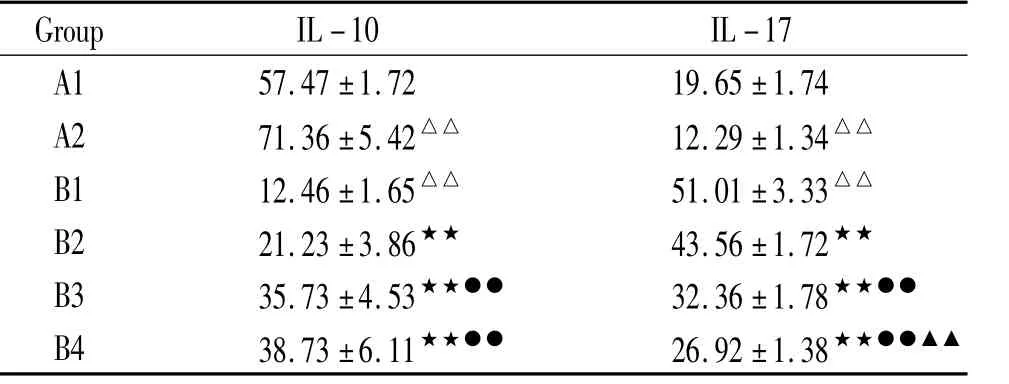
表3 各组T细胞上清液中IL-10和IL-17的水平Table 3.Levels of IL-10 and IL-17 in T cells from different groups(ng/L..n=8)
△△P <0.01 vs A group;★★P <0.01 vs B1 group;●●P <0.01 vs B2 group;▲▲P <0.01 vs B3 group.A1:T cells from normal mice;A2:PI3K inhibitor-treated T cells from normal mice;B1:T cells from asthma mice;B2:5 μmol/L PI3K inhibitor-treated T cells from asthma group;B3:10 μmol/L PI3K inhibitor-treated T cells from asthma group;B4:20 μmol/L PI3K inhibitor-treated T cells from asthma group.
A1 57.47±1.72 19.65±1.74 A2 71.36±5.42△△ 12.29±1.34△△B1 12.46±1.65△△ 51.01±3.33△△B2 21.23±3.86★★ 43.56±1.72★★B3 35.73±4.53★★●● 32.36±1.78★★●●B4 38.73±6.11★★●● 26.92±1.38★★●●▲▲
4 各组T细胞中转录因子Foxp3 mRNA和RORγt mRNA表达变化
RORγt mRNA表达 B1组(0.31±0.06)显著高于A1组(0.08±0.02)(P<0.01);A2组(0.05±0.01)显著低于 A1组(P<0.05);B2组(0.22±0.04)、B3组(0.15±0.04)和B4组(0.09±0.03)显著低于 B1组(分别为 P <0.05,P<0.01,P<0.01),且呈药物浓度依赖性降低。Foxp3 mRNA表达B1组(0.40±0.11)显著低于A1组(1.22±0.32)(P<0.01);A2组(1.44±0.28)显著高于 A1组(P<0.01);B2组(0.57±0.08)、B3组(0.82±0.22)和B4组(1.04±0.31)均显著高于B1组(分别为P<0.05,P <0.01,P <0.01),见图 5。
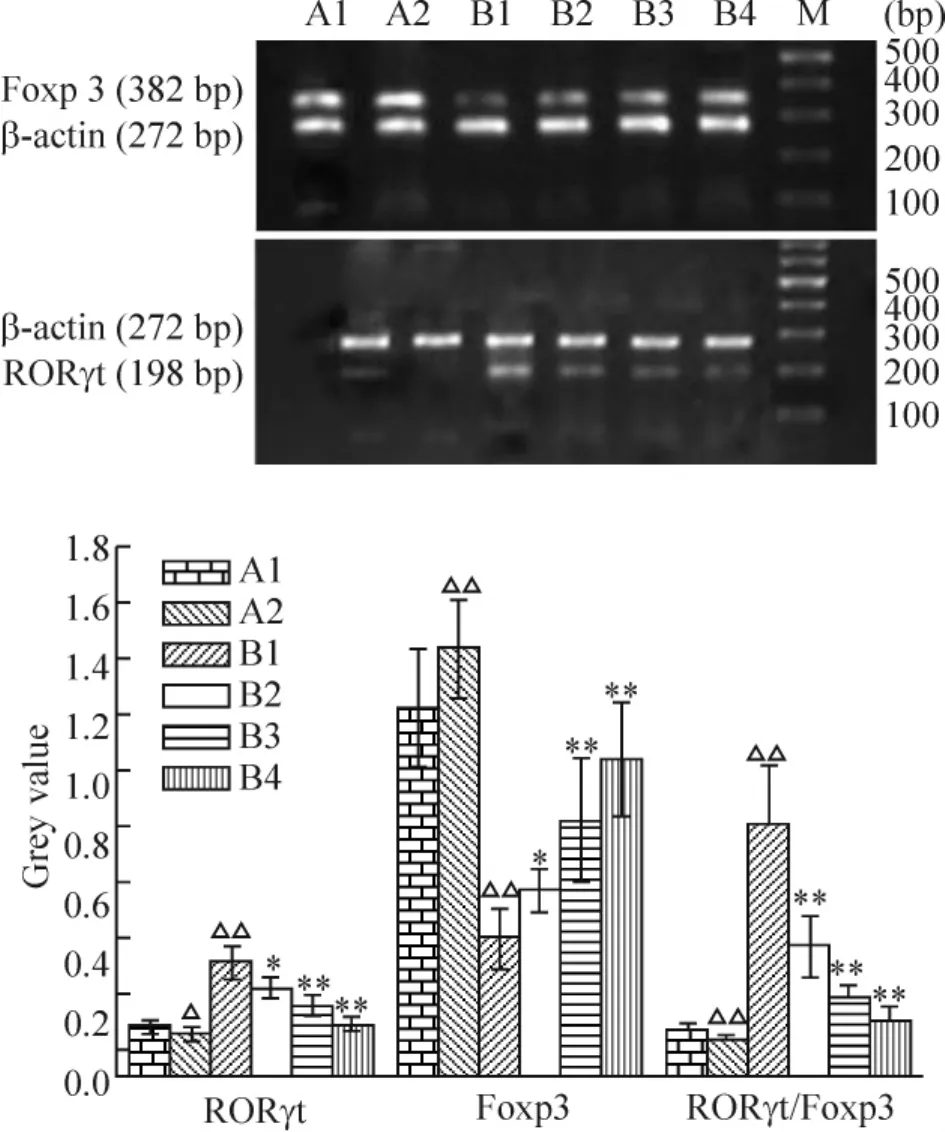
Figure 5.The expression of Foxp3,RORγt mRNA and RORγt/Foxp3 in different groups.M:DNA marker;A1:T cells from normal mice;A2:PI3K inhibitor-treated Tcells from normal mice;B1:T cells from asthma mice;B2:5 μmol/L PI3K inhibitor-treated T cells from asthma group;B3:10 μmol/L PI3K inhibitor-treated T cells from asthma group;B4:20 μmol/L PI3K inhibitortreated T cells from asthma group..n=8.△P<0.05,△△P <0.01 A1 group;*P <0.05,**P <0.01 vs B1 group.图5 各组T细胞组转录因子Foxp3和RORγt mRNA的表达
5 各组T细胞中转录因子RORγt mRNA/Foxp3 mRNA比值的变化
B1组RORγt mRNA/Foxp3 mRNA(0.83±0.26)显著高于A1组[(0.07±0.02)](P<0.01);A2组[(0.04±0.01)]显著低于A1组(P<0.01);B2组(0.37±0.11)、B3组(0.18±0.05)和B4组(0.10±0.04)显著低于B1组(均P<0.01),且呈浓度依赖性降低,见图5。
6 RORγt mRNA/Foxp3 mRNA的比值与细胞因子IL-10和IL-17表达水平相关关系分析
RORγt mRNA/Foxp3 mRNA的比值与 Th17特异性细胞因子IL-17的分泌呈正相关(r=0.89,P<0.01),而与Treg特征性细胞因子IL-10的分泌呈负相关(r=-0.86,P <0.01)。
讨 论
T淋巴细胞是哮喘主要效应细胞之一。Th17和Treg细胞的生物学功能和分化过程相拮抗,促炎的Th17细胞和抑炎的Treg细胞相互制约以维持体内的免疫平衡。一旦Th17/Treg平衡失调,出现Th17优势反应,出现异常免疫反应导致哮喘等免疫性疾病的发生[1-2]。
Treg细胞是CD4+T细胞的一个重要亚型,通过细胞间的接触及分泌抑制性细胞因子(如IL-10或TGF-β等)来发挥免疫抑制作用[2]。有研究表明[6],哮喘患者体内Treg细胞的数量和功能都出现下降,与本实验结果一致。同时我们的研究还表明,PI3K抑制剂LY294002在对照组和哮喘组内均介导了活化T细胞向Treg的分化,且在哮喘组内随着PI3K抑制浓度的增加Treg细胞逐渐增加,其结果提示PI3K信号通路通过对Treg细胞功能的调节而参与哮喘的发病过程,与 Liu 等[7]和 Patton 等[8]报道一致。
本研究发现,哮喘组较对照组脾脏T细胞中RORγt mRNA水平显著增高,伴随Th17的效应性细胞因子IL-17表达增高;而Foxp3 mRNA的表达明显降低,伴随Treg相关因子 IL-10表达下降,且RORγt/Foxp3比值增高,提示哮喘发生的可能机制与Th17/Treg失衡导致的免疫絮乱有关。
Sauer等[14]研究发现,PI3K 信号抑制剂通过调节TCR/CD28活化信号而参与Foxp3的诱导生成。我们在此基础上发现,PI3K信号不仅影响Foxp3的表达而且对RORγt的表达也具有显著作用。本实验应用PI3K抑制剂LY294002对哮喘T细胞进行干预发现,随着干预剂浓度的增加,Foxp3 mRNA的表达及IL-10水平逐渐增高;而RORγt mRNA及IL-17水平明显下降,且RORγt/Foxp3比例逐渐下降,各水平的变化呈浓度依赖性,且在对照组内变化与哮喘组一致,表明PI3K信号通路对哮喘Th17/Treg失衡起着调控作用。
总之,本实验证实哮喘小鼠T淋巴细胞中存在Th17/Treg失衡,而PI3K信号通路参与Th17/Treg失衡的调节,其机制可能是PI3K信号特异性抑制剂上调了特异性转录因子Foxp3的表达而间接抑制了RORγt的表达,使RORγt/Foxp3的表达优势发生改变,进而减轻Th17优势分化,使免疫失衡减轻,表现为其代表性细胞因子IL-10的升高和IL-17的下降。进一步深入研究PI3K信号通路与Th17/Treg平衡的调节机制,将为哮喘提供新的治疗靶点。
[1]Awasthi A,Murugaiyan G,Kuchroo VK.Interplay between effector Th17 and regulatory T cells[J].J Clin Immunol,2008,28(6):660-670.
[2]Palomares O,Yaman G,Azkur AK,et al.Role of Treg in immune regulation of allergic diseases[J].Eur J Immunol,2010,40(5):1232-1240.
[3]Deane JA,Fruman DA.Phosphoinositide 3-kinase:diverse roles in immune cell activation[J].Annu Rev Immunol,2004,22(1):563-598.
[4]Ghigo A,Damilano F,Braccini L,et al.PI3K inhibition in inflammation:Toward tailored therapies for specific diseases[J].Bioessays,2010,32(3):185-196.
[5]张维溪,李昌崇,程晓明,等.哮喘小鼠支气管MIP-1α、RANTES基因和蛋白的表达[J].中国病理生理杂志,2004,20(5):858-861.
[6]Hartl D,Koller B,Mehlhorn AT,et al.Quantitative and functional impairment of pulmonary CD4+CD25hiregulatory T cells in pediatric asthma[J].J Allergy Clin Immunol,2007,119(5):1258-1266.
[7]Liu D,Zhang T,Marshell AJ,et al.The p110δ isoform of phosphatidylinositol 3-kinase controls susceptibility to Leishmania major by regulating expansion and tissue homing of regulatory T cells[J].J Immunol,2009,183(3):1921-1933.
[8]Patton DT,Garden OA,Pearce WP,et al.Cutting edge:the phosphoinositide 3-kinase p110 delta is critical for the function of CD4+CD25+Foxp3+regulatory T cells[J].J Immunol,2006,177(10):6598-6602.
[9]Sakaguchi S.Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self[J].Nat Immunol,2005,6(4):345-352.
[10]Ivanov II,McKenzie BS,Zhou L,et al.The orphan nuclear receptor RORγt directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(6):1121-1131.
[11]Ichiyama K,Yoshida H,Wakabayashi Y,et al.Foxp3 inhibits RORγt-mediated IL-17A mRNA transcription through direct interaction with RORγt[J].J Biol Chem,2008,283(25):17003-17008.
[12]Zhou L,Lopes JE,Chong MM,et al.TGF-β-induced Foxp3 inhibits TH17 cell differentiation by antagonizing RORγt function[J].Nature,2008,453(7192):236-240.
[13]Ziegler SF,Buckner JH.FOXP3 and the regulation of Treg/Th17 differentiation[J].Microbes Infect,2009,11(5):594-598.
[14]Sauer S,Bruno L,Hertweck A,et al.T cell receptor signaling controls Foxp3 expression via PI3K,Akt and mTOR[J].Proc Natl Acad Sci USA,2008,105(22):7797-7802.

