复方美托洛尔-氨氯地平双层片体外释放度方法研究
沈淑媛 吴 赟 王成港 王杏林
1.天津中医药大学,天津 300193;2.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300193
酒石酸美托洛尔为水溶性β受体阻滞剂,口服1.5 h血药浓度达峰值,半衰期3~5 h,为减少服药次数可制成缓释制剂[1];苯磺酸氨氯地平为二氢吡啶类钙拮抗剂,口服不受食物影响、生物利用度高,6~12 h达到峰浓度,血浆半衰期长(36~45 h)[2]。二者通过不同的作用途径,达到了相同的降血压效果。两者联合不仅能协同降低血压,而且可抑制由于降压而引起的反射性心率增快,同时可以减少对心、脑、肾等靶器官的毒副作用。由阿斯利康公司研发的复方琥珀酸美托洛尔氨氯地平缓释片(SelomaxTM)在国外已上市,而国内尚无此类产品上市。笔者对复方酒石酸美托洛尔-苯磺酸氨氯地平双层片进行了研究开发,本文主要考察了自制美托洛尔-氨氯地平双层片的体外释放度。
1 材料与试药
1.1 仪器
紫外可见分光光度计UV2550(日本岛津),安捷伦高效液相色谱仪1200(美国安捷伦公司),AB104N型电子天平(瑞士 METTLER TOLEDO),智能溶出试验仪(ZRS-8G)(天大天发科技有限公司)。
1.2 药品
酒石酸美托洛尔(广州汉方现代中药研究开发有限公司,批号:00239),苯磺酸氨氯地平(常州亚邦制药有限公司,批号:M100401),磷酸二氢钾(天津博迪化工股份有限公司,批号:20101201),盐酸(天津市凯信化学有限公司),乙腈(天津市康科德科技有限公司)。
2 方法与结果
2.1 材料的制备
2.1.1 缓释层的制备
将酒石酸美托洛尔与新型预胶化淀粉缓释骨架材料SWELSTARTM MX-1、乳糖等辅料混匀,加入适量黏合剂(10%PVP及乙醇溶液)制软材,过30目筛制粒,在60℃烤箱中干燥0.5 h,取出,过30目筛整粒,加入适量硬脂酸镁,混匀即得。
2.1.2 速释层的制备
根据预试验知速释层可以采用粉末直接压片法制备,先将各辅料按处方量混合均匀,再将苯磺酸氨氯地平按等量递加法与辅料混合,即得。
2.1.3 双层片的制备
根据处方设计要求将两种颗粒按一定比例分层压片。
2.2 释放度方法考察
2.2.1 吸收波长的选择
分别用0.01 mol/L的盐酸溶液配制50 μg/mL的美托洛尔溶液、20 μg/mL的氨氯地平溶液及空白辅料溶液,在200~400 nm范围内进行全波长扫描。结果酒石酸美托洛尔在274 nm处有最大吸收波长,而苯磺酸氨氯地平在237 nm处有较高吸收。空白辅料在两个波长下均无干扰吸收。考察在两个不同的波长下主药的检测,在237 nm波长条件下,基线平稳,两个主药互不影响,因此选择237 nm为两者的检测波长。
2.2.2 释放度测定方法
采用高效液相色谱(HPLC)法测定。色谱条件具体为流动相:0.02 mmol/L 磷酸二氢钾(pH 3.0)-乙腈=65∶35,十八烷基硅烷键合硅胶柱(25 cm),流速:1 mL/min,检测波长:237 nm。配制适宜浓度的样品和对照品,进样20 μL,记录色谱图及主峰峰面积。用外标法计算两个主药释放度。
2.2.3 专属性
按处方量称取本品中除主药外的其他原辅料置100 mL量瓶中,加甲醇溶解,过滤,在237 nm下进样。称取相当于含美托洛尔50 mg、氨氯地平5 mg的片粉于50 mL的容量瓶中,加甲醇稀释,超声溶解,移取1 mL至10 mL容量瓶中,加甲醇定容,过滤,分别进样。结果表明空白辅料不干扰主药的测定。酒石酸美托洛尔的理论塔板数为2902,苯磺酸氨氯地平的理论塔板数为2392,两者的分离度为2.93。
2.2.4 线性关系
2.2.4.1 美托洛尔和氨氯地平对照品溶液的制备 用0.01 mol/L盐酸分别配制浓度为120 μg/mL和15 μg/mL的美托洛尔和氨氯地平对照品储备液。
2.2.4.2 美托洛尔标准溶液的制备 分别精密吸取1、2、4、6、8 mL美托洛尔对照品储备液于10 mL容量瓶中,加0.01 mol/L盐酸溶液定容至刻度,摇匀,得浓度为 12、24、48、72、96 μg/mL的美托洛尔标准溶液。
2.2.4.3 氨氯地平标准溶液的制备 分别精密吸取1、2、4、6、8 mL苯磺酸氨氯地平对照品储备液于10 mL容量瓶中,0.01 mol/L盐酸溶液定容至刻度,摇匀,得浓度为1.5、3.0、6.0、9.0、12.0 μg/mL 的氨氯地平标准溶液。
分别将上述系列标准溶液、对照品储备液进样,记录峰面积,以峰面积对浓度做直线回归[3],得酒石酸美托洛尔和苯磺酸氨氯地平在0.01 mol/L盐酸溶液中的回归方程分别为A=19562C+6951(r=0.9999)和 A=2932C+678(r=0.9998)。结果表明酒石酸美托洛尔在12~120 μg/mL浓度范围内线性关系良好,苯磺酸氨氯地平在1.5~15.0 μg/mL浓度范围内线性关系良好。
2.2.5 精密度试验
称取复方美托洛尔-氨氯地平缓释双层片粉,加0.01 mol/L盐酸溶液溶解稀释定容,配成约含美托洛尔100 μg/mL、氨氯地平10 μg/mL的供试品溶液。重复进样6次,分别测定两个主药峰面积,计算RSD。美托洛尔的RSD为0.68%、氨氯地平的RSD为0.72%,结果表明两者精密度良好。
2.2.6 稳定性试验
称取复方美托洛尔-氨氯地平缓释双层片粉适量,加0.01 mol/L的盐酸溶解并过滤。配成约含美托洛尔100 μg/mL、氨氯地平 10 μg/mL 的供试品溶液。 分别于 0、3、6、9、12 h 进样,测定峰面积,得酒石酸美托洛尔的RSD为0.92%,苯磺酸氨氯地平的RSD为1.3%。结果表明,酒石酸美托洛尔及苯磺酸氨氯地平在0.01 mol/L的盐酸中12 h均稳定。
2.2.7 回收率试验
2.2.7.1 酒石酸美托洛尔回收率试验 用0.01 mol/L盐酸溶液分别配制含标示量美托洛尔80%、100%、120%的9个样品,进样,计算回收率。酒石酸美托洛尔的回收率平均值99.92%,RSD<2%,回收率符合要求。
2.2.7.2 氨氯地平回收率试验 用0.01 mol/L的盐酸溶液配制含标示量氨氯地平80%、100%、120%的9个样品,进样,计算回收率。氨氯地平的回收率平均值100.23%,RSD<2%,回收率符合要求。
2.2.8 滤膜干扰试验
专属性项下样品溶液,分别过滤 5、10、15、20、25、30 mL续滤液20 μL分别进样检查。试验结果表明,样品经过滤膜过滤后,不干扰溶出度的测定结果。
2.2.9 双层片释放度的测定
双层片释放度的测定采用《中国药典》2010年版二部附录X D第一法。按照《中国药典》2010年版二部附录XIX D缓释、控释和迟释制剂指导原则,转速75 r/min,温度37.5℃,溶出介质0.01 mol/L的盐酸500 mL。定时取样5 mL,滤过,同时补加相应的溶出介质5 mL;取续滤液20 μL注入液相色谱仪,按外标法分别计算两个主药的累积释放百分率,结果见图 1、2。
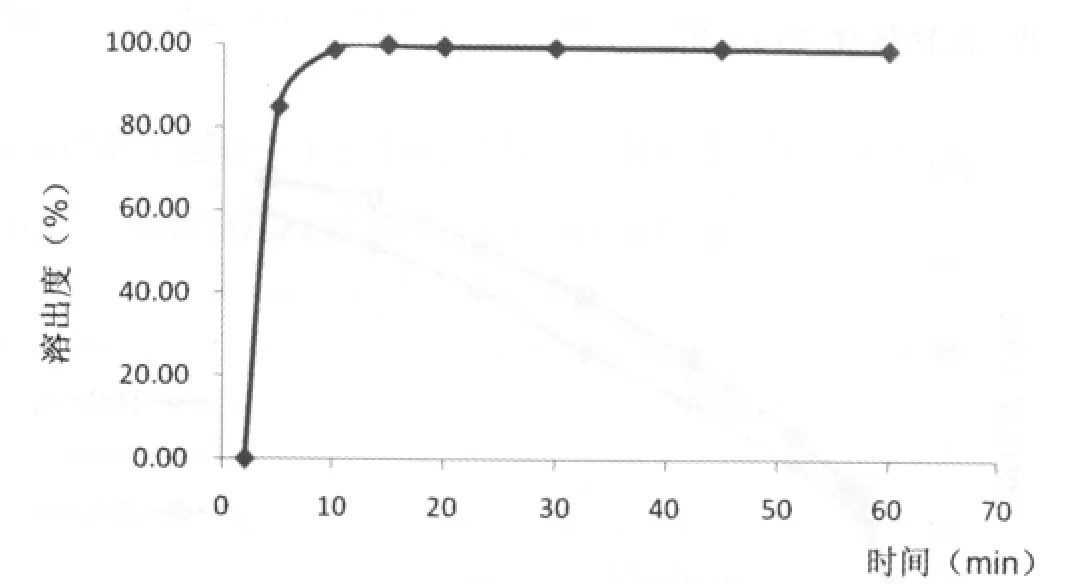
图1 苯磺酸氨氯地平溶出度曲线
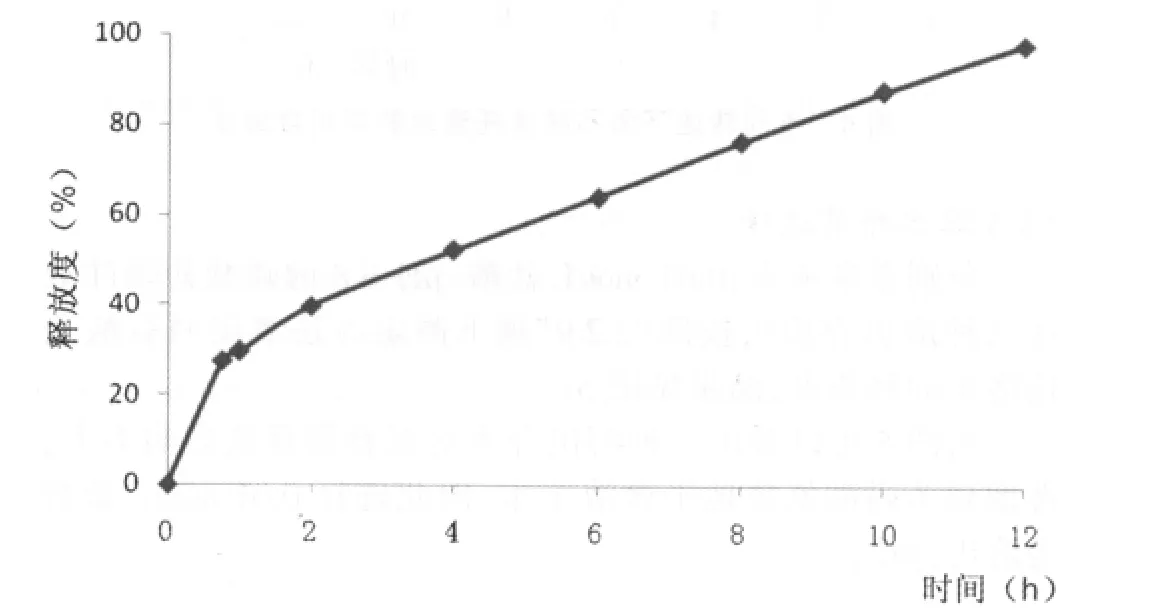
图2 酒石酸美托洛尔累积释放度曲线
2.3 释放度方法的研究
目前国内尚无此复方制剂上市,考虑到含有两个主药,为减少误差,首先参考了FDA、日本厚生省等对苯磺酸氨氯地平的溶出方法规定,确定速释层溶出度的考察方法:桨法,75 r/min,溶出介质为0.01 mol/L的盐酸。下面从这三个方面考察酒石酸美托洛尔的释放,判断是否可以用同一个方法测定。
2.3.1 溶出方法的选择
分别使用桨法、篮法测定酒石酸美托洛尔的释放度[4],结果见图3。由图3可知,溶出方法对释放无显著影响,为了便于观察缓释层的溶蚀情况,选择桨法。
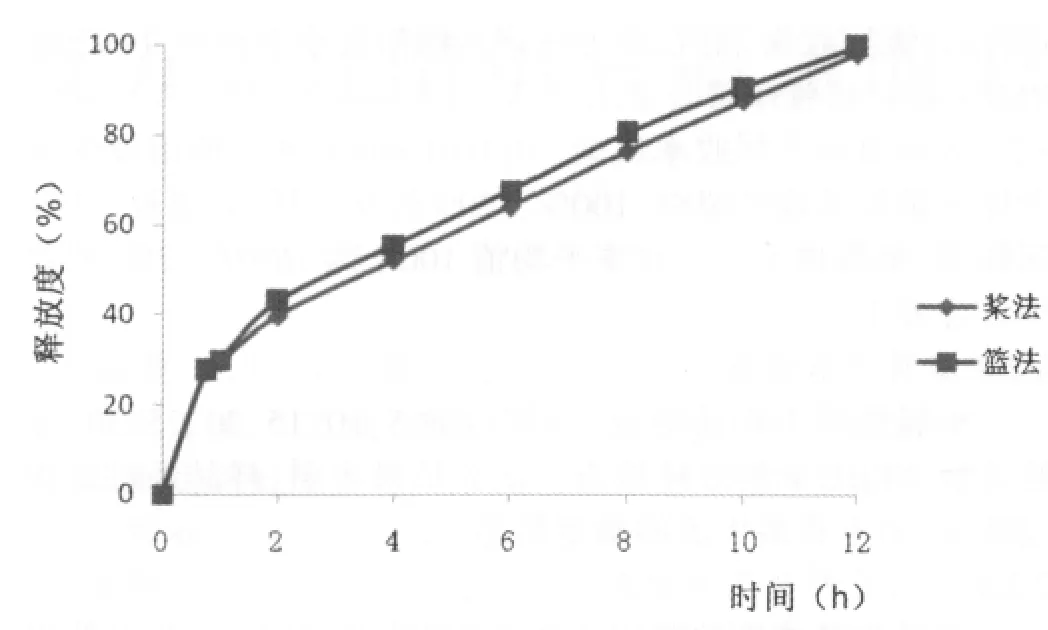
图3 不同溶出方法下酒石酸美托洛尔释放度曲线
2.3.2 转速选择
分别在100、75、50 r/min条件下测定双层片缓释层的释放度结果见图4。
由图4可以看出50 r/min条件下释放较慢,75 r/min及100 r/min条件对释放度的影响不大,考虑到速释层释放条件,选择转速75 r/min。
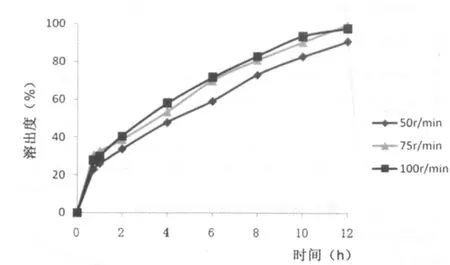
图4 不同转速下酒石酸美托洛尔的溶出度曲线
2.3.3 溶出介质选择
分别考察纯水、0.01 mol/L盐酸、pH 6.8的磷酸盐缓冲液这三种溶出介质[5],按照“2.2.9”项下测定方法测定酒石酸美托洛尔的释放度,结果见图5。
由图5可以看出三种溶出介质对缓释层释放影响不大,考虑到苯磺酸氨氯地平微溶于水,因此选择0.01 mol/L盐酸为溶出介质。
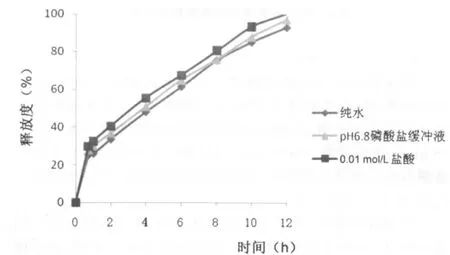
图5 不同释放介质中酒石酸美托洛尔的释放度曲线
综合以上结论,两个主药可选择同一方法测定溶出度。
2.4 缓释层释药动力学研究
目前评价缓、控释制剂药物释放机制的模型主要有如下几种:零级释药方程[6]:Q=Kt;一级释药方程[7]:ln(100-Q)=-kt;Higuchi平面扩散模式方程[8]:Q=Kt1/2;Ritger-Peppas 方程[9]:lnQ=nlnt+k。式中Q为累积释药百分率,K为释放速率常数,t为时间,n为扩散指数。考察45 min~12 h之间酒石酸美托洛尔的释放度。

表1 复方双层片中缓释部分释药曲线的模型拟合(n=6)
拟合时以相关系数(r)越大,表明拟合效果越好。由此判断酒石酸美托洛尔缓释层体外释药机制接近零级动力学方程。
3 讨论
对于复方缓释片的释放度测定方法,国内尚未见报道,通过参考相关资料首先确定了测定氨氯地平速释层溶出度的方法,接着考察了不同条件下酒石酸美托洛尔的释放度,并建立了测定复方双层片的方法。酒石酸美托洛尔为水易溶药物,在水中溶解度 >700 mg/mL,故在选择释放介质时,如释放介质能满足苯磺酸氨氯地平漏槽条件的话,酒石酸美托洛尔也满足漏槽条件。
自制片中加入了一种亲水凝胶骨架材料,是由旭化成化学公司和三和淀粉公司共同开发的一种新型预胶化淀粉,商品名为SWELSTARTM MX-1,通过加入亲水性物质聚乙二醇(PEG 6000)使其具有可控制的凝胶强度,推进水分的渗透作用,增加了MX-1早期的吸水性,减少其溶蚀,从而控制药物以零级速率释放。
[1]谢虹虹,饶晓玲,鲁联,等.酒石酸美托洛尔骨架缓释片的制备及释放度测定[J].中国医院药学杂志,2008,28(8):626-629.
[2]石卫兵,赖宜生,张奕华.苯磺酸氨氯地平的合成研究[J].中国药物化学杂志,2006,16(3):161-164.
[3]江东波,马晓鹂,黄冬,等.盐酸氯米帕明缓释片的制备及其体外释放度考察[J].中国药房,2009,20(13):1005-1007.
[4]石雷,范长春.辛伐他汀凝胶骨架缓释片制备工艺与体外释放考察[J].中国医药导报,2011,8(26):76-78.
[5]钟玲,吴伟,臧志和.芦丁渗透泵片的体外释放度方法研究[J].时珍国医国药,2010,21(1):131-133.
[6]Korsmeyer RW,Gurny R,Doelker E.Mechanism of solute release from porous hydrophilic polymers[J].Int J Pharm,1983,15:25-35.
[7]Schwartz JB,Simonelli AP,Higuchi WI.Drug release from wax matrics.I.analysis of data with first order kinetics and with diffusion-controlled model[J].J Pharm Sci,1968,57(2):274-277.
[8]Higuchi T.Mechanism of sustained-action medication theoretical analysis of rate of release of,solid drugs dipersed in solid matrices [J].J Pharm Sci,1963,52(12):l145-1149.
[9]Peppas N.Analysis of Fickian and non-Fickian drugs drug release from polymers[J].Pharm Acta Helv,1985,60(4):110-111.

