siRNA沉默Musashi-1基因表达对人HCT116结肠癌细胞生物学行为的影响
章福彬,朱 斌,唐 郡,刘 卫 (解放军第105医院消化内科,安徽合肥 230000)
Musashi是一种RNA结合蛋白,最早发现于果蝇,在维持干细胞状态、分化和肿瘤发生方面起着重要作用。本实验通过RNAi技术调控人HCT116结肠癌细胞Musashi-1基因表达水平,并检测干扰后细胞生物学行为的改变,探讨Musashi-1基因对结肠癌细胞增殖及细胞周期的影响,为探讨结肠癌中Musashi基因的功能提供新的手段。
1 材料与方法
1.1 细胞株与主要试剂
人结肠癌细胞株HCT116由本实验室保存,干扰质粒载体pGenSil-1购于武汉晶赛公司;Musashi-1 siRNA序列由上海吉凯公司合成,LipofectamineTM 2000 Reagent转染试剂和AnnexinV凋亡试剂购于Invitrogen公司,总RNA提取试剂(Trizol)和real time PCR试剂盒购于TaKaRa公司。
1.2 Musashi-1siRNA靶序列的设计与合成
根据GenBank的Musashi-1 mRNA(NM_002442)全长序列,按siRNA原则设计,经BLAST数据库分析未发现同源序列。设计基因靶点分别于Musashi-1基因的第205、741位点,靶序CCGGAGTTA。将化学合成的正义链和反义链退火,与经HindⅢ和BamHⅠ酶切后线性化pGeneSil-1载体连接,经筛选、酶切鉴定后测序。
1.3 细胞培养和转染
人结肠癌细胞株HCT116接种于含10%新生小牛血清、100 U/mL青霉素和100μg/mL链霉素的培养基中,细胞转染时,取对数生长期的HCT116细胞,以合适的细胞数接种于6孔培养板,用含10%血清不含抗生素的DMEM培养液、37℃、5%CO2温育过夜,次日转染。转染操作按LipofectamineTM 2000 Reagent说明书进行,转染24 h后将转染的细胞按1∶10稀释,将其种植于另一培养板,再经过24 h后,向培养液中加入400 μg/mL的G418进行抗性筛选,2周后荧光显微镜下可见细胞克隆发出荧光,对阳性克隆进行有限稀释,扩大培养后获得稳定表达的细胞株。
1.4 Real time PCR 检测
按Trizol法提取总RNA,据反转录试剂盒操作方法获得单链cDNA,取cDNA作为模板进行Real-time PCR检测。采用嵌合荧光检测法,采用50μl反应体系(2×SYBR Premix Ex TaqTM 25 μl,上游引物 1 μl,下游引物 1 μl,50 × ROX Reference Dye 1 μl,cDNA,溶液4 μl,DEPCH2O 18 μl)95 ℃预变性180 s;95℃ 20 s,60℃ 60 s,40个循环。用 pGEM-Musashi质粒和pGEM-GAPDH质粒,系列稀释同时扩增,制作标准曲线。记录各管扩增CT值,换算出基因拷贝数。以Musashi基因拷贝数与GAPDH基因拷贝数的比值作为其相对表达水平,Musashi引物序列为:正义5'-GTTTCGGCTTCGTCACTTTC-3',反义5'-GAGTCACCATCTTGGGCTGT-3';GAPDH引物序列为:正义5'-TGCACCACCAACTGCTTAGC-3',反义 5'-GGCATGGACTGTGGTCATGAG-3'。
1.5 MTT法检测细胞生长曲线
将转染后的干扰组、空载体组细胞制备成3×103个细胞悬液,接种于96孔培养板中,每孔200μl,于37℃、5%CO2的培养箱中培养。每天取一板进行MTT反应,每孔分别加入5 mg/mLMTT 20μl,37℃孵育4 h后弃去上清,每孔均加入二甲基亚砜100μl,轻微振荡使紫蓝色沉淀溶解。用酶标仪测定490 nm波长处的吸光度(D),计算细胞的抑制率。细胞生长抑制率(%)=[(对照组A490 nm-实验组A490 nm)/对照组A490 nm]×100%。
1.6 流式细胞仪检测细胞周期
转染后的干扰组、空载体组细胞接种于6孔板中,收集转染后扩增的细胞和空载体组细胞各1×106个,70%冰乙醇固定,碘化丙啶(PI)染色,测定细胞周期情况。
1.7 统计学分析
2 结果
2.1 Musashi siRNA真核表达质粒的鉴定及观察
测序结果证实插入寡核苷酸序列与设计的靶点序列完全吻合,说明重组载体构建成功。质粒中含有编码GFP的基因,故转染细胞在荧光显微镜下可激发出绿色荧光(图1)。

图1 G418抗性筛选后阳性克隆荧光倒置显微镜检测结果
2.2 Musashi siRNA对HCT116细胞Musashi mRNA表达的影响
实时荧光定量PCR检测结果显示:siRNA-1组及siRNA-2组的mRNA 相对表达量分别为(0.37±0.040)和(0.33±0.025),与空载体对照组(0.87 ±0.034)比较,siRNA1 ~siRNA2均可下调Musashi mRNA的表达,siRNA-1~siRNA-2间差异无统计学意义(图2)。

图2 Real time PCR检测结果
2.3 Musashi siRNA对HCT116细胞增殖的影响
Musashi siRNA 转染 HCT116 细胞后 1、2、3、4 d与对照组比较,siRNA-1、siRNA-2组细胞增殖减慢。细胞转染2 d后的抑制率较1 d显著增加,但4 d的抑制率较3 d增加不明显,转染4 d后抑制率较前下降。空载体对照组细胞的抑制率无明显变化(图3)。

图3 Bim-1 RNAi对HCT116细胞增殖的影响
2.4 Musashi siRNA对HCT116细胞周期的影响
与空载体组细胞比较,干扰组细胞出现G0/G1期阻滞,在S期和G2/M期细胞数下降,以上结果提示Musashi的RNA干扰可以使HCT116细胞停滞于G0/G1期,明显抑制HCT116细胞的增殖(P<0.05),见表1。
表1 Musashi siRNA 对HCT116细胞周期分布影响±s,%)
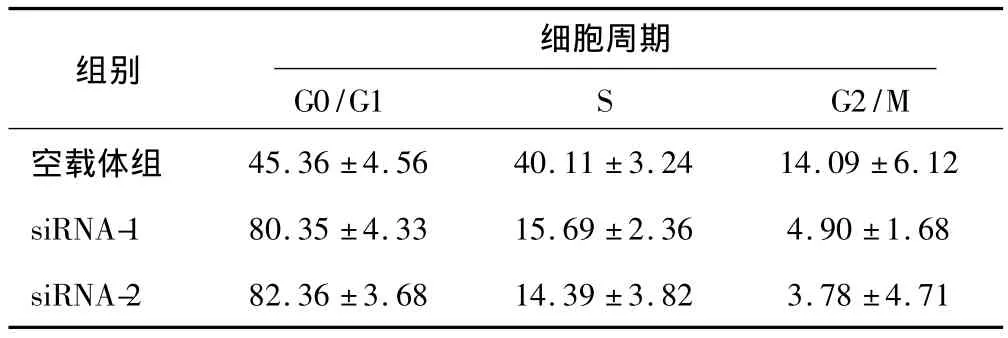
表1 Musashi siRNA 对HCT116细胞周期分布影响±s,%)
空载体组45.36 ±4.5640.11 ±3.2414.09 ±6.12 siRNA-180.35 ±4.3315.69 ±2.364.90 ±1.68 siRNA-282.36 ±3.6814.39 ±3.823.78 ±4.71
3 讨论
干细胞是一类具有自我更新和增殖分化潜能的原始细胞,近年来提出在肿瘤的瘤体内也存在与干细胞具有相似生物学活性的一类细胞群体,科学家命名这种存在于肿瘤细胞群体中的特殊细胞为肿瘤干细胞(cancer stem cell)[1],肿瘤干细胞在肿瘤的发生发展中起着关键性作用,它位于肠黏膜隐窝基底部[2],与肠道肿瘤的形成密切相关,有研究表明结肠癌的形成是通过持续性基因突变产生的,这种基因突变可能发生在肠道干细胞水平。
结肠癌是我国常见恶性肿瘤,其预后不良,早期诊断可以提高患者生存率。作为肠道干细胞的特异性分子标记之一的Musashi-1越来越受到人们的重视。人Musashi-1由362个氨基酸组成,N端含有2个保守的RRM(RNA Recognize Domain)结构域。Musashi家族分子能够在多个层面上决定细胞命运,包括维持干细胞的状态、细胞的分化和肿瘤的发生等[3]。苏沐等[4]认为正常肠道干细胞标记物Musashi-1有可能成为结直肠癌干细胞样肿瘤细胞特异性标记,龚剑峰等[5]则对Musashi-1启动子进行了克隆及功能分析,为应用该启动子进行肠道干细胞的分离和纯化提供条件。赵晔等[6]采用免疫组织化学对正常的胃黏膜、小肠黏膜及降结肠黏膜中musashi-1、端粒酶逆转录酶(TERT)、Oct-4和Nestin的表达情况进行研究,认为Musashi-1是胃肠道相对特异的干细胞标记物。本研究则是构建了Musashi-1的两个siRNA真核表达载体(siRNA-1、siRNA-2),转染人结肠癌细胞株HCT116细胞,运用实时荧光定量测定Musashi-1 mRNA的表达,结果发现,siRNA-1、siRNA-2均能抑制Musashi-1的表达,同时应用MTT和流式细胞技术分析细胞的生长曲线和周期分布,发现Musashi-1siRNA能够使细胞增殖速度减慢,并使细胞停滞于G0/G1期。
总之,本研究通过使用靶向Musashi-1的siRNA,有效抑制了Musashi-1基因在结肠癌细胞中的表达,还能在体外特异性抑制结肠癌细胞的分裂增殖,为探讨结肠癌中Musashi基因的功能提供新的手段。
[1] Reya T,Morrison SI,Clarke MF,et al .Stem cell,cancer and cancer stem cell[J].Nature,2001,414(6859):105 - 111.
[2] Potten CS,Loeffler M.Stem cells:attributes,cycles,spirals,pitfalls and uncertainties lessons for and from the crypt[J].Development 1990,110(4):1001-1020
[3] 杨爱萍,姜 藻,陈 静.Musashi-1、Ki-67的表达与食管鳞癌的临床意义[J].中国现代医生,2009,47(32):58 -60.
[4] 苏 沐,姜 藻.5-FU对SW480细胞Musashi-1基因表达的影响[J].东南大学学报(医学版),2007,26(3):198 -201.
[5] 龚剑锋,朱维铭,高 翔,等.肠道干细胞特异性表达基因Musashi-1启动子的克隆及功能分析[J].肠外与肠内营养,2006,13(5):257-264.
[6] 赵 晔,李建生,马长路.胃肠道干细胞标记物的筛选[J].胃肠病学和肝病学杂志,2006,15(2):199 -202.

