吸附树脂负载铁酞菁光催化降解4-硝基苯酚
孙 越 韩 玲 王 彧 王志良
(1东南大学土木工程学院,南京210096)
(2江苏省环境科学研究院,南京210036)
近年来,以生成羟基自由基为标志的高级氧化技术引起了环境工作者的广泛重视[1].其中,设备简单、操作方便的Fenton氧化法(Fe2+/H2O2)及氧化能力更强、反应速率更快的光助Fenton氧化法已在有机废水处理中获得了广泛应用[2-6].但均相Fenton反应结束后,催化剂难以分离回收,易造成二次污染.
酞菁分子结构中含有4个吡啶分子大环π电子体系,可有效吸收可见光,是一种日益受到重视的高效光敏材料[7].若酞菁与铁离子络合形成铁酞菁,可使铁离子牢固地固载在酞菁环上,并且降低了铁离子的前线分子轨道能级,其催化性能大大高于自由铁离子,可作为理想的光助Fenton反应催化剂[8].但铁酞菁在水溶液中易于形成聚合体而降低甚至丧失催化活性,将其固定在载体上制得多相催化剂是一种有效的解决途径[9].同时,多相催化剂易于分离,可实现循环利用.
本文将铁酞菁通过共价键负载在吸附树脂上,制得多相光催化剂,在可见光照射下,催化H2O2氧化典型水环境污染物4-硝基苯酚,取得了良好的效果.
1 实验
1.1 实验仪器及材料
实验仪器包括:85-2型控温磁力搅拌器(金坛市医疗仪器厂);UV-vis分光光度计(北京普析通用仪器有限责任公司);TOC-V CPH总有机碳分析仪(日本岛津公司);TAS-990F原子吸收光谱仪(北京普析通用仪器有限责任公司).
实验材料包括:氯甲基化聚苯乙烯树脂(杭州争光树脂有限公司);铁酞菁(自制);4-硝基苯酚(AR,天津市化学试剂研究所);过氧化氢(AR,国药集团化学试剂有限公司).
1.2 催化剂的制备
利用邻苯二甲酸酐/尿素法合成铁酞菁[10].取20 g氯甲基化聚苯乙烯树脂加入到100 mL硝基苯中,依次加入2.0 g无水氯化锌和1.0 g铁酞菁,加热反应10 h,得到多相催化剂,采用浓硫酸、蒸馏水及无水乙醇依次洗涤,干燥后备用.
1.3 实验方法与步骤
配制50 mg/L 4-硝基苯酚溶液,取200 mL放入反应容器中,根据实验要求,调节pH值至一定值,磁力搅拌器搅拌,水银节点温度计和电子继电器联合调节磁力搅拌器加热,控制反应温度.待溶液温度稳定后,开启卤灯光源,加入一定量的催化剂和H2O2,定时取样,测定溶液浓度.
1.4 分析方法
对所取样品稀释一定的倍数,用UV-vis分光光度计测定410 nm处的吸光度.根据下式计算去除率:
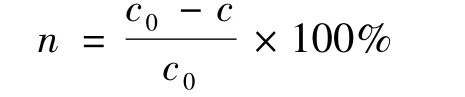
式中,n为4-硝基苯酚去除率;c0和c分别为原溶液和一定时间所取样品的浓度.样品的总有机碳直接由总有机碳分析仪测定得出.
2 结果与讨论
2.1 光照对反应的影响
催化剂用量为 2.0 g/L,H2O2用量为 50 mmol/L,溶液pH未作调整,温度为40℃时,4-硝基苯酚去除效果如图1所示.结果表明,催化剂能够有效地催化降解水溶液中的4-硝基苯酚.相对于无光照反应体系,在可见光照射下的去除效果更好.光源功率为 25,50,100 W 时,反应 510 min,去除率分别高出无光照体系9.5%,20.7%,25.4%.表明催化剂可利用可见光,具有光敏性.采用拟一级反应动力学方程ln(c/c0)=kt拟合图1中的4组数据,所得拟合曲线的相关系数 R2均大于0.99,表明4-硝基苯酚的去除过程符合拟一级反应动力学规律.计算得到无光源照射反应速率常数k为2.5 ×10-3min-1,25,50 和 100 W 光源照射下的反应速率常数分别为 3.2 ×10-3,4.7 ×10-3和5.4 ×10-3min-1,表明可见光照射可加快反应进程.在50和100 W光源照射下,4-硝基苯酚的去除率均可达到90%以上,综合考虑节约能源和反应效果,选择50 W为最佳光源功率.

图1 光照对4-硝基苯酚去除效果的影响
2.2 催化剂用量对反应的影响
光源功率为50 W,H2O2用量为50 mmol/L,溶液pH未作调整,温度为40℃时,不同催化剂用量对4-硝基苯酚去除效果的影响如图2所示.结果表明:催化剂投加量为2.0 g/L时的处理效果明显优于1.0 g/L投加量;而当催化剂投加量增加至3.0 g/L时,效果与2.0 g/L时相差不多.这是因为过量的铁离子可与羟基自由基发生反应Fe2++·OH→Fe3++OH-,对羟基自由基具有一定的清除作用[11].综合考虑处理效果和处理成本,选择催化剂的最佳用量为2.0 g/L.

图2 催化剂用量对4-硝基苯酚去除率的影响
2.3 pH值对反应的影响
用H2SO4和NaOH调节反应体系的初始pH值,光源功率为50 W,催化剂用量为2.0 g/L,H2O2用量为50 mmol/L,在40℃下进行4-硝基苯酚降解实验,结果如图3所示.pH值为3.0时处理效果最好,反应450 min去除率达到93.8%;随着pH值的升高,4-硝基苯酚去除率有所下降,但是下降幅度非常小,在pH值为6.0时,反应570 min仍然能达到92.1%的去除率.相比于均相Fenton催化剂,负载型的铁酞菁催化剂受pH值影响较小,在pH值为3.0~6.0范围内都具有良好的催化性能.实验所采用的4-硝基苯酚溶液的pH值为5.7,从操作方便和节约成本的角度考虑,采用溶液的原始pH值进行后续实验,不再进行调节.
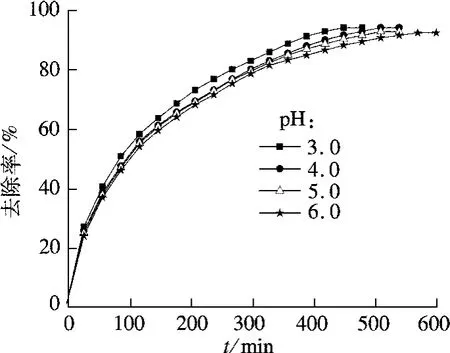
图3 pH值对4-硝基苯酚去除率的影响
2.4 温度对反应的影响
光源功率为50 W,催化剂用量为2.0 g/L,H2O2用量为50 mmol/L,pH值为5.7时,考察了30,40和50℃下4-硝基苯酚的去除率,如图4所示.结果表明,较高的温度有助于反应的进行.因为温度升高,羟基自由基的产生速度加快、活性增大,有利于4-硝基苯酚的降解.在40和50℃下,反应480 min,4-硝基苯酚的去除率均可达到90%以上.综合考虑处理成本和反应效果,选择40℃为最佳反应温度.

图4 温度对4-硝基苯酚去除率的影响
2.5 H2O2用量对反应的影响
光源功率为50 W,催化剂用量为2.0 g/L,pH值为5.7,温度为40℃时,不同H2O2用量对4-硝基苯酚去除效果的影响如图5所示.由图5可知,随着H2O2加入量的增加,4-硝基苯酚的降解率呈现先增大后减小的变化趋势,当H2O2的加入量为50 mmol/L时,降解效果最好.这是因为在较低的H2O2浓度范围内,反应体系中产生的羟基自由基随H2O2浓度的增加而增加,提高了4-硝基苯酚的降解率;而当H2O2浓度超过一定限值后,过量的H2O2可与羟基自由基发生反应,降低了强氧化剂羟基自由基的利用效率,从而导致了在过高H2O2浓度下4-硝基苯酚降解效果的下降.因此选择50 mmol/L为H2O2的最佳投加量.

图5 H2O2用量对4-硝基苯酚去除率的影响
2.6 矿化度分析及催化剂稳定性
采用总有机碳测定仪研究在优化条件(即光源功率50 W,催化剂用量2.0 g/L,H2O2用量50 mmol/L,pH值为5.7,温度为40℃)下4-硝基苯酚降解反应的矿化度,结果见图6.TOC去除率随4-硝基苯酚的去除而逐步提高,反应540 min后,4-硝基苯酚的去除率为92.2%,TOC去除率达到82.5%.可见,催化剂对4-硝基苯酚具有良好的去除效果,且能达到较高的矿化度,反应比较彻底.
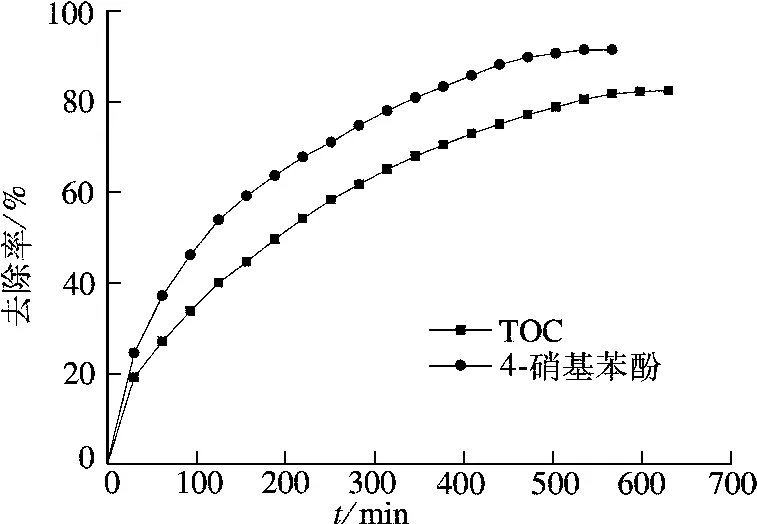
图6 4-硝基苯酚溶液的TOC去除率
为考察催化剂的稳定性,采用原子吸收分光光度计测试反应后溶液,未检测出铁离子,说明催化剂中铁离子的固定是牢固的,催化剂具有很好的稳定性.在4-硝基苯酚降解实验完成后,分离出催化剂,经水洗、干燥后,进行下批次催化降解实验.6批次循环实验结果表明,催化剂活性没有明显降低,对4-硝基苯酚均可达到90%以上的去除率,可重复使用.
3 结语
将铁酞菁通过共价键负载在吸附树脂上,制得多相催化剂.该催化剂具有良好的可见光催化活性,能有效地催化H2O2降解4-硝基苯酚.在4-硝基苯酚初始浓度为50 mg/L,可见光源功率为50 W,催化剂投加量为 2.0 g/L,H2O2用量为 50 mmol/L,pH值为5.7,温度为40℃条件下,4-硝基苯酚去除率达到92.2%,矿化度达到82.5%.另外,催化剂具有很好的稳定性,可重复使用.
References)
[1]Hayat K,Gondal M A,Khaled M M,et al.Laser induced photocatalytic degradation of hazardous dye(safranin-O)using self synthesized nanocrystalline WO3[J].Journal of Hazardous Materials,2011,186(2/3):1226-1233.
[2]Chang Mengwen,Chen Taishang,Chen Jiaming.Initial degradation rate of p-nitrophenol in aqueous solution by Fenton reaction[J].Industrial and Engineering Chemistry Research,2008,47(22):8533-8541.
[3]Li Chiwang,Chen Yiming,Chiou Yicheng,et al.Dye wastewater treated by Fenton process with ferrous ions electrolytically generated from iron-containing sludge[J].Journal of Hazardous Materials,2007,144(1/2):570-576.
[4]Christopher K D,Steven E M,David W.pH effects on iron-catalyzed oxidation using Fenton’s reagent[J].Environmental Science and Technology,2008,42(5):8522-8527.
[5]Ahmed B,Elalaoui L,Abdel-Wahab A,et al.Photo-Fenton treatment of actual agro-industrial wastewaters[J].Industrial and Engineering Chemistry Research,2011,50(11):6673-6680.
[6]Andre W V,Bettina M V.Photo-Fenton reaction at near neutral pH[J].Environmental Science and Technology,2009,43(18):6927-6933.
[7]Giuseppe M,Elisa G L,Leonardo P,et al.Photocatalytic degradation of 4-nitrophenol in aqueous suspension by using polycrystalline TiO2impregnated with lanthanide double-decker phthalocyanine complexes [J].Journal of Physical Chemistry C,2007,111(17):6581-6588.
[8]Tao Xia,Ma Wanhong,Zhang Tianyong,et al.A novel approach for the oxidative degradation of organic pollutants in aqueous solutions mediated by iron tetrasulfophthalocyanine under visible light radiation [J].Chemistry—A European Journal, 2002,8(6):1321-1326.
[9]Fang Ying,Chen Dajun.A novel catalyst of Fe-octacarboxylic acid phthalocyanine supported by attapulgite for degradation of Rhodamine B [J].Materials Research Bulletin,2010,45(6):1728-1731.
[10]Ali H,Langlois R,Wagner J R,et al.Biological activities of phthalocyanines-X.syntheses and analyses of sulfonated phthalocyanines[J].Photochemistry and Photobiology,1988,47(5):713-717.
[11]Luo W,Zhu L H,Wang N.Efficient removal of organic pollutants with magnetic nanoscaled BiFeO3as a reusable heterogeneous Fenton-like catalyst[J].Environmental Science and Technology,2010,44(5):1786-1791.

