基因组改组选育抗镉菌及生物修复镉污染土壤
姜春晓,王 婷,张彦峰,孙红文
基因组改组选育抗镉菌及生物修复镉污染土壤
姜春晓1,2,王 婷1,张彦峰1,孙红文1
(1. 南开大学环境科学与工程学院教育部环境污染过程与基准重点实验室,天津 300071;2. 广州市环境保护工程设计院有限公司,广州 510115)
为了获得对土壤重金属污染物具有高效固定能力的微生物,将基因组改组技术用于构造对镉具有高效耐受性和富集性微生物.以前期获得的6株抗镉诱变菌为出发菌株,经3轮基因组改组获取2株高抗镉融合菌——F178和F185,对镉最小受抑制浓度为4.0,mmol/L和4.2,mmol/L,与出发菌株(0.08~0.25,mmol/L)相比显著提高.盆栽实验考察2株菌对(10±0.4),mg/kg镉污染土壤的修复效果.同时添加诺沃肥,F178和F185分别显著降低萝卜体内的镉含量至0.3,mg/kg和0.4,mg/kg,而对照组萝卜体内镉的含量达2.24,mg/kg;生物量得到显著提高,是对照的近2倍.添加F178和F185进行复合处理,镉含量可进一步降至0.17,mg/kg,达到FAO/WHO食品安全质量限量标准(0.2,mg/kg).
重金属;土壤;原生质体融合;生物修复
菌种选育技术一直在应用微生物学领域受到高度重视,其发展经历了自然选育、诱变育种、代谢控制育种、杂交育种和分子育种等几个重要阶段[1].采用传统的诱变育种,以单一出发菌株为亲本,经连续多代诱变,往往导致后代菌株间遗传多样性降低.原生质体融合是新兴的育种技术,但是一般要求亲代具有遗传标记,这将导致融合菌代“先天不足”.美国加州Maxgen公司Cardayré等提出了基因组改组(genome shuffling)技术,大大提高了获得优良性状菌株的几率.基因组改组技术已在工业微生物育种中得到广泛应用[2],能优化大多数工业产物的代谢途径和表型,可直接用于食品工业[3]、医药卫生[4]等众多生产领域.
微生物固定是土壤中低中度重金属污染修复的一个重要技术,筛选和培育对重金属具有高耐受性和富集性的微生物菌株一直是该研究的重点和前沿[5-6].微生物富集固定重金属主要由基因决定,如果能将活性基因集中到一株微生物体内,可大大提高微生物对重金属的耐受性(抗性)及富集固定能力.利用分子生物学技术构建抗重金属微生物,操作繁琐,很难成功.而基因组改组技术,简单易行,可不必将基因分离出来,实现多株抗重金属微生物之间的融合,从而构建高效抗重金属微生物.目前,还没有关于利用基因组重组技术构建抗重金属工程菌的报道.
笔者以利用传统诱变技术获得的6株抗镉诱变菌株为出发菌,利用基因组改组技术对6种菌株进行融合,以期获得比出发菌抗镉性能更高的融合菌株.经过3轮基因组改组技术,筛选出了2株高效抗镉融合菌,并利用盆栽实验考察了2种融合菌对镉污染土壤的生物强化修复效果.
1 材料与方法
1.1 材 料
基因组改组用到的6株诱变菌株,由前期实验通过紫外诱变和亚硝酸盐化学诱变,在梯度浓度镉存在下筛选获得.其中C14是以热带假丝酵母菌(Candida tropicalis)的原生质体经紫外诱变5,min获得的,C44是C.,tropicalis原生质体经过亚硝酸诱变10,min获得的,B42与B41是枯草芽孢杆菌(Bacillus subtilis)分别经过紫外诱变1,min和5,min获得的,B65和B310是B.,subtilis经过亚硝酸诱变10,min和20,min获得的[7].
采用高渗缓冲液(PBS)作为稳定剂,于0.2,mol/L pH 6.0磷酸缓冲液(PB)中加入0.8,mol/L 山梨醇配制而成.
对于酵母菌而言,制备原生质体的前预处理是必不可少的.预处理液包括:含质量分数为0.1%~0.2% β-巯基乙醇的PB溶液,0.06,mol/L,EDTA;100,mmol/L TrisHCl,5,mmol/L EDTA,5,mmol/L DTT(二硫苏糖醇).
用2% 蜗牛酶水解细菌的细胞壁;用2% 蜗牛酶来水解酵母菌的细胞壁.酶溶液均是由PBS缓冲液配制,并用0.45,μm膜过滤除菌[1,8].
40% 的聚乙二醇(PEG4000)由PBS配制.细菌培养基为牛肉膏蛋白胨培养基(LB):蛋白胨10,g/L,氯化钠5,g/L,牛肉膏5,g/L,pH7.2;酵母菌培养基为葡萄糖蛋白胨液体培养基(YEPD):葡萄糖20,g,蛋白胨20,g,酵母膏10,g,蒸馏水1,000,mL,pH 7.0;营养肉汤琼脂培养基(NB):蛋白胨10,g,牛肉膏5,g,NaCl 5,g,葡萄糖5,g,琼脂20,g,蒸馏水1,000,mL,pH 7.5;融合菌再生营养肉汤琼脂(RNB)培养基:蛋白胨10,g,牛肉膏5,g,NaCl 5,g,葡萄糖5,g,琼脂20,g,PBS溶液1,000,mL,pH 7.5[9].
1.2 B. subtilis诱变菌原生质体的制备
将4株B.,subtilis诱变菌分别接种于斜面,37,℃培养24,h,活化2代.转接于LB液体培养基中,37,℃振荡过夜.按1%~2%(体积分数)的接种量转接到新鲜液体培养基,培养至对数生长期中段,3,500,r/min离心10,min,用PBS缓冲液洗涤菌体2次.用新鲜配制的溶菌酶液悬浮,置于37~40,℃条件下缓慢振荡酶解,每隔15,min取样镜检原生质体形成情况,当大多数细胞都转化成原生质体时(60~90,min),离心,终止酶解,PBS缓冲液洗涤2次,重新将原生质体悬浮于PBS缓冲液中,低温保存备用[1,10].
1.3 C. tropicalis诱变菌原生质体的制备
将2株C.,tropicalis诱变菌分别接种于YEPD培养基斜面,28~30,℃培养24,h,活化2代.转接于YEPD液体培养基中(加少量的2-脱氧葡萄糖),28~30,℃,振荡过夜.以1%~2%(体积分数)的接种量转接到新鲜液体培养基中,培养至对数生长期中段.3,500,r/min下离心10,min,用PB缓冲液洗涤菌体2次.加入β-巯基乙醇-PB溶液,28,℃恒温10,min,离心,用PB缓冲液洗涤.上述预处理过程对于酵母菌来说是必不可少的.预处理后的细胞沉淀物加入蜗牛酶溶液悬浮,28~30,℃下低速振荡恒温水解,每隔15,min取样镜检观察.当大部分细胞转化成球形的原生质体时(60~90,min),离心,终止酶解,PBS缓冲液洗涤2次,重新将原生质体悬浮于PBS缓冲液中,低温保存备用[1,11].
1.4 基因组改组
将上述方法获得的6株原生质体各取0.5,mL(约1×106,个/mL)进行均匀混合,进行第1轮基因组改组.
用PBS缓冲液洗涤1次,3,500,r/min离心10,min弃去上清液,原生质体沉淀用少量的PBS缓冲液悬浮,然后加入40%的PEG-PBS溶液,振荡均匀.30,℃静止保温30~60,min,离心,除去PEG,用PBS溶液洗涤2次,原生质体沉淀用PBS溶液悬浮.适当稀释后,采用双层平板法涂布于RNB培养基平板上,于28,℃培养,长出菌落后,转接到NB斜面上保存.利用浓度梯度平板和摇瓶发酵(添加镉浓度为1,mmol/L的Cd(NO3)2)两步筛选方法,挑选高抗镉的融合菌,经过遗传稳定性实验鉴定后,将挑选出的菌株在NB斜面上保存,即为第1轮基因组改组获得的抗镉融合菌[1].
制备上面筛选的5株融合菌菌株原生质体,将镉浓度提高为2 mmol/L和 4,mmol/L Cd(NO3)2,其他步骤同上,进行第2轮和第3轮基因组重组[1].
1.5 融合菌对镉的抗性实验
将3轮获得基因组改组融合菌(菌液浓度均为106,个/mL)分别在含1~5,mmol/L Cd(NO3)2浓度梯度的NB琼脂平板上划线培养7,d后,确定镉对融合菌最小抑制浓度 (minimum inhibition concentration,MIC).
1.6 盆栽实验
利用盆栽实验考察抗镉菌株对镉污染土壤的修复效果.以球形萝卜为对象(种子购自天津市种子管理站),实验土壤采自天津市武清区,实验前使用Cd(NO3)2对土壤染毒(10,mg/kg),混匀后放置2周,测得土壤中镉的含量为(10±0.4),mg/kg.土壤中添加的诺沃肥来源于天津市开发区诺维信(中国)生物技术有限公司,诺沃肥是生产酶制剂的发酵残渣,经过添加石灰、高温灭菌和脱水处理加工制成.采用标准方法测定土壤和诺沃肥的若干理化性质.
设置4个盆栽处理,分别是对照(S)、仅接种融合菌(SB)、仅添加2%诺沃肥(SN)以及同时添加诺沃肥并接种微生物的生物强化处理(SNB).应用于盆栽实验的菌株为来自第3轮基因组改组得到的2株具有稳定遗传性的抗镉融合菌(F178和F185),分别单独添加F178和F185,并将F178和F185按照体积比1∶1混合添加,接种量为3,mg(菌株干重)/g(土).上述处理的土壤在室温下风干,混合均匀.然后栽种萝卜种子,培养60,d,定期补充水分.测定萝卜地下部镉含量并称量萝卜地下部干重.
1.7 重金属含量的测定
采用WX-4000型微波消解仪(上海屹尧微波化学技术有限公司)对干化土壤和蔬菜样品进行消解.消解完全后,采用WFX-210型石墨炉原子吸收分光光度计(北京瑞利分析仪器公司)测定Cd含量.
2 结果与分析
2.1 基因组改组过程中原生质体融合的镜检结果
由镜检结果(见图1)可以发现,有大量的原生质体之间发生了融合现象.由此证明,利用本文采用的实验条件,可以实现不同原生质体的有效融合.

图1 基因组改组过程中微生物的原生质体融合Fig.1 Photograph of protoplast fusion in the process of genome shuffling
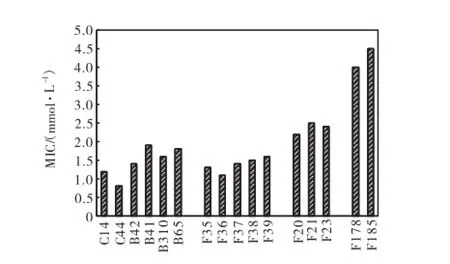
图2 3轮基因组改组获得的融合菌对镉的最小耐受浓度Fig.2 Minimum inhibition concentration to cadmium of fused strains after three rounds of genome shuffling
2.2 基因组改组获得的融合菌对镉的抗性
图2为3轮基因组改组筛选到的融合菌对镉的抗性.第1轮基因组改组获得5株融合菌,分别是F35~F39,镉对这5株融合菌的MIC与出发菌的6株菌(MIC:0.08~0.25,mmol/L)相比,没有显著差异(P>0.05).第2轮基因组改组共筛选到3株融合菌,分别是F20、F31和F23,镉对这3株融合菌的MIC与出发菌株相比,显著提高,对镉的抗性浓度范围为2.2~2.5,mmol/L.第3轮基因组改组获得2株融合菌F178和 F185,其MIC分别达到4,mmol/L和4.2,mmol/L,说明第3轮基因组改组能进一步提高融合菌对镉的抗性.将第2轮和第3轮获得的5株抗镉融合菌株分别在含镉2,mmol/L和4,mmol/L的琼脂平板上划线(见图3),由图3结果可知,在2,mmol/L的含镉平板上,5株菌株生长状况良好;而在4,mmol/L的含镉平板上,只有第3轮筛选到的F178和F185菌株可以生长.实验结果证明,基因组改组技术可以进一步提高诱变菌株的抗镉性能.经过多代培养,2株融合菌对镉的抗性稳定,均保持在4,mmol/L左右.
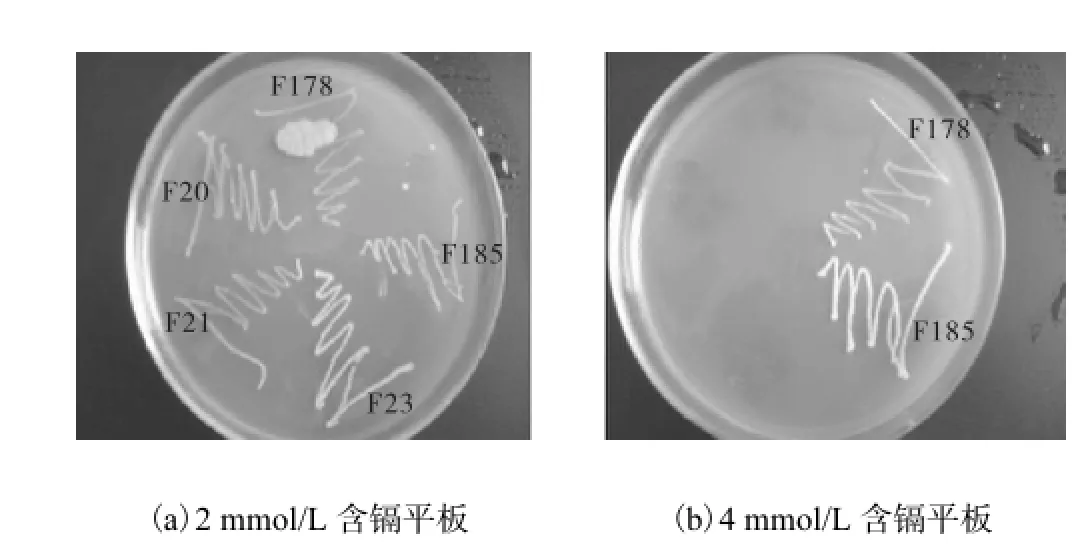
图3 融合菌株在含镉平板培养基上的生长Fig.3 Growth of fused strains on plates containing cadmium
2.3 融合菌对镉污染土壤的修复效果
供试土壤和诺沃肥的主要理化性质见表1.
图4显示,单独接种F178及F185后(SB),萝卜体内镉含量与对照S相比,不但没有下降,反而显著升高(P<0.05).同时接种2株融合菌,萝卜体内镉含量与对照相比也有所提高,但差异不显著(P>0.05).这可能是由于加了微生物,改变了土壤生境,促进萝卜的生长,提高了植物的吸收,导致萝卜体内镉含量的升高.另外,在高浓度镉胁迫下,没有添加有效的营养,无论是外来微生物还是土著微生物都不能得到快速繁殖,不能发挥微生物对重金属的固定作用.Reddy等[12]研究发现在缺乏营养物质的土壤中,生物强化处理技术的效率由于微生物的生长受到抑制而大大降低.
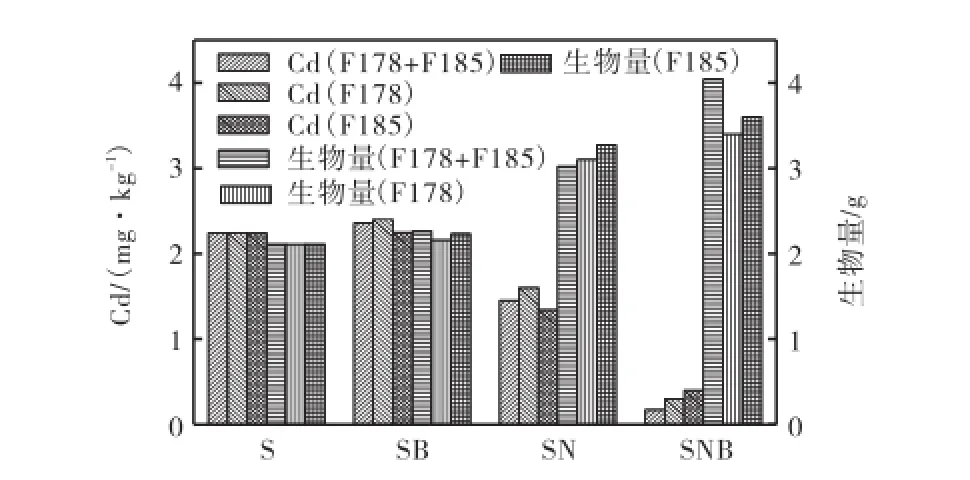
图4 各处理中萝卜体内的镉含量及生物量Fig.4 Biomass and Cd concentrations in raddish grown in Cd-contaminated soil of different treatments
在添加诺沃肥的土壤中(SN),萝卜体内的镉含量与对照组相比,显著降低(P<0.05).诺沃肥自身对Cd有很强的吸附能力.诺沃肥含有大量的羟基、羰基和羧基、丰富的有机质以及石灰,这些基团在固定镉的过程中起到了重要作用[13-14].
同时添加诺沃肥和融合菌的生物强化处理中,萝卜体内的镉含量进一步下降,其中接种F178的生物强化处理,萝卜体内镉降低至0.3,mg/kg;接种F185处理中,萝卜体内的镉降低至0.4,mg/kg;同时接种2株菌,萝卜体内的镉含量最低,其值为0.17,mg/kg,达到了FAO/WHO食品安全质量限量标准0.2,mg/kg.实验室前期研究表明,在添加诺沃肥的土壤中,过氧化氢酶和脲酶活性显著高于对照组,土壤微生物量显著高于未施加诺沃肥只接种微生物的土壤[7],这就说明诺沃肥可以作为营养物质,促进微生物增长,保障微生物修复效果.
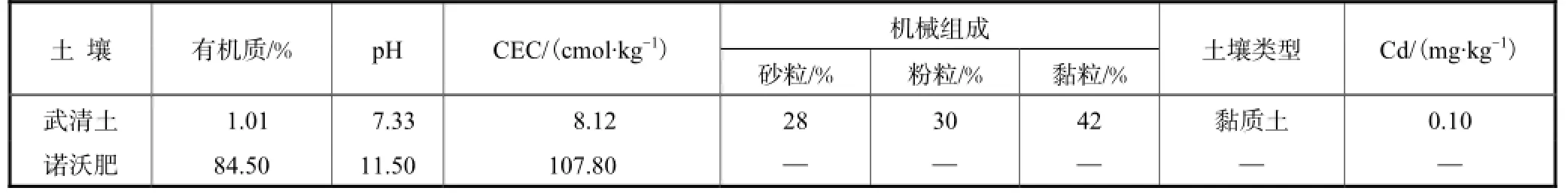
表1 供试土壤和诺沃肥的理化性质Tab.1 Physicochemical properties of soil and NovoGro
在SB处理中,萝卜生物量虽有所升高,但是与对照相比,差异不显著(P>0.05).而SN和SNB处理,萝卜的生物量与对照相比显著提高.在SNB中,同时接种2株融合菌,萝卜的生物量最高,为4.04,g,比对照提高了91%.另外,在3个生物强化处理中,萝卜的生物量与萝卜体内的镉含量呈负相关.这说明加入融合菌的微生物强化技术可对植物的生长和重金属的固定起到协同作用.
同时接种2株融合菌,比单独接种1株处理效果更好,不仅能降低萝卜体内镉含量,还能促进萝卜生长.关于同时接种2种微生物来提高对污染物处理效果的研究已有相关报道,Thompson等[15]建议采用生态理论来设计生物强化策略.增加表型不一致的功能群体的数量,可能导致补偿性的再生,使生态系统更加稳定[16-17].因此,在生物强化系统中接种一系列功能相似的菌种,有利于系统的稳定性.首先,应确定接种的微生物是否有相似的功能,因为功能相异的微生物会发生激烈的竞争作用,导致生物强化系统运行的失败.Jiang等[18]在生物强化系统中接种2种功能性相似的菌株,研究处理酚的效果,结果表明2种菌株即使存在微弱竞争,但是发挥相同的功能,降解酚的效果良好.事实上,有些菌株虽然某些情况下对生态系统是多余的,但是在特定的时间内可能会应对环境的变化,对生态系统的维持起到缓冲作用[16-19],因此接种多种不同特征的微生物可能比单一微生物对生物强化更有效[20].
3 结 论
本文利用基因组改组技术构建对镉有高耐受性的工程菌,并将所获得的工程菌用于镉污染土壤的修复.得到如下结论.
(1) 实验证明基因组改组技术可以被用来构造高效抗镉微生物,通过3轮基因组改组后共获取2株抗镉融合菌,镉对这2种融合菌的最小抑制浓度分别为4.0,mmol/L和4.2,mmol/L,比出发6株突变菌有显著提高.
(2) 在生物修复镉污染土壤的实验中发现,在添加诺沃肥后,分别接种这2种融合菌的生物强化处理可以显著降低萝卜体内的镉浓度,促进萝卜生长.同时利用F178和F185进行生物强化处理时,效果更好.
[1] 施巧琴,吴松刚. 工业微生物育种学[M]. 2版. 北京:科学出版社,2003. Shi Qiaoqin,Wu Songgang. Breeding of Industrial Microbiology[M]. 2nd ed. Beijing:Science Press,2003 (in Chinese).
[2] Zhang Y X,Perry K,Victor C,et al. Genome shuffling leads to rapid phenotypic improvement in bacteria[J]. Nature,2002,415(6872):644-646.
[3] Petri R,Claudia S D. Dealing with complexity:Evolutionary engineering and genome shuffling[J]. Current Opinion in Biotechnology,2004,15:298-304.
[4] 林 峻,施碧红,施巧琴,等. 基因组改组技术快速提高扩展青霉碱性脂肪酶产量[J]. 生物工程学报,2007,23(4):672-676. Lin Jun,Shi Bihong,Shi Qiaoqin,et al. Rapid improvement of lipase production in Penicillium expansum by genome shuffling[J]. Chinese Journal of Biotechnology,2007,23(4):672-676(in Chinese).
[5] 段学军,黄春晓. Ralstonia eutropha菌株镉抗性调节基因CzcR的克隆与序列测定[J]. 生态环境,2007,16(6):1665-1668. Duan Xuejun,Huang Chunxiao. Cloning and sequencing of the cadmium resistance regulation gene CzcR in Ralstonia metallidurans[J]. Ecology and Environment,2007,16(6):1665-1668(in Chinese).
[6] Zhao Xiaowei,Zhou Maohong,Li Qingbiao,et al. Stimultaneous mercury bioaccumulation and cell propagation by genetically engineered Escherichia coli[J]. Process Biochemmistry,2005,40(5):1611-1616.
[7] Jiang Chunxiao,Sun Hongwen,Sun Tieheng,et al. Immobilization of cadmium in soils by UV-mutated Bacillus subtilis 38 bioaugmentation and NovoGro amendment[J]. Journal of Hazardous Materials,2009,167:1170-1177.
[8] 李思光,罗玉萍,吴 兰. 原生质体融合技术构建棕榈油酸高产酵母菌株[J]. 菌物学报,2006,25(3):454-460. Li Siguang,Luo Yuping,Wu Lan. Construction of high palmitoleic acid-producing yeast by protoplast fusion[J]. Mycosystema,2006,25(3):454-460(in Chinese).
[9] 桑稳姣,王 磊,刘 真,等. 高效脱氮菌原生质体融合条件的研究[J]. 武汉理工大学学报,2008,30(7):84-87. Sang Wenjiao,Wang Lei,Liu Zhen,et al. Experimental condition optimization study on getting higher efficiency denitrifier bacteria by protoplast fusion[J]. Journal of Wuhan University of Technology,2008,30(7):84-87(in Chinese).
[10] 谢凤行,张峰峰,周 可,等. 原生质体诱变选育高纤维素酶活性枯草芽孢杆菌的研究[J]. 华北农学报,2010,25(5):211-214. Xie Fengxing,Zhang Fengfeng,Zhou Ke,et al. The mutagenesis of bacillus subtilis protoplast for screening highly producing cellulase strains[J]. Acta Agriculturae Boreali-Sinica,2010,25(5):211-214(in Chinese).
[11] 彭帮柱,岳田利,袁亚宏,等. 酵母菌原生质体融合技术[J]. 西北农业学报,2004,13(1):101-103. Peng Bangzhu,Yue Tianli,Yuan Yahong,et al. Proto-plast fusion in yeast[J]. Acta Agriculturae Borealioccidentalis Sinica,2004,13(1):101-103(in Chinese).
[12] Reddy K,Cutight T. Nutrient amendment for the bioremediation of a chromium-contaminated soil by electrokinetics [J]. Energy Sources,2003,25:931-943.
[13] Chen J P,Lie D,Wang Lin,et al. Dried waste activated sludge as biosorbents for metal removal:Adsorptive characterization and prevention of organic leaching [J]. Journal of Chemical Technology and Biotechnology,2002,77(6):657-662.
[14] Min S,Han J S,Shin E W,et al. Improvement of cadmium ion removal by base treatment of juniper fiber[J]. Water Research,2004,38(5):1289-1295.
[15] Thompson I P,van der Gast C J,Ciric L,et al. Bioaugmentation for bioremediation:The challenge of strain selection[J]. Environmental Microbiology,2005,7(7):909-915.
[16] Naeem S,Li S B. Biodiversity enhances ecosystem reliability[J]. Nature,1997,390(6659):507-509.
[17] Norberg J,Swaney D P,Dushoff J,et al. Phenotypic diversity and ecosystem functioning in changing environments:A theoretical framework[J]. Proceedings of the National Academy of Sciences,2001,98(20):11376-11381.
[18] Jiang H L,Maszenan A M,Tay J H. Bioaugmentation and coexistence of two functionally similar bacterial strains in aerobic granules [J]. Applied Microbiology and Biotechnology,2007,75(5):1191-1200.
[19] Loreau M,Naeem S,Inchausti P,et al. Biodiversity and ecosystem functioning:Current knowledge and future challenges[J]. Science,2001,294(5543):804-808.
[20] Ellis R J,Thompson I P,Bailey M J. Temporal fluctuations in the pseudomonad population associated with sugar beet leaves[J]. FEMS Microbiology Ecology,1999,28(4):345-356.
Breeding Cadmium-Resistant Strains by Genome Shuffling and Bioremediation of Cadmium Contaminated Soil
JIANG Chun-xiao1,2,WANG Ting1,ZHANG Yan-feng1,SUN Hong-wen1
(1. MOE Key Laboratory of Pollution Processes and Environmental Criteria,College of Environmental Science and Engineering,Nankai University,Tianjin 300071,China;2. Environmental Engineering Design Institute Company Limited,Guangzhou 510115,China)
In order to acquire microorganism species with greater capacity to fix heavy metal pollutants in soil,genome shuffling technology was for the first time applied for cultivating strains with high cadmium (Cd)-resistance and accumulation potential. After three rounds of shuffling,two fused strains named F178 and F185 were obtained,whose minimum inhibition concentration (MIC) to cadmium was 4.0 mmol/L and 4.2 mmol/L,respectively,much higher than the MIC of the six original strains (0.08—0.25 mmol/L). The bioremediation effects of the two fused species were checked by pot experiment spiked with Cd concentration of (10 ± 0.4) mg/kg. NovoGro,a fertilizer made from the waste of an enzyme producer,was simultaneously added to support the activity of the organisms in soil. Results of the bioaugmentation experiment show that single inoculation with strain F178 and strain F185 reduces Cd concentration in the root tissue of radish to 0.3 mg/kg and 0.4 mg/kg, respectively, while Cd concentration in the control is 2.24 mg/kg. The biomass of radish is significantly improved,nearly 2 times that of the control. When coinoculated with strain F178 and strain F185,the concentration of Cd in the root tissue of radish is further reduced to 0.17 mg/kg,meeting the FAO/WHO food safety standards (0.2 mg/kg).
heavy metal;soil;protoplast fusion;bioremediation
X53
A
0493-2137(2012)07-0609-06
2011-04-27;
2011-08-15.
天津市农委科技合作项目(0604130).
姜春晓(1979— ),男,博士,高级工程师,jiangchunxiao@mail.nankai.edu.cn.
孙红文,sunhongwen@nankai.edu.cn.

