64层螺旋CT在肝内胆管细胞癌术前分期中的应用
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC),来源于肝内二级分支以下胆管上皮的肿瘤,发病率约占肝脏恶性肿瘤的10%[1]。手术治疗虽然是治愈或延长患者生存时间的有效途径,但是就诊时患者病变大多处于晚期,失去手术机会,因此需要一个合适的或综合的治疗方案,这就需要较准确的临床分期。ICC临床病理分期系统包括美国癌症联合会(AJCC)系统和日本肝癌研究组(LCSGJ)分期系统。以往肝细胞肝癌和ICC临床分期共同采用AJCC/国际抗癌联盟(UICC)肝癌分期系统,并没有独立的ICC分期系统。2009年,AJCC肿瘤分期第7版第一次提出了针对ICC独立的分期系统[2]。本文对照AJCC第7版ICC临床病理分期探讨64层螺旋CT用于ICC临床分期的价值。
1 资料与方法
1.1 研究对象 2006-01~2011-07经病理组织活检证实的42例ICC患者,排除标准:①临床、病理及影像资料不全,不能分期者。②影像资料为非64层螺旋CT扫描者。③CT图像质量差,达不到诊断要求者。其中男14例,女28例;年龄38~74岁,平均(57±12)岁;病程平均(30±15)d,均有不同程度的腹部疼痛,其中15例伴黄疸,6例伴发热。
1.2 仪器与方法 采用GE LightSpeed XT 64层CT机,高压注射器为EZEM Empower CTA专用双筒注射器。患者扫描前10~15min饮水600~1000ml,扫描体位为仰卧位。扫描参数:管电压120kV,管电流400mA,每旋转1周时间0.6s,螺距0.984∶1,准直器厚度0.625mm。行平扫及三期增强扫描,经肘前静脉高压注射碘普罗胺或碘海醇注射液(300mgI/ml)100ml,注射速率3~5ml/s,动脉期、静脉期应用CT扫描系统提供的SMART方法控制,延迟时间约为团注造影剂后3~5min。平扫及增强扫描范围包括整个胆道系统,于吸气并屏气完成,扫描层厚5mm,间隔5mm。将扫描所得数据进行薄层重建,层厚及间隔均为1.25mm,传送至AW4.4工作站。所有病例均行多平面重组(MPR)和最大密度投影( MIP)。
1.3 评价标准 采用单盲法由一名放射科主治医师和一名副主任医师分别独立对ICC患者CT资料进行回顾性分析,意见不一致时,两者协商决定。肿瘤形态按照LCSGJ对ICC大体形态的阐述进行分型[3]。肿瘤侵犯血管评判标准:①肿瘤周围血管形态改变:管腔狭窄、闭塞或变形;②管壁浸润性改变:血管壁毛糙、欠光整。③走形异常(如变直、推移等)。淋巴结转移结合淋巴结大小、形态及强化特点进行综合分析,其中淋巴结短径>1.5cm为淋巴结转移,1.2~1.5cm之间可疑。由一名外科副主任医师依据AJCC第7版阐述对ICC进行临床病理分期[2]。
1.4 统计学方法 采用SPSS 18.0软件,通过Kappa一致性检验观察ICC CT分期与临床病理分期的一致性,Kappa≥0.7表示吻合度较强,0.4≤Kappa<0.7表示吻合度一般,Kappa<0.4表示吻合度较弱。
2 结果

图1 肿块型肝内胆管细胞癌典型强化特征(A~D)、血管侵犯和淋巴结转移(E、F)。平扫肝右叶见低密度肿块,边界不清(A),动脉期边缘强化(B),门脉期强化范围向中心扩大(C),延迟期强化持续并进一步向中心扩大,间隔呈网状强化(D)。肝左叶肝内胆管细胞癌侵犯血管,肝静脉左支紧邻肿块并受压不完整,呈蚕食状(E)。胃小弯侧淋巴结转移,肿大淋巴结形态不规则(F)
2.1 肿瘤分期 CT结果显示42例中肿块型35例,混合型7例;淋巴结转移27例(其中伴腹膜后淋巴结转移15例);血管受侵13例;1例直接侵犯左侧膈肌;2例转移至肾上腺和肺。肿块、淋巴结及血管CT征象见图1。CT分期:Ⅰ期8例,Ⅱ期7例,Ⅳa期10例,Ⅳb期17例;临床病理分期:Ⅰ期12例,Ⅱ期6例,Ⅳa期11例,Ⅳb期13例。
2.2 肿瘤的T分期 本组42例ICC,CT T分期与临床病理结果T分期比较表1。与临床病理结果相比,64层螺旋CT对ICC分期诊断结果各期阳性预测值、在各期中的正确率分别为T1期89%、86%,T2期75%、76%,T3期100%、100%,T4期100%、95%,总的T分期正确率为86%(36/42)。对64层螺旋CT与病理的分期结果进行一致性检验,Kappa=0.780。
2.3 肿瘤的N分期 本组42例ICC,CT N分期与患者临床病理N分期比较见表2。与临床病理结果相比,64层螺旋CT对ICC N0阳性预测值为100%、N1阳性预测值为81%,总的N分期正确率为88%(37/42)。对64层螺旋CT与临床病理分期结果进行一致性检验,Kappa= 0.759。
2.4 肿瘤的M分期 CT与临床病理M分期结果见表3。与临床病理结果相比,64层螺旋CT对ICC M0阳性预测值为100%,M1阳性预测值为76%,M分期总的正确率为90%(38/42)。对64层螺旋CT与临床病理分期结果进行一致性检验,Kappa=0.795。
2.5 肿瘤的血管侵犯情况 CT与临床病理发现的血管受侵比较见表4,64层螺旋CT判断血管受侵的总正确率为95%(40/42),阳性预测值为85%,Kappa=0.884。
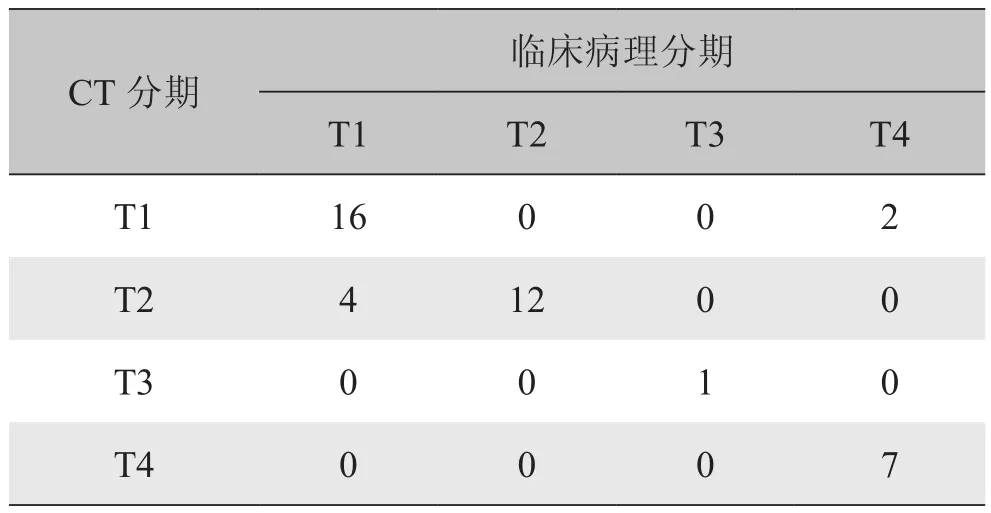
表1 CT与临床病理对肝内胆管细胞癌T分期结果比较
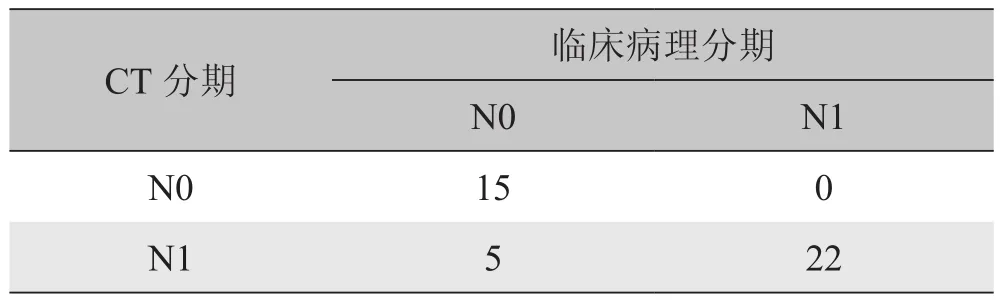
表2 CT与临床病理对肝内胆管细胞癌N分期结果比较
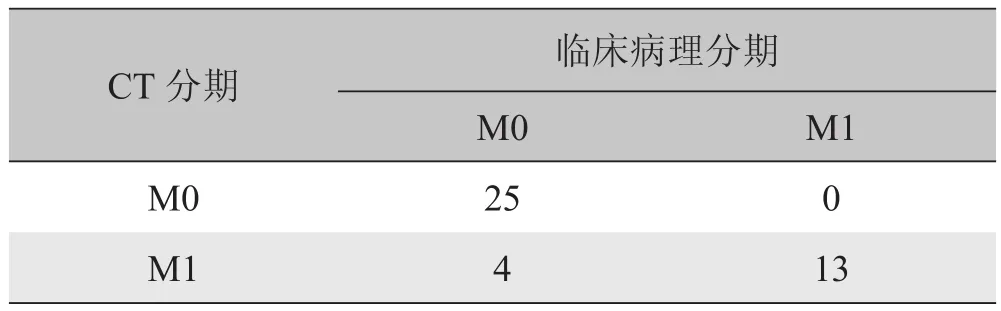
表3 CT与临床病理对肝内胆管细胞癌M分期结果比较
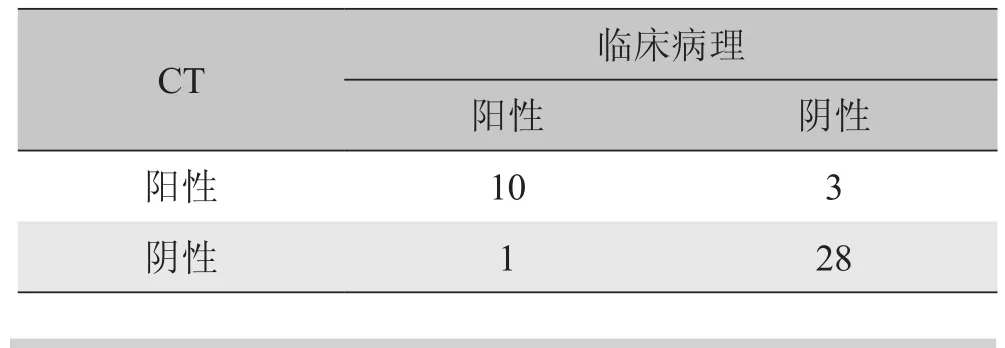
表4 CT与临床病理对肝内胆管细胞癌侵犯血管情况比较
3 讨论
恶性肿瘤临床分期系统对指导肿瘤治疗和判断预后具有重要意义。因此,术前准确分期是临床医师追求的目标,也是实行个体化治疗的基础。术前分期很重要的部分来源于影像对肿瘤局部、外侵情况、淋巴结转移及远处转移资料的总结。AJCC第7版ICC分期系统是基于Nathan等[4]的大样本的监测、流行病学及预后研究结果,并结合LCSGJ的ICC形态分型而成,其摒弃了以往分期系统对肿瘤大小的规定,认为肿瘤数目和肿瘤侵犯血管对影响预后没有差别。因此,将实性肿瘤伴有血管侵犯定为T2a,多发肿瘤伴或不伴血管侵犯定义为T2b。与以往分期系统相比,其临床操作更简单。
本组病例中CT对ICC总的T分期正确率为86%(36/42),与病理结果有较高的一致性。但事实上在判断肿瘤侵及血管及胆管时分辨困难,致使T1、T2、T4间存在假阳性或假阴性。较多研究肯定了CT对肿瘤侵犯血管的评价,其中以肿瘤接触血管程度和肿瘤包绕血管程度的标准最为大家接受[5]。但是ICC生长在肝实质内,肿瘤周围与血管间没有对比较好的脂肪组织,增加评判难度,因此这两种标准在此并不实用。ICC对血管的侵犯为不同于肝细胞肝癌,后者是血管腔内形成癌栓,而前者是对血管壁的浸润[6]。因此,观察肿瘤周围血管形态改变能真实反映出ICC浸润血管病理方式。本组2例为假阳性,分析原因为扩张胆管及胆汁淤积型肝硬化使外周小血管显示细小、不规则。
ICC伴淋巴结转移发生率为30%~32%[4,7]。本组病例中总的N分期正确率为88%(37/42),与临床病理结果一致性程度高。CT提示淋巴结转移27例,病理证实转移22例,与病理对比存在假阳性,假阳性病例中基本上是淋巴结慢性炎症。慢性胆管炎症是胆管细胞癌发生的基础,因此,鉴别炎性淋巴结和转移淋巴结非常必要且困难。CT对转移淋巴结的诊断通常依据淋巴结的大小、形状、密度等变化,对明显增大、坏死、强化的淋巴结诊断敏感性较高,淋巴结增大且呈融合状或(和)不均匀强化时,转移的可能性较大,一般认为直径>15mm有诊断意义;对直径≤10mm、密度均匀的淋巴结则难以诊断是否为转移。CT灌注成像鉴别良恶性淋巴结较常规形态、大小、密度改变具有更高价值[8,9]。然而本研究并未将CT灌注纳入评判淋巴结转移体系,在一定程度上影响结果的准确性。此外,笔者认为尽管CT评估淋巴结转移存在假阳性,但是CT对淋巴结数目和区域的判断非常必要。转移淋巴结数目是独立预后因素,与1~2个淋巴结转移相比,3个以上淋巴结转移预后更差[4,10]。但是AJCC第7版并未对转移淋巴结数目进行规定。很明显CT可提供肿瘤分期系统外的更多信息。
对于ICC的M分期,CT与临床病理比较总的正确率为90%(38/42)。由于AJCC第7版将腹膜后淋巴结定为M1(因为在美国并不常规清扫腹膜后淋巴结,因而影响患者预后),本组病例CT判断腹膜后淋巴结转移有15例定为M1,其中4例为炎性淋巴结。CT在扫描区域内能很敏感地发现远处转移灶,2例CT诊断为肺和肾上腺转移。
综上所述,第7版AJCC ICC分期系统各期阐述简单、易分辨,且64层螺旋CT影像分期与临床病理分期具有很好的一致性,因而术前64层螺旋CT分期有利于判断ICC的预后及制订治疗方案。但本组样本量较小,在肿瘤T1、T2、T4间分期的一致性还需更大样本量证实。此外,本研究未与LCSGJ ICC分期系统进行比较,有待今后进一步研究。
[1]Jiang BG, Sun LL, Yu WL, et al. Retrospective analysis of histopathologic prognostic factors after hepatectomy for intrahepatic cholangiocarcinoma. Cancer J, 2009, 15(3):257-261.
[2]Edge SB, Byrd DR, Compton CC, et al. AJCC cancer staging manual. 7th ed. New York: Springer, 2010.
[3]Liver Cancer Study Group of Japan. Classification of primary liver cancer. Tokyo: Kanehara, 1997.
[4]Nathan H, Aloia TA, Vauthey JN, et al. A proposed staging system for intrahepatic cholangiocarcinoma. Ann Surg Oncol, 2009, 16(1): 14-22.
[5]Slattery JM, Sahani DV. What is the current state-of-the-art imaging for detection and staging of cholangiocarcinoma?Oncologist, 2006, 11(8): 913-922.
[6]Yamasaki S. Intrahepatic cholangiocarcinoma: macroscopic type and stage classi fi cation. J Hepatobiliary Pancreat Surg,2003, 10(4): 288-291.
[7]De Jong MC, Nathan H, Sotiropoulos GC, et al. Intrahepatic cholangiocarcinoma: an international multi-institutional analysis of prognostic factors and lymph node assessment.J Clin Oncol, 2011, 29(23): 3140-3145.
[8]杨智云, 孟悛非, 徐巧兰, 等. 颈部淋巴结病变CT灌注成像. 临床放射学杂志, 2007, 26(9): 865-868.
[9]钟进, 刘筠, 华锐, 等. 颈部淋巴结病变的CT灌注成像研究. 中华放射学杂志, 2011, 45(1): 46-49.
[10]Tamandl D, Kaczirek K, Gruenberger B, et al. Lymph node ratio after curative surgery for intrahepatic cholangiocarcinoma. Br J Surg, 2009, 96(8): 919-925.

