磁共振T2WI结合扩散加权成像对小肾癌亚型的诊断价值
小肾癌是指肿瘤直径≤3.0cm的单发病灶,约占肾癌的8.7%~25.4%[1]。由于肿瘤体积较小,患者很少有明确的临床症状,影像学检查是最重要的早期发现手段。MRI广泛应用于肾脏影像学检查。小肾癌亚型的治疗方法和预后差异较大,本研究旨在探讨T2WI结合扩散加权成像(DWI)检查对小肾癌亚型的诊断价值。
1 资料与方法
1.1 研究对象 2008-12~2009-11解放军总医院共收治72例经手术病理证实的小肾癌患者,术前均行肾脏MRI检查。男47例,女25例;年龄23~86岁,平均(51.5±12.4)岁;临床症状:血尿2例,腰酸痛4例,间断血尿合并腰痛2例,无症状体检发现64例。
1.2 仪器与方法 采用GE Signa 1.5T高场超导MR扫描仪,使用腹部相控阵线圈,患者平静呼吸,加呼吸门控,肾脏轴位、冠状位快速恢复快速自旋回波序列(FRFSE)T2WI:TR/TE 3000~ 7000ms/110~ 115ms,层厚4~5mm,层距0.5~1.0mm,视野(FOV)(26~35)cm×(35~40)cm,矩阵320×224,采集时间为2'48"。DWI成像:采用轴面扫描,选用体部矩阵线圈,采用平面回波 DWI(echo planar imaging DWI, EPI DWI),扫描参数:TR 5000ms,TE 55.2ms,矩阵 128×128,层厚4mm,层距1mm,FOV (35~40)cm×(35~40)cm,激励次数1,呼气末屏气状态下扫描,扫描时间20s。b值为0、800s/mm2,三个方向均施加扩散梯度。
1.3 图像分析 由2名有经验的主治医师以上MR诊断医师采用盲法对MRI T2WI及DWI图像进行分析,有分歧时共同协商取得一致结果,信号强度以同侧肾脏正常实质为标准,所有患者均与病理结果进行比较。
2 结果
2.1 病理结果 右肾37例,左肾35例,均为单发病灶,肿瘤直径0.6~3.0cm。透明细胞癌61例,乳头状肾细胞癌5例,嫌色细胞癌4例,囊性肾细胞癌2例。
2.2 MR表现 72例患者MR图像均显示清晰,无明显磁敏感伪影及图像变形。2例嫌色细胞癌及1例乳头状癌信号较均匀,69例肿瘤信号不均匀。61例透明细胞癌中,56例(91.8%)T2WI表现为混杂高信号(图1A),54例(88.5%)DWI序列表现为高或稍高信号(图1B),5例(8.2%)表现为等信号,2例(3.3%)DWI及T2WI均表现为稍低信号;5例乳头状癌中,4例T2WI表现为低信号(图2A),DWI表现为高或明显高信号(图2B),1例DWI与T2WI均表现为高信号;4例嫌色细胞癌中T2WI均呈低信号,DWI均呈高或明显高信号(图3)。
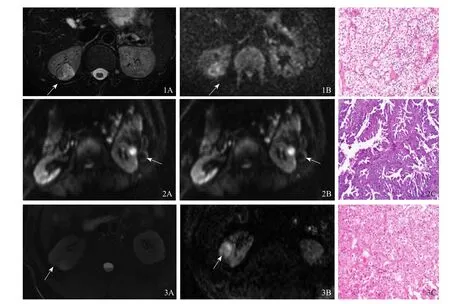
图1 患者男,37岁,右肾透明细胞癌。A.轴位T2WI示右肾中上部类圆形以高信号为主混杂信号;B.DWI示病灶呈稍高信号;C.透明细胞癌(FuhrmanⅠ级),肿瘤细胞胞质内含有细微嗜酸性颗粒(HE,×10)。图2 患者女,47岁,左肾乳头状细胞癌。A.轴位T2WI示左肾中下部圆形短T2信号;B.DWI示病灶呈明显高信号,信号强度较透明细胞癌高;C.乳头状肾细胞癌,胞质较少,细胞核相对均匀的低级别细胞呈乳头状结构排列(HE,×10)。图3 患者男,53岁,右肾嫌色细胞癌。A.轴位T2WI示右肾下部类圆形短T2信号,无囊变坏死;B.DWI示病灶呈高信号;C.嫌色细胞癌,肿瘤细胞呈圆形或多角形,胞质边界清晰,轻度嗜酸性胞质中可见细微网状结构(HE,×20)
3 讨论
肾细胞癌是肾脏最常见的恶性肿瘤,占成人肾实质恶性肿瘤的85%~95%[2]。近年通过影像学检查发现的肾癌明显增多,MRI对小肾癌具有较高的组织分辨率,在显示病灶内部的组织特性等方面较敏感。目前关于肾脏DWI结合T2WI对小肾癌亚型的诊断价值研究较少。
3.1 肾癌亚型与预后 2004年WHO把分子遗传、基因突变和免疫表型作为除组织病理学以外对肾癌进行分类的新标准,将肾癌分为11个亚型[3],其中透明细胞癌、乳头状癌和嫌色细胞癌是最常见的肾脏恶性肿瘤,生长速度和转移发生率差异大,5年生存率也不同。乳头状肾细胞癌和嫌色细胞癌5年生存率为80%~90%,而透明细胞癌只有50%~60%,其中嫌色细胞癌预后更好[3,4]。
3.2 肾癌亚型的DWI与T2WI特点 DWI序列是能探测或显示水分子的随机运动(布朗运动)及水分子运动受限状态的序列, 是目前惟一能够在活体组织内探测水分子自由扩散运动的影像学技术, 属于功能成像[5]。
DWI的信号强度受组织水扩散率和组织本身T2特性的双重影响。T2WI对比反映了组织的不同T2特征,与组织组成、水分子的含量和空间分布有关,而DWI对比显示的是组织内部水分子的不规则热运动的差别,与组织细胞密度密切相关[3]。二者提供的是关于组织不同特征的信息,从而形成不同的对比。观察和分析病变时,需要同时观察常规T2WI及DWI图像。本研究中肾透明细胞癌占本组病例的84.7%,MR信号均不均匀,56例(91.8%)T2WI表现为混杂高信号,54例(88.5%)DWI序列表现为高或稍高信号。病理上肾透明细胞癌质地多不均匀[6,7],易出血、坏死、囊变及钙化而表现为红、黄、灰、白等多种颜色交错的多彩状,该信号特点反映了肿瘤病理改变的复杂性。非透明细胞癌中,乳头状肾细胞癌的MRI表现不均一,本组4例表现为T2WI以低信号为主,混杂有高信号,DWI序列呈高或明显高信号。Tsuda等[8,9]认为肿瘤内富含含铁血黄素、新鲜出血及少细胞等多种因素共同作用是乳头状肾细胞癌MRI显像T2WI低信号的原因,但由于乳头状肾细胞癌容易发生囊性变或坏死,故在T2WI上亦往往见高信号,给诊断带来困难[10]。尽管肾嫌色细胞癌是恶性肾细胞癌之一,但其恶性度相对较低、转移晚、预后好,本组嫌色细胞癌MRI表现为具有均质性的特点,囊变、出血、坏死少见,肿瘤实质部分信号较均匀,在T2WI上大多呈低或稍低信号,DWI序列上呈高或明显高信号,可能原因是肿瘤组织细胞增殖活跃,细胞体积大、排列紧密,导致细胞内外水分子扩散受限,DWI图像呈高或明显高信号。文献[11,12]报道b值为0、800s/mm2时DWI图像上肾非透明细胞癌信号高于肾透明细胞癌,与本组病例特点一致。
3.3 鉴别诊断 透明细胞癌、乳头状肾细胞癌、嫌色肾细胞癌为较常见的肾细胞癌亚型。由于常伴有出血坏死,透明细胞癌在T2WI上多表现为不均匀中高信号,与乳头状肾细胞癌比较[13],透明细胞癌出血、囊变出现的比例低,坏死较前者常见;两者信号都不均匀,但T1WI透明细胞癌多呈中、低信号,而乳头状肾细胞癌以混杂信号为主。嫌色细胞癌质地较均匀,出血坏死、囊变病例少见。
肾细胞癌亦需与含脂肪成分较少的血管平滑肌脂肪瘤(AML)及嗜酸细胞腺瘤进行鉴别。AML含脂肪成分较少时在T2WI也常表现为低信号,部分肾细胞癌在T2WI也可表现为低信号,但乳头状细胞癌内部常有出血,可表现相应信号,而乏脂肪AML信号相对均匀,50%的患者伴发结节性硬化,病灶内钙化罕见[14],而嫌色细胞癌的钙化率较高。唐光健等[15]发现“杯口征”与“劈裂征”在AML与小肾癌的鉴别诊断中有一定参考意义。文献[16,17]报道55%的嗜酸细胞腺瘤中央有特征性的纤维星形瘢痕,并且瘤体越大,此征象越显著,而肾细胞癌多无中央瘢痕。
3.4 术前诊断肾癌亚型的意义 肾癌不同病理亚型的影像学表现、手术方式及预后不同,因此术前正确诊断对手术方式的选择和预后判断具有重要意义。肾细胞癌的预后在很大程度上依赖于术前对其亚型的准确预测。尽管80%的肾肿瘤为恶性,但对部分预后较好的肾癌亚型可以选用保留肾单位的腹腔镜下肾部分切除术、肿瘤剜除术或冷冻治疗、射频消融治疗等非手术方法。若治疗前能明确肾癌的亚型,将有助于医师对患者进行分层,判断预后,并制订个性化的治疗方案,减少术后并发症及死亡率。
综上所述,MR T2WI结合DWI对小肾癌亚型诊断有一定特点,肾透明细胞癌T2WI一般为混杂高信号,DWI为稍高信号或等信号,而非透明细胞癌则多数为T2WI低信号,DWI为明显高信号,其MRI表现对小肾癌亚型的诊断与鉴别有一定帮助。但本组中非透明细胞癌样本量较小,未对T2WI及DWI信号特征进行定量分析,有待进一步研究。
[1]徐朝霞,张学昕,耿江红,等.小肾癌的影像学分析.实用放射学杂志, 2008, 24(8): 1066-1068.
[2]吴阶平.泌尿外科学.济南:山东科学技术出版社,2005: 898-900.
[3]Prasad SR, Humphrey PA, Catena JR, et al. Common and uncommon histologic subtypes of renal cell carcinoma: imaging spectrum with pathologic correlation.Radiographics, 2006, 26(6): 1795-1806.
[4]周建军, 曾蒙苏,严福华,等.双皮质期扫描对肾细胞癌亚型诊断和鉴别诊断的影响.放射学实践, 2010, 25(5):529-532.
[5]李莉, 任转琴,陈涛,等.磁共振扩散加权成像在胆管癌诊断中的价值研究.中国医学影像学杂志, 2011, 19(1):76-80.
[6]Cheville JC, Lohse CM, Zineke H, et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cellcarcinoma. Am J Surg Pathol, 2003, 27(5): 612-624.
[7]康晓丽,何宁,周俊林,等.肾癌亚型的CT表现与病理对照分析. 实用放射学杂志, 2009, 25(4): 512-516.
[8]Tsuda K, Kinouchi T, Tanikawa G, et al. Imaging characteristics of papillary renal cell carcinoma by computed tomography scan and magnetic resonance imaging. Int J Urol, 2005, 12(9): 795-800.
[9]王海屹,张爱莲, 叶慧义, 等. 乳头状肾细胞癌的MR影像表现与病理对照分析. 中国医学影像学杂志, 2009,17(3): 198-201.
[10]Kuroda N, Toi M, Hiroi M, et al. Review of papillary renal cell carcinoma with focus on clinical and pathobiological aspects. Histol Histopathol, 2003, 18(2): 487-494.
[11]Wang H, Cheng L, Zhang X, et al. Renal cell carcinoma:diffusion-weighted MR imaging for subtype differentiation at 3.0T. Radiology, 2010, 257(1): 135-143.
[12]余小多, 林蒙, 欧阳汉, 等. 3.0T MR扩散加权成像诊断肾脏恶性肿瘤.中国医学影像技术, 2010, 26(3): 538-542.
[13]连世东, 谭晓天, 徐哲, 等. 肾透明细胞癌的MRI分析.中国临床医学影像杂志, 2010, 21(1): 64-66.
[14]Kim JK, Park SY, Shon JH, et al. Angiomyolipoma with minimal fat: differentiation from renal cell carcinoma at biphasichelical CT. Radiology, 2004, 230(3): 677-684.
[15]唐光健,许燕.肾血管平滑肌脂肪瘤与肾癌的CT鉴别诊断. 中华放射学杂志, 2004, 38(10): 1090-1093.
[16]Eiss D, Larousserie F, Mejean A, et al. Renal oncocytoma:CT diagnostic criteria revisited. J Radiol, 2005, 86(12):1773-1782.
[17]廖茜, 白人驹, 汪俊萍. 肾嗜酸细胞瘤的CT表现与病理对照分析. 中国医学影像学杂志, 2011, 19(4): 283-286.

