猪繁殖与呼吸综合征病毒GP5基因的亚克隆及原核表达*
李建辉,左玉柱,孙彦欣,范京惠
(河北农业大学动物科技学院,河北保定 071001)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是猪的一种高度接触性传染病,可引起母猪的生殖障碍以及仔猪严重的呼吸道疾病和高病死率[1]。本病的病原为猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),该病毒感染具有两个主要特征,一是持续性的感染,二是免疫抑制作用[2]。PRRSV主要结构蛋白有E蛋白、M蛋白和N蛋白,其中E蛋白即GP5蛋白,由病毒ORF5基因编码。GP5蛋白是PRRSV的囊膜糖蛋白,在病毒感染宿主细胞过程中起着重要作用,同时,还能刺激机体产生中和抗体[3]。但该蛋白含有的3个疏水跨膜区使得应用多种表达系统均难以获得GP5全基因的高效表达[4]。陈军义等[5]曾去除了 N末端的信号肽部分,扩增了GP5全基因中79bp~600 bp的基因片段,并成功地表达了GP5蛋白。Oleksiewicz M B等[6]从噬菌体12肽库中鉴定出一个高度保守的中和表位,即B表位。此外,在位于B表位的7个氨基酸之前,还有一高变异性的免疫优势区域称为A表位,该表位在感染后快速产生非中和抗体。这些特征使得A表位可能成为诱骗表位,从而减少针对邻近NE的保护性反应。顾小雪等[7]扩增了只包括A表位和B表位的一段小肽的基因片段,虽然成功表达,但并不能产生中和抗体。因此,为了获得含有中和活性的PRRSV-GP5蛋白,本研究根据PRRSV-GP5蛋白的结构特点,扩增去除信号肽及A表位的GP5基因获得dGP5,并对表达的PRRSV-dGP5融合蛋白进行SDS-PAGE和 Western blot分析,以期为深入研究PRRSV GP5蛋白的结构和功能奠定基础。
1 材料与方法
1.1 材料
pGEX-6p-1载体和猪PRRS阳性血清均由河北农业大学动物科技学院微生物实验室保存;100bp DNA Lander、预染蛋白Marker购自北京全是金生物技术有限公司;限制性内切酶BamHⅠ、EcoRⅠ、Simple-T 载 体、TaqDNA 聚 合 酶、DL 2 000 DNA plus Marker、T4DNA连接酶等购自宝生物工程(大连)有限公司;DNA胶回收试剂盒、小量质粒提取试剂盒为康维世纪生物科技有限公司,HRP标记的羊抗猪IgG购自北京索莱宝科技有限公司;6份病料(肺脏)采自河北省保定地区临床上疑似PRRS的病猪,并经PCR诊断试剂盒检测为阳性。
1.2 方法
1.2.1 PRRSV GP5基因扩增、克隆及鉴定 根据GenBank中发表的PRRSV GP5全基因序列,使用Primer5.0 软 件 设 计 合 成 特 异 性 引 物。P1:5′-GGATCCAAGCTTATGTTGGGGAAA-3′;P2:5′-CCATGGCTCGAGCTAGAGACGAC-3′。 用 Trizol方法提取PRRSV总RNA,用随机引物进行反转录反应后,进行PCR扩增,目的片段的扩增条件为:95℃5min;94℃30s,52℃45s,72℃1min,35个循环;72℃延伸10min。扩增产物经琼脂糖凝胶电泳、回收后与pMD18-T Vector连接,连接产物转化至感受态细胞DH5α。经质粒抽提、PCR鉴定正确后送天根公司测序,鉴定正确的重组质粒命名为pMD-GP5。
1.2.2 dGP5引物的设计与目的基因的PCR扩增
由于GP5蛋白在表达系统中难以表达,在设计引物P3、P4时将氨基端疏水性较强的信号肽序列去掉。根据Simple-T克隆载体以及pGEX-6p-1表达载体的特点,用Primer5.0软件设计特异性引物,并在上游引物引入BamHⅠ酶切位点,下游引物引入EcoRⅠ酶切位点,预期大小为513bp。引物由天根公司合成,分别为P3:GGATCCATGAGCAACAGCAACAG;P4:GAATTCCTAGAGACG -ACCCCATT。
以重组质粒pMD-GP5为模板,PCR扩增截短后的GP5基因,反应条件为:94℃5min;94℃40 s,51.7℃40s,72℃1min,共30个循环;最后72℃延伸10min。PCR产物用琼脂糖凝胶回收DNA试剂盒进行纯化回收。
1.2.3 dGP5基因重组表达载体的构建 将纯化回收的dGP5基因扩增产物克隆至pMD18-T载体,命名为pMD18-T-dGP5。再用BamHⅠ和EcoRⅠ同时分别双酶切 pMD18-T-dGP5和表达载体pGEX-6p-1,经T4DNA连接酶连接后转化到E.coliDH5α感受态细胞,命名为pGEX-6p-dGP5。提取质粒后转入E.coliBL21(DE3)感受态细胞,进行PCR和双酶切鉴定以及序列测定。
1.2.4 重组表达载体的诱导表达 挑取含阳性重组表达质粒的单菌落,接种于含有氨苄青霉素抗性的LB培养基中,37℃振荡培养至D600nm到0.7,加入终浓度为1mmol/L的IPTG。在30℃下诱导培养,分别于诱导前和诱导后2、3、4、6h取菌。将不同时间取的菌液12 000r/min离心1min,弃上清,再用PBS重悬菌液沉淀,加入等体积的2×SDS上样缓冲液,煮沸变性5min,12 000r/min离心1min,取上清。
1.2.5 重组蛋白的SDS-PAGE鉴定 将分离胶与浓缩胶配好,加样时设置空载体和诱导前菌体作对照。电压在浓缩胶内为90V,在分离胶内为110V。电泳后,用考马斯亮蓝染色1h左右,再在脱色液中脱色2h,期间更换脱色液2次~3次,直到蛋白区域清晰为止。检查重组蛋白的表达情况。
1.2.6 重组蛋白的 Western blot分析 将重组蛋白进行SDS-PAGE电泳后,转印到NC膜。湿转3h后再转移至5 0g/L的脱脂奶粉封闭液中,4℃过夜。次日加入1∶100的猪PRRSV阳性血清(一抗)。室温下作用3h后,用TBST洗膜3次,每次6 min,然后加入1∶1 000稀释的HRP标记的羊抗猪IgG(二抗),室温振荡1h;洗涤同上。最后在暗处将洗涤后的NC膜放入新配置的DAB底物显色液中显色3min~5min,直至条带清晰后迅速用去离子水终止显色反应,拍照记录结果。
2 结果
2.1 PRRSV GP5基因的扩增
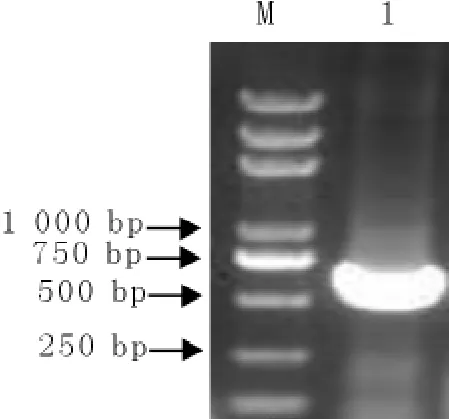
应用RT-PCR方法从疑似病猪的病料中扩增出了大小约为600bp的特异性条带,与预期大小相符(图1)。
2.2 原核表达质粒pGEX-6p-dGP5的构建与鉴定
以pMD-GP5为模板,P3和P4为引物,进行dGP5基因扩增,扩增产物经BamHⅠ、EcoRⅠ双酶切连接至pGEX-6P-1,重组质粒通过PCR扩增和酶切进行鉴定。由图2和图3可知,应用PCR方法从重组质粒中扩增出约500bp左右的特异性基因片段,对重组质粒进行双酶切,分别获得与空载体对照相一致的约4 360bp左右基因片段和约500bp左右的dGP5基因片段,将PCR和双酶切鉴定为阳性的重组质粒进行测序,并将阳性重组质粒命名为pGEX-6p-dGP5。
2.3 表达产物的SDS-PAGE分析
将含有阳性重组质粒的大肠埃希菌用IPTG诱导,在不同诱导时间取样,并经SDS-PAGE检测,结果在约40ku处可见表达条带,与预期蛋白大小相一致(图4),而未诱导菌和空载体菌诱导后,均没有出现此蛋白条带,且在诱导后4h表达量最高。
M.DNA标准DL 2 000;1.GP5基因的PCR产物M.DNA Marker DL 2 000;1.PCR products of GP5gene

图1 RT-PCR扩增的GP5基因Fig.1Amplification of GP5gene by RT-PCR
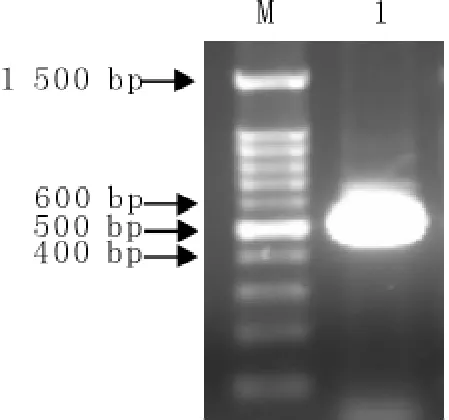
图2 重组质粒pGEX-6p-dGP5的PCR鉴定Fig.2Identification of pGEX-6p-dGP5gene by PCR
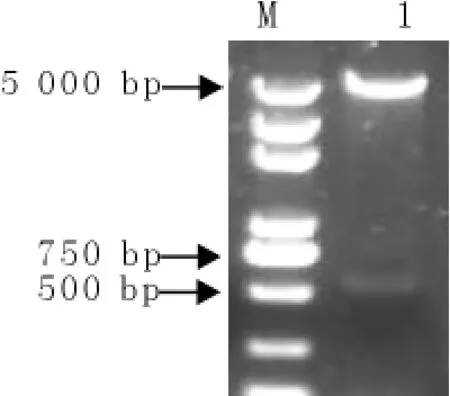
图3 重组质粒pGEX-6p-dGP5的酶切鉴定ig.3Identification of the plasmid pGEX-6p-dGP5by enzyme digestion
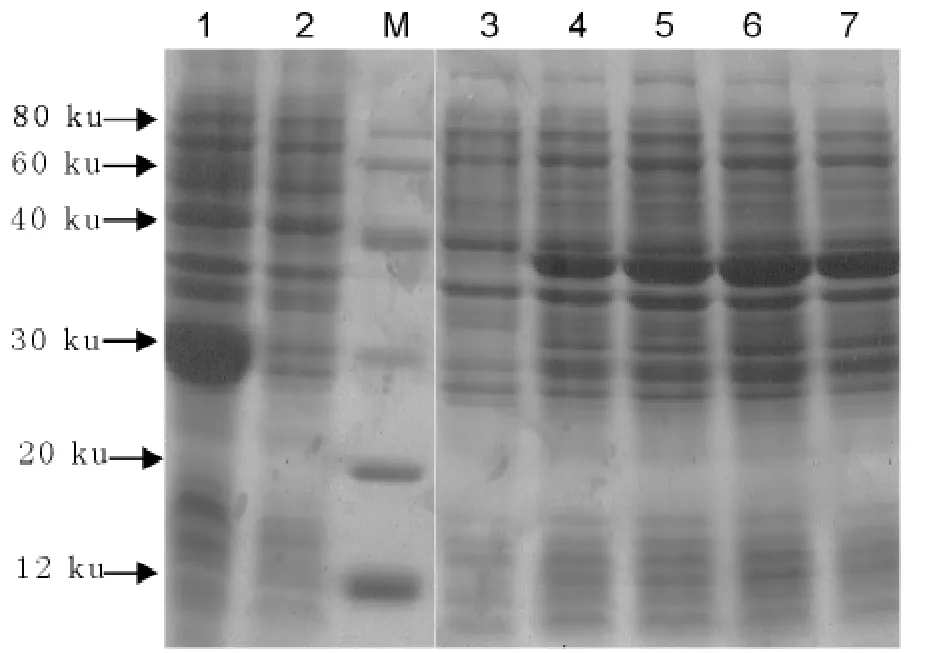
图4 诱导不同时间重组菌的SDS-PAGE分析Fig.4SDS-PAGE analysis of pGEX-6p-dGP5induced in different time
2.4 Western blot鉴定
DAB显色后,在约40ku处有特异性条带,而阴性空载体诱导对照无此特异性反应。证明重组的dGP5在大肠埃希菌中获得了正确表达,且表达蛋白具有良好的抗原性(图5)。
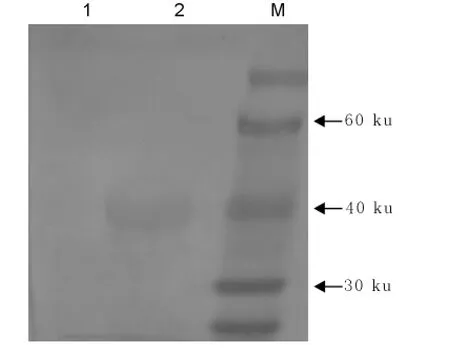
图5 PRRSV-dGP5蛋白的Western blot检测Fig.5Western blot detection of PRRSV-dGP5
3 讨论
猪繁殖与呼吸综合征在全世界范围内迅速的传播,给整个养猪业造成巨大的经济损失,因此研制出有效的疫苗就显得十分重要。本研究中成功得到了缺失了N端30个氨基酸残基的GP5蛋白,这为该疫苗的研制提供了选择的机会。有报道曾经证实,感染PRRSV康复猪的血清中GP5蛋白的抗体滴度与中和病毒的能力具有显著相关性[8]。可见,GP5蛋白可以在机体内产生中和抗体。但鲜有重组的GP5蛋白成功在体内产生中和抗体的报道,可能与A表位的存在,极大地延缓和减弱了B表位诱导中和抗体的产生有关[9]。本试验成功扩增出了缺失A表位基因的dGP5基因片段,为进一步研究中和抗体的产生奠定了基础。
PRRSV-GP5蛋白含有3个疏水跨膜区以及存在较多的大肠埃希菌稀有密码子,这些因素都严重影响了其表达量[10]。在本试验中,目的基因在表达载体pGEX-6P-1中的表达量并不高,证实了上述影响因素存在的可能性。另外,冷超粮等[11]研究结果表明,HP-PRRSV只有B表位并不能诱导产生中和抗体,推测在中和抗体产生的过程中,GP5基因中B表位之外的其他基因片段可能发挥了重要作用。因此本研究仅对N端信号肽序列以及A表位基因这一覆盖表位进行了敲除,而保留了包括B表位基因在内的大部分GP5基因,并在大肠埃希菌中成功表达了大小约40ku的GP5蛋白,经Western blot分析表明,重组的GP5蛋白能够和PRRSV阳性血清反应,具有良好的反应原性。然而,该融合蛋白能否较早激发较强的中和抗体值得进一步深入探究。
[1]Wensvoort G,Terpstra C,Pol J M A,et al.Mystery swine disease in the Netherlands:The isolation of Lelystad virus[J].Vet Microbiol,1991,13(3):121-130.
[2]Snijder E J,Meulenberg J M.The molecular biology of arteriviruses[J].J Gen Virol,1998,271:4684-4691.
[3]周海范,夏平安,崔保安,等.猪繁殖与呼吸综合征病毒河南分离株ORF5基因的克隆与变异分析[J].中国兽医学报,2007,27(6):111-113.
[4]谷 红,杨汉春,郭 鑫,等.PRRSV BJ-4株ORF5基因的原核表达与重组蛋白的纯化[J].畜牧兽医学报,2004,35(1):64-69.
[5]陈军义,王开功,罗险峰,等.PRRSV GZJL株GP5基因的克隆及原核表达[J].河北农业大学学报,2011,34(1):101-104.
[6]Oleksiewicz M B,Botner A .Porcine B-cells recognize epitopes that are porcine reproductive and conserved between the structural of American-and European-type respiratory syndrome virus[J].J GenViro1,2002,83(6):1407-1418.
[7]顾小雪,李玉峰,姜 平,等.猪生殖与呼吸综合征病毒GP5蛋白抗原表位基因的表达及其表达产物的抗原性[J].中国兽医科学,2007,37(12):1053-1057.
[8]王云峰,周艳君,仇华吉,等.应用重组N蛋白-ELISA检测猪繁殖与呼吸综合征抗体的研究[J].中国兽医杂志,2001,37(3):3-5.
[9]刘 涛,陈赛娟,曹洪站,等.猪繁殖与呼吸综合征病毒 HB-3(cz)株ORF5基因序列分析及原核表达[J].中国兽医杂志,2008,44(12):88-91.
[10]Ostvowslti M,Galeota J A,Jar A M,et al.Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5ectodomain[J].2002,76(9):4241-4250.
[11]冷超粮,安同庆,陈家锃,等.高致病性猪繁殖与呼吸综合征病毒GP5蛋白B表位诱导中和抗体能力的研究[J].中国预防兽医学报,2011,33(4):297-300.

