伪狂犬病病毒TJ1株生物学特性研究*-
韩 伟,张 莉*,鄢明华,李秀丽,高俊成,韩孝党
(1.天津市畜牧兽医研究所,天津 300112;2.天津市西青区畜牧水产业发展服务中心,天津 300380)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病。该病毒属于疱疹病毒科甲疱疹病毒亚科[1-2],猪是其自然宿主和储存宿主,可以引起包括猪在内的多种家畜和野生动物发病。新生仔猪临床表现为呼吸困难、厌食、腹泻和神经症状,发病率和死亡率可达100%;妊娠母猪可引发流产、产死胎、木乃伊胎、弱仔等繁殖障碍症,耐过猪感染后形成潜伏感染而终身带毒[3-4]。随着PRV基因缺失疫苗的应用,该病已经得到有效控制,但在一些小规模猪场仍时有发生。笔者从天津某猪场分离到一株伪狂犬病病毒(TJ-1株),对其主要生物学特性进行了研究。
1 材料与方法
1.1 材料
1.1.1 病毒及细胞系 PRV TJ-1株、PK-15、BHK-21和Marc-145细胞均为天津市畜牧兽医研究所兽医研究室保存。
1.1.2 主要试剂 MEM培养基购自GIBCO公司,新生牛血清购自北京民海生物有限公司,PRV荧光标记抗体购自中国兽药监察所。
1.1.3 种蛋及试验用动物 种蛋购自天津市某种鸡场,在本室孵化至10日龄后使用;试验用兔购自天津西青区某养殖场。
1.2 方法
1.2.1 病毒理化特性测定
1.2.1.1 病毒增殖及预处理 PK-15细胞接种 PRV TJ-1株,待出现90%~95%CPE时收获毒液,3 000r/min离心20min,取上清用于后续试验。
1.2.1.2 乙醚敏感性试验 按照文献[5]进行。取灭菌离心管6只,各加入0.8mL收获的TJ-1株病毒液,其中3管加入0.2mL乙醚,另3管加入0.2mL生理盐水作为对照。密闭管口,充分震荡,置4℃处理24h后2 000r/min离心20min。吸取含乙醚的离心管的下层病毒液,在超净台内反复吹吸使乙醚完全挥发后备用。将6个离心管的病毒液分别接种PK-15细胞,测定其TCID50,病毒滴度降低2个数量级判为敏感,反之判为不敏感。
1.2.1.3 氯仿敏感性试验 按照文献[5]进行。取灭菌离心管6只,各加入1mL收获的TJ-1株病毒液,其中3管加入48μL氯仿,另3管加入48μL生理盐水作为对照。充分混匀震荡,置4℃处理10min,500r/min离心5min。吸取试验组离心管上层的病毒液备用。将6个离心管的病毒液分别接种PK-15细胞,测定其TCID50,病毒滴度降低2个数量级判为敏感。
1.2.1.4 胰蛋白酶敏感性试验 按照文献[5]进行。取灭菌离心管6只,各加入0.5mL收获的TJ-1株病毒液,其中3管加入0.5mL胰酶(浓度1%),另3管加入0.5mL生理盐水作为对照。密闭管口,充分震荡离心管,37℃水浴作用1h,加入灭活犊牛血清4mL,充分混合后备用。将6个离心管的病毒液分别接种PK-15细胞,测定其TCID50,病毒滴度降低2个数量级判为敏感,反之判为不敏感。
1.2.1.5 酸碱敏感性试验 按照文献[5]进行。取装有TJ-1株培养物2mL的离心管6只,用0.1 mol/L HCl和 NaOH 调 pH 至3、5、6、8、10、11,于37℃水浴作用1h,在接种细胞前将所有离心管中液体 pH 调至7.0,立即接种 PK-15 细胞,测定TCID50。试验重复3次,观察pH对病毒效价的影响。
1.2.1.6 热敏感性试验 按照文献[6-7]进行。取盛有TJ-1株培养物1mL的离心管6只,置于56℃水浴,分别于作用5、10、15、30、45、60min后,取出接种于PK-15细胞,测定其TCID50,病毒滴度降低2个数量级判为敏感,该试验重复3次。
1.2.2 免疫荧光试验 将灭菌飞片置于24孔板内,每孔加入一定量的PK-15细胞,待长成单层后,在每个飞片上接种TJ-1株,同时设不接毒细胞对照。取接毒24h~48h的飞片,用PBS缓冲液漂洗2次,置丙酮中固定20min后自然风干,加入PRV荧光标记抗体,37℃作用2h,再用PBS液冲洗,吸去飞片表面的水分,滴加500mL/L甘油碳酸盐缓冲液,加盖玻片,荧光显微镜观察结果。
1.2.3 细胞培养特性 将TJ-1株分别接种于PK-15、BHK-21和 Marc-145细胞,于37℃、体积分数为5%CO2培养箱中培养,记录病毒在3种细胞上的产生病变的情况。
1.2.4 鸡胚绒毛尿囊膜接种 按照文献[8]进行。将TJ-1株接种于3枚10日龄鸡胚绒毛尿囊膜,每枚接种0.2mL,同时用相同剂量的MEM维持液接种鸡胚作为对照。鸡胚置培养箱继续孵化144h,每日照蛋2次,弃去24h死亡鸡胚,观察24h~144h死亡和未死亡的鸡胚绒毛尿囊膜是否有痘斑形成。1.2.5 家兔人工感染试验 按照文献[9]进行。取TJ-1株的细胞培养物颈部皮下接种于3只家兔,每只注射1mL,空白对照家兔接种相同剂量的MEM维持液,两个试验组分开隔离饲养14d,每天观察家兔的采食、体温、精神状态等情况。
2 结果
2.1 病毒理化特性的测定
由表1可见,PRV TJ-1株经乙醚、氯仿、胰蛋白酶处理后病毒滴度显著下降,说明病毒对这3种试剂均敏感;由图1可见,该病毒在pH 5.0以下和8.0以上,TCID50明显降低,在pH 5.0至8.0之间病毒较稳定,TCID50变化幅度小;由图2可见,病毒在56℃条件下,随着时间的延长,病毒滴度逐渐降低,至60min时病毒可被灭活。
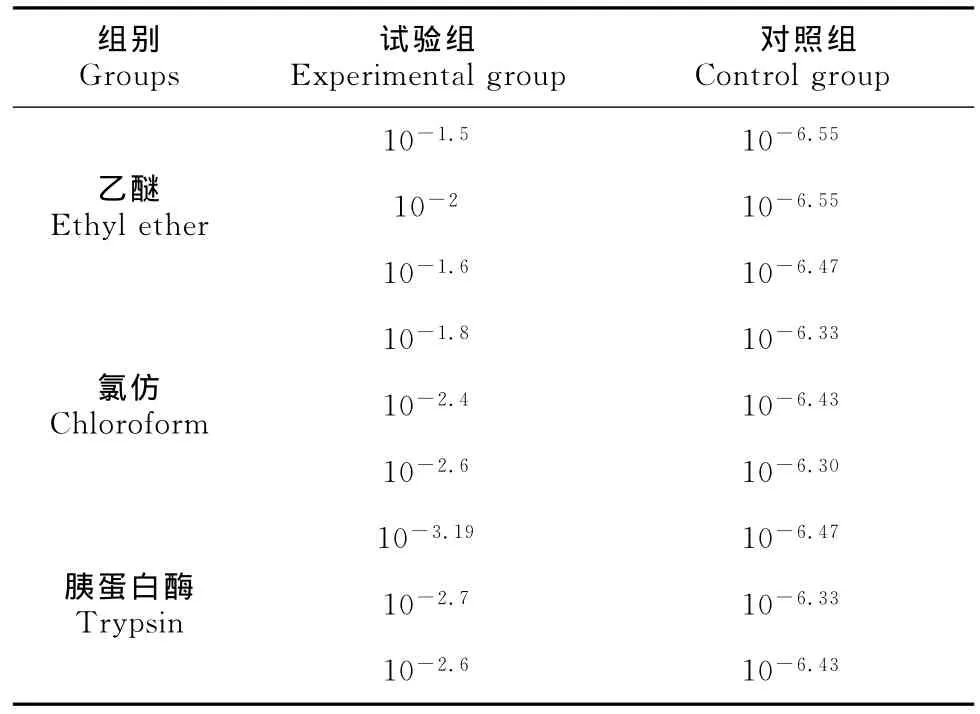
表1 伪狂犬病病毒TJ-1株对乙醚、氯仿、胰蛋白酶敏感性Table 1The sensitivity of PRV TJ-1strain to ethyl ether,chloroform and trypsin(TCID50/0.1mL).
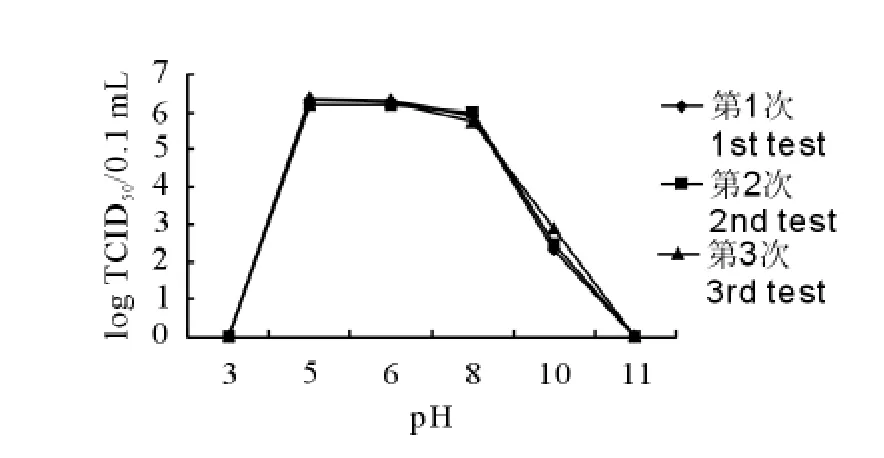
图1 伪狂犬病病毒TJ-1株对酸碱敏感性Fig.1The sensitivity of PRV TJ-1strain to acid and alkali
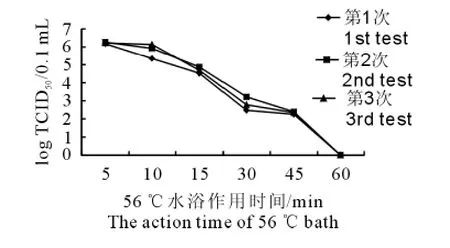
图2 伪狂犬病病毒TJ-1株对56℃热灭活敏感性Fig.2The sensitivity of PRV TJ-1strain to heat-inactivation at 56 ℃
2.2 免疫荧光试验
用PRV荧光标记抗体检测感染TJ-1株的PK-15细胞,在胞浆内可见特异性的绿色荧光,而正常的PK-15细胞无荧光(图3)。
2.3 病毒在3种细胞上的增殖特性
PRV TJ-1 株 在 PK-15、BHK-21 和 Marc-145细胞上均能生长,但细胞病变存在明显差异(图4)。PK-15细胞接毒后早期可见细胞膨大,随之细胞变性圆缩,继而开始脱落逐渐形成空斑病灶;BHK-21细胞接毒后感染细胞变性圆缩,有合胞体出现,细胞逐渐死亡脱落,形成分散病灶区;Marc-145细胞接毒后,早期可见细胞拉长,随之细胞变圆,细胞逐渐融合形成空斑,继而逐渐脱落。试验中PK-15和BHK-21两种细胞在18h~24h即可出现细胞病变,Marc-145在24h~28h出现细胞病变。

图3 伪狂犬病病毒TJ-1株感染PK-15细胞免疫荧光实验结果(200×)Fig.3Immunofluorescence test result of PK-15cell inoculated with PRV TJ-1(200×)
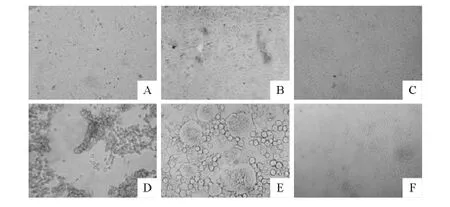
图4 伪狂犬病病毒TJ-1株在3种细胞上的细胞病变Fig.4CPE of PRV TJ-1strain on three cell lines
2.4 鸡胚绒毛尿囊膜接种
接种TJ-1毒株后144h,鸡胚均未死亡,4℃冻胚4h后观察病变,可见鸡胚绒毛尿囊膜水肿、增厚并有白色的痘斑,对照鸡胚绒毛尿囊膜无异常病变(图5)。
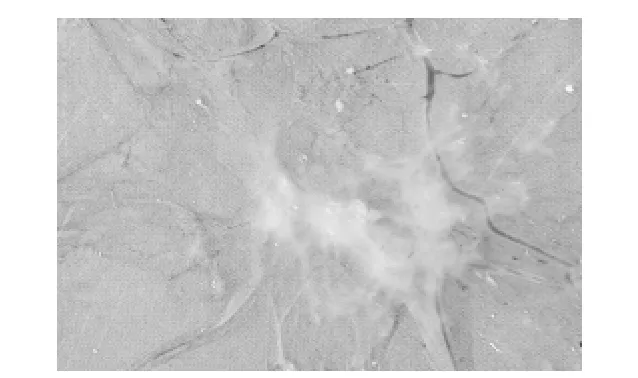
图5 鸡胚尿囊膜形成痘斑Fig.5 Pox spots on chick chorioallantoic membrane
2.5 动物试验
接种TJ-1毒株细胞培养物3d后的兔子表现为奇痒,用嘴啃咬注射部位,使注射部位被毛脱落,皮肤受损,继而死亡。而注射MEM维持液对照家兔无异常变化。
3 讨论
伪狂犬病是多种家畜和野生动物的一种重要的病毒性传染病,给养殖业带来很大的经济损失。德国、瑞典、奥地利、英国和丹麦等已经实现了PR的净化,在我国近些年随着伪狂犬病病毒基因缺失疫苗和gE-ELISA抗体检测方法的使用[10],已鲜有大规模发病的报道。在天津地区某猪场笔者分离到了伪狂犬病病毒,说明仍需重视该病的防控,特别是大型养殖场应定期对猪群进行监测,制定净化方案而消灭本病。本文对伪狂犬病病毒天津(TJ-1)分离株的主要生物学特性进行分析,结果将为该毒株的深入研究奠定基础。
本研究对伪狂犬病病毒TJ-1株的理化特性分析表明,该毒株对乙醚、氯仿、胰蛋白酶均敏感,在pH 5至8之间病毒较稳定,而当pH为3或者11时,病毒在37℃1h可以被灭活。此外,该毒株对热有一定的抵抗力,病毒在56℃条件下,随着时间的增长,病毒滴度逐渐降低。本文试验数据与陈陆等报道的伪狂犬病病毒Fa株的理化特性相似,但TJ-1株在耐热性方面较弱,置于56℃ 经60min病毒可被灭活。
伪狂犬病病毒为疱疹病毒属病毒,具有广嗜性,研究报道该病毒能在多种细胞上增殖[11-13]。为了解TJ-1株的细胞增殖特性,本文将其接种于PK-15、BHK-21和Marc-145细胞,结果发现该毒株在3种细胞上均可增殖。3种细胞相同的细胞病变主要为细胞变圆,形成散在病灶,继而逐渐扩散至全部细胞,细胞溶解脱落。但是3种细胞产生病变的时间不同,而且只在BHK-21细胞观察到了多核合胞体。
[1]Straw B E,Zimmerman J J,`Allaire S D,et al.猪病学[M].北京:中国农业大学出版社,2008:465-477.
[2]Nauwynck H,Glorieux S,Favoreel H,et al.Cell biological and molecular characteristics of pseudorabies virus infections in cell cultures and in pigs with emphasis on the respiratory tract[J].Vet Res,2007,38(2):229-241.
[3]韩 勇,李文刚,项朝荣,等.猪伪狂犬病病毒的分离和鉴定[J].动物医学进展,2007,28(3):43-44.
[4]张 莉,丁伯良,王英珍,等.区分猪伪狂犬病病毒gE缺失疫苗株和野毒株的gE-PCR方法的建立[J]动物医学进展,2008,29(11):5-8.
[5]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:329-340,998-1009.
[6]张超范,刘长明,危艳武,等.致病性猪伪狂犬病病毒PRV-JF株的分离鉴定[J].中国预防兽医学报,2008,30(3):212-215.
[7]陈 陆,郭万柱,殷华平,等.伪狂犬病病毒基因缺失疫苗制苗用毒种特性研究[J].中国病毒学,2005,20(2):130-134.
[8]杨润德,郁宏伟,张洪德,等.猪伪狂犬病病毒的分离鉴定[J].中国兽医杂志,2008,44(1):25-26.
[9]邢俊玲,高付城.猪伪狂犬病诊断检测方法的研究进展及应用[J].山东畜牧兽医,2010,30(9):91-92.
[10]孙圣福,陈 静,马慧玲,等.不同日龄猪伪狂犬抗体跟踪监测与分析[J].中国畜牧兽医,2011,38(4):232-234.
[11]张 辉,方六荣,赵 骞,等.伪狂犬病毒UL14基因缺失突变株的构建及其生物学特性研究[J].畜牧兽医学报,2007,38(4):369-375.
[12]程晓霞,陈小莺,胡奇林,等.猪伪狂犬病病毒在几种细胞中增殖情况的比较[J].福建畜牧兽医,2006,28(6):37-38.
[13]陈瑞爱,邵定勇,韩静芳.猪伪狂犬病毒TK缺失株PRV/TK-的构建及其生物学特性[J].中国兽医学报,2011,30(5):577-582.

