组蛋白去甲基化酶JARID1B的表达纯化及酶活力分析
郭 雪 刘 意 杨慧蓉 徐彦辉
(1复旦大学生物医学研究院结构生物学实验室 上海 200032;2复旦大学生命科学学院结构生物学实验室 上海 200433)
组蛋白甲基化是一种重要的翻译后修饰,影响染色质形成、翻译调控及DNA损伤修复等多种生化过程。研究证实组蛋白H3上的多个赖氨酸残基(如H3K4、H3K9、H3K27、H3K36和 H3K79)可以发生甲基化修饰,其中H3K4、H3K36和H3K79的甲基化与转录激活相关,而H3K9和H3K27的甲基化则与转录抑制联系[1-3]。随着2004年第一个组蛋白去甲基化酶LSD1(lysine-specific-demethylase1)的发现[4],目前为止已经有几十种组蛋白去甲基化酶被发现。这些已知的组蛋白去甲基化酶可以分为两类:以LSD1为代表的第一类酶在发生催化反应时需要黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)作为辅助因子;第二类含JmjC(jumonji C)结构域的酶在去甲基化过程中需要FeⅡ和α-同戊二酸(α-ketoglutarate,α-KG)的参与[5-9]。
JARID1B(jumonji AT-rich interactive domain 1B)属于第二类组蛋白去甲基化酶,能特异性去除H3K4的三甲基化修饰,从而抑制相应基因转录。该蛋白在乳腺癌、前列腺癌等的发生过程中起着非常重要的作用,被认为是重要的药物靶标蛋白[10-11]。人源JARID1B(也称PLU-1)蛋白序列全长1544个氨基酸残基,包含JmjN、Arid、JmjC、Zinc-finger和3个PHD(一个位于N端,两个位于C端)等结构域,它是含JmjC结构域的去甲基化酶家族中拥有结构域种类和数量最多的成员之一。结构功能域的多样性与复杂性在很大程度上影响了该全长蛋白的表达和纯化,本文通过软件预测全长蛋白的二级结构,结合预测的二级结构和已知结构功能域边界设计新的截短体蛋白JARID1B1-825,并采用昆虫细胞表达系统制备得到大量具有酶活性的蛋白,为后续的结构与功能研究以及药物筛选等工作奠定了基础。
材料和方法
材料 E.coliTOP10及DH10BacTM感受态细胞由实验室自制。pFastBacHT B质粒和含人jarid1b目的基因的质粒由中国科学院生化与细胞所的陈德桂老师惠赠。PCR产物纯化试剂盒、胶回收试剂盒购自爱思进生物技术(杭州)有限公司;质粒抽提试剂盒购自北京索莱宝科技有限公司;高保真的Pfu DNA聚合酶、限制性内切酶、T4DNA连接酶、dNTP、DNA marker、蛋白 marker购自日本TaKaRa生物工程有限公司;异丙基-β-D硫代半乳糖苷(IPTG)及β-半乳糖苷酶(X-gal)购自生物工程(上海)有限公司;各种抗生素购自北京赛尔曼生物技术有限公司。E.coli LB培养基及SOC培养基参照《分子克隆手册》配制;昆虫细胞培养基SFX-insect购自美国HyClone公司。
JARID1B的截短设计 全长1544个氨基酸残基的JARID1B包含JmjN、Arid、PHD1、JmjC、Zincfinger、PHD2和PHD3等7个结构域(图1)。采用PSIPRED(position specific iterated PRED)Server预测全长蛋白二级结构,并结合已知文献报道的结构功能域边界设计蛋白截短体。
重组Bacmid DNA的制备
重组 pFastBacHT B-jarid1b1-825质粒的构建以全长 JARID1B的cDNA为模板,用5′-CATCGGATCCATGGAGGCGGCCACCACACT-3′上游引物和5′-TGACCTCGAGTCATCTAGTTTGCCTTTTGCCAT-3′下游引物及高保真的Pfu DNA聚合酶进行PCR反应,反应条件为:98℃预变性3min;98℃、20s,55℃、20s,72℃、3min,30个循环;72℃后延伸10min。纯化扩增获得的目的DNA片段与载体pFastBacHT B分别用限制性内切酶BamH1和Xhol在37℃双酶切2h。将酶切后胶回收的目的基因片段和载体室温连接1h,转化E.coli TOP10感受态细胞,涂布于含氨比西林和庆大霉素的LB固体培养基上培养过夜。PCR筛选阳性单克隆,送美国Invitrogen公司测序。
人jarid1b1-825基因从质粒到Bacmid的转座将测序 正 确 的 pFastBacHT B-jarid1b1-825质粒加入DH10BacTME.Coli感受态细胞中,冰育30min,42℃热激45s,冰育2min,加入1mL SOC培养基,37℃、220r/min复苏4h,10倍梯度稀释,涂布于含50μg/mL卡那霉素、7μg/mL庆大霉素、10μg/mL四环素、100μg/mL X-gal和40μg/mL IPTG的LB固体平板上。37℃培养24~48h,直到菌落蓝白斑分明,挑选白色单克隆划线涂布在新的平板上,进一步确定阳性白斑克隆。挑选白色单克隆入含50 μg/mL卡那霉素、7μg/mL庆大霉素和10μg/mL四环素的液体LB培养基中,37℃、220rpm培养14~20h,保存甘油菌,并抽提DNA。
重组bacmid DNA的抽提与鉴定 13000r/min离心5mL过夜培养的DH10BacTM-jarid1b1-825菌体30s,弃上清;加入250μL溶液Ⅰ(含100mg/mL的RNase A)重悬细胞沉淀至均匀;加入250μL溶液Ⅱ,轻摇5~7次,混匀,裂解细胞;加入350μL溶液Ⅲ(溶液Ⅰ、Ⅱ、Ⅲ取自索莱宝公司质粒抽提试剂盒),轻摇8~10次,混匀;冰上放置5min,13000r/min离心15 min,将上清转移到新的EP管中,加入等体积100%异丙醇,轻轻反复上下颠倒EP管,充分混匀,静置5~10min,13000r/min离心15min,吸尽上清,用75%乙醇清洗DNA沉淀,13000r/min离心5min,吸尽乙醇,放置室温,待乙醇挥发尽后加入30μL超纯H2O溶解DNA。用bacmid正向引物M13F和反向引物 M13R以及jarid1b1-825的正向引物和bacmid的反向引物M13R进行PCR鉴定,确定目的jarid1b1-825基因转座成功。
重组bacmid DNA转染Sf9昆虫细胞 取2μg转座成功的bacmid DNA(即包含目的基因jarid1b1-825)加入到100μL不含血清和抗生素的Grace培养基中;另外取一EP管加入100μL不含血清和抗生素的Grace培养基和6μL CellfectinⅡ试剂轻轻混匀,室温放置5min后加入到bacmid DNA溶液中,轻弹混匀,室温放置30min。同时准备Sf9昆虫细胞:取1×106个细胞铺入3.5cm培养皿中,培养基(不含血清和抗生素)体积为2mL,铺板后静置20min左右。将bacmid DNA和转染脂质体混合液加入平皿中,27℃培养4h,换正常培养基SFX-insect,27℃培养72h,收P0代病毒(4000×g离心15min,上清即为病毒),4℃避光保存。转染同时设阳性和阴性对照,阴性对照不含DNA。
取2mL P0代病毒感染40mL悬浮的Sf9昆虫细胞,27℃、110r/min培养72h,收P1代病毒。再用P1代病毒以1∶1000感染Sf9细胞,得P2代病毒。
His6×-JARID1B1-825融合蛋白的表达与纯化JARID1B1-825蛋白的表达 P2代病毒以1∶200感染Hi5昆虫细胞(密度为8×105),培养基为SFX-insect,27℃、110r/min培养48h,4000×g离心15min,收取细胞沉淀。
Ni-NTA亲和层析纯化JARID1B1-825French Press细胞破碎仪裂解细胞,裂解缓冲液为:25mmol/L Tris/Cl(pH 8.0)、500mmol/L NaCl和2mmol/Lβ-巯基乙醇(β-mercaptoethanol,β-ME)。30000×g离心45min,上清过Ni-NTA 亲和层析柱(美国通用电气医疗集团)。蛋白挂柱后,用20个柱体积的25mmol/L Tris/Cl(pH 8.0)、500mmol/L NaCl,2mmol/Lβ-ME和20mmol/L咪唑(pH 8.0)的washing缓冲液冲洗非特异结合的杂蛋白。然后用25mmol/L Tris/Cl(pH 8.0)、500mmol/L NaCl、2mmol/Lβ-ME和250mmol/L(pH 8.0)的洗脱缓冲液洗脱与Ni柱特异结合的目的蛋白JARID1B1-825。
Sourse Q阴离子交换纯化JARID1B1-825将目的蛋白JARID1B1-825在低盐缓冲液[20mmol/L Tris/Cl(pH 8.0)+3mmol/L DTT]条件下上样于阴离子交换柱SQ(美国通用电气医疗集团),而后梯度增加盐浓度[高盐缓冲液:20mmol/L Tris/Cl(pH 8.0)+1 mol/L NaCl+3mmol/L DTT]洗脱目的蛋白。
分子筛层析纯化JARID1B1-825目的蛋白JARID1B1-825经分子筛层析柱(美国通用电气医疗集团,Superdex 20010/300GL)纯化。分子筛缓冲液含10mmol/L Tris/Cl(pH8.0)、500mmol/L NaCl和3mmol/L DTT。
MALDI-TOF 分析测定JARID1B1-825的去甲基化酶活性 取10μg纯化得到的高纯度JARID1B1-825蛋白与1μg化学合成的多肽H3K4me3[ARTK(me3)QTARKSTGGKA]37℃反应1h。酶活反应缓冲液含30mmol/L Tris-HCl(pH 7.4)、150mmol/L NaCl、50μmol/L(NH4)2Fe(SO4)2、1mmol/Lα-酮戊二酸和2mmol/L抗坏血酸盐。去甲基化酶活反应结束后,对样品进行脱盐处理:将10μL的反应溶液过C18 Ziptip(德国Merck Millipore公司)脱盐柱,而后用含70%乙腈和0.1%三氟乙酸的洗脱溶液洗脱挂在脱盐柱上的多肽,送至复旦大学生物医学研究院公共服务平台进行 MALDI-TOF(ABI 4700)质谱分析。
结 果
JARID1B截短蛋白的设计 全长人JARID1B(GI:296439317)功能结构域如图1所示,去除C-端2个PHD结构域(PHD2和PHD3)的截短蛋白JARID1B1-825含 JmjN、Arid、PHD1、JmjC 和 Zincfinger等5个密集在N-端的结构域。
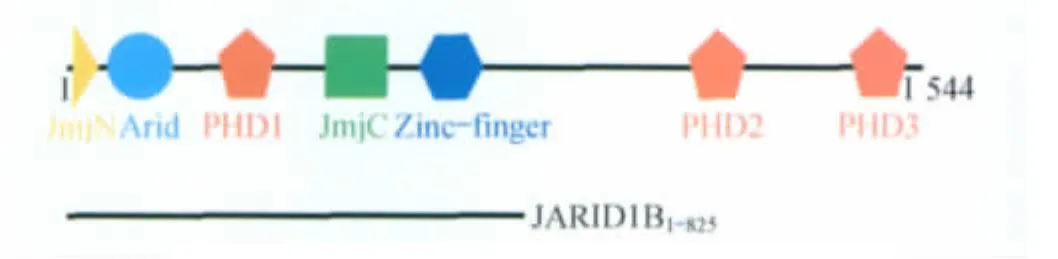
图1 JARID1B的结构功能域示意图Fig1 Schematic representation of domain structure of JARID1B
重组bacmid-jarid1b1-825DNA的鉴定bacmid-Jarid1b1-825的开放式阅读框的大小为2475bp,如果pFastBacHT B-jarid1b1-825质粒携带的目的基因jarid1b1-825被成功整合到 DH10BacTME.coli的bacmid中,那么用bacmid的上游引物M13F和下游引物M13R进行的PCR反应产物的DNA片段大小应约为4900bp(2430bp+2475bp),而用jarid1b1-825的上游引物和bacmid的下游引物M13R进行的PCR反应产物大小约为2500bp(图2)。
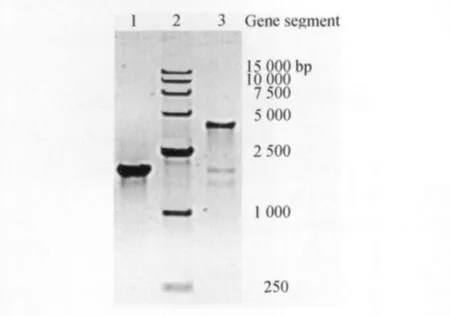
图2 重组bacmid-jarid1b1-825DNA 的 PCR 鉴定结果Fig2 The PCR verification of recombinant bacmid-jarid1-825
JARID1B1-825蛋白的表达和纯化 转染后获得的病毒经过2代的扩展获得了P2代的高毒力病毒,之后进行不同感染浓度的检测(1∶1000、1∶500、1∶200、1∶100),并进行表达时间的优化(48、60、72、84、96h),每个条件培养50mL细胞,进行少量的纯化检测,结果发现以1∶200浓度感染并培养48h后收集细胞获得最高的蛋白产量。之后按照优化的条件扩大至 1L培养。His6×-JARID1B1-825融合蛋白的相对分子质量应为96.5×103,过 Ni-NTA亲和层析柱得到的蛋白纯度较低(图3),为了得到纯度更高的目的蛋白,进一步采用Sourse Q阴离子交换的方法将Ni柱洗脱下来的蛋白进行纯化(JARID1B1-825的计算等电点pI 为6.22,网站http://web.expasy.org/protparam),得到纯度大于90%的目的蛋白(图4)。图5所示的是分子筛层析得到的高纯度目的蛋白JARID1B1-825。将对应的目的条带割胶后送质谱鉴定确定为目的蛋白(结果未放入本文)。经过上述纯化过程后,经UV280测浓度,获得JARID1B1-825蛋白质约10mg(从1L细胞培养得到的产物量,产率为10mg/L)。

图3 JARID1B1-825的Ni柱亲和层析纯化Fig3 Purification of JARID1B1-825by Ni-NTA
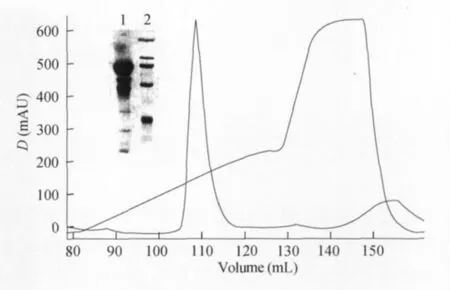
图4 JARID1B1-825的Source Q阴离子交换层析Fig4 Purification of JARID1B1-825by Source Q
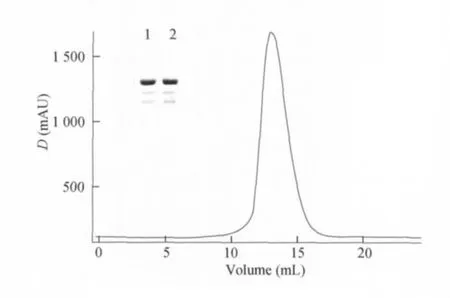
图5 JARID1B1-825的分子筛层析Fig5 Purification of JARID1B1-825by filtration
JARID1B1-825的去甲基化酶活力分析 体外合成JARID1B底物组蛋白修饰多肽 H3K4me31-15aa(ARTK(me3)QTARKSTGGKA)的理论相对分子质量为1602.8×103,MALDI-TOF质谱分析结果显示其为1603.1×103(图6A),与理论值一致。如果H3K4me31-15aa失去1个甲基基团(-CH3),其相对分子质量应减去14×103(-CH2的相对分子质量),从而变成1589.1×103;如果失去2个甲基基团,则应减少为1575.1×103。从加有截短蛋白JARID1B1-825的多肽质谱分析谱图(图6B)中可以看到,出现了分别代表相对分子质量1575.08×103和1589.15×103的峰。若以代表相对分子质量1575.08×103峰的峰高为100%,那么代表二甲基化和三甲基化的多肽峰则均只有10%左右,也就是说,在本文所采用的反应条件 下(10μg JARID1B1-825∶1μg H3K4me3,37℃,1h),绝大多数三甲基化的H3K4被去二甲基变成了H3K4me1。体外酶活测定实验显示截短的JARID1B1-825依然具有去甲基化的酶活活力,能特异催化H3K4me31-15aa多肽去一甲基和去二甲基。值得注意的是JARID1B1-825在体外没有去me1的活性,因此催化反应的最终产物为H3K4me1,与文献报道一致[5-9]。

图6 截短体JARID1B1-825的去甲基化酶活力分析Fig6 Demethylase activity analysis of JARID1B1-825
讨 论
组蛋白去甲基化酶通过与组蛋白甲基转移酶协同作用调控着组蛋白的甲基化修饰水平,这些甲基化修饰可以被含有特定结构域如Chromo结构域、PHD结构域、Tudor结构域和WD40repeat等的效应蛋白解读,从而启动下游的生物学反应,调控基因转录的激活、沉默、DNA损伤修复等,广泛参与发育分化、细胞衰老、肿瘤的发生发展等细胞生物学过程[12-13]。
JARID1组蛋白去甲基化酶家族包含JARID1A/RBP2、JARID1B/PLU-1、JARID1C/SMCX和JARID1D/SMCY等4个成员,它们通过对三甲基化或二甲基化的H3K4(H3K4me3/me2)去甲基化修饰,发挥抑制基因转录的作用[10,14-16]。JARID1A控制细胞分化[17],调节 HOX 基因 转录[14];JARID1C与 X 连锁精神发育迟滞(X-linked mental retardation,XLMR)相关[15,18]。JARID1B和肿瘤的发生密切相关,其表达可以被癌基因c-ErbB2显著上调。正常生理情况下,JARID1B表达量非常低,但在导管性乳腺癌和前列腺癌中均可发现JARID1B高度表达[10-11,19]。JARID1B 的 高表达抑制了其下游14-3-3σ、BRCA1、CAV1 和HOXA5等抑癌基因的表达[10],进而促使肿瘤发生与发展。此外,JARID1B对乳腺癌细胞系 MCF-7的增殖和免疫缺陷小鼠乳腺癌的发生也是必需的[10]。因此,阐明JARID1B去甲基化酶的作用机制对于研究肿瘤的发生发展有重要意义。
全长1544个氨基酸残基的人源组蛋白去甲基化酶JARID1B(相对分子质量175.7×103)在E.coli中表达量极低且性质不好,非常不稳定,我们课题组曾经尝试多种截短该蛋白亦不能解决此问题,因此本文设计利用昆虫细胞表达系统表达纯化了它的截短蛋白。为了使其截短体尽可能拥有全长蛋白的酶活活力,本文尽可能地保留了JARID1B的功能结构域(仅去除C-末端的2个PHD结构域)。经尝试不同的蛋白表达系统,最终从昆虫细胞中获得大量的目的蛋白,进一步的去甲基化酶活实验证实了该截短体(JARID1B1-825)具有去组蛋白甲基化的酶活性。现有研究结果证实JARID1B能特异性去H3K4的三甲基化和二甲基化修饰,但其对甲基化位置和状态的特异性选择机制尚不清楚。本文为进一步研究JARID1B的功能和药物筛选奠定了基础。
[1]Zhang Y,Reinberg D.Transcription regulation by histone methylation:interplay between different covalent modifications of the core histone tails[J].Genes Dev,2001,15(18):2343-2360.
[2]Martin C,Zhang Y.The diverse functions of histone lysine methylation[J].Nat Rev Mol Cell Biol,2005,6(11):838-849.
[3]Margueron R,Trojer P, Reinberg D. The key to development:interpreting the histone code?[J].Curr Opin Genet Dev,2005,15(2):163-176.
[4]Shi Y,Lan F,Matson C,et al.Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J].Cell,2004,119(7):941-953.
[5]Shi Y,Whetstine JR.Dynamic regulation of histone lysine methylation by demethylases[J].Mol Cell,2007,25(1):1-14.
[6]Chen Z,Zang J,Whetstine J,et al.Structural insights into histone demethylation by JMJD2family members[J].Cell,2006,125(4):691-702.
[7]Cloos PA,Christensen J,Agger K,et al.The putative oncogene GASC1demethylates tri-and dimethylated lysine 9 on histone H3[J].Nature,2006,442(7100):307-311.
[8]Tsukada Y,Fang J, Erdjument-Bromage H,et al.Histone demethylation by a family of JmjC domain-containing proteins[J].Nature,2006,439(7078):811-816.
[9]Whetstine JR,Nottke A,Lan F,et al.Reversal of histone lysine trimethylation by the JMJD2family of histone demethylases[J].Cell,2006,125(3):467-481.
[10]Yamane K,Tateishi K,Klose RJ,et al.PLU-1is an H3K4demethylase involved in transcriptional repression and breast cancer cell proliferation[J].Mol Cell,2007,25(6):801-812.
[11]Xiang Y,Zhu Z,Han G,et al.JARID1Bis a histone H3 lysine 4demethylase up-regulated in prostate cancer[J].Proc Natl Acad Sci U S A,2007,104 (49):19226-19231.
[12]Ng SS,Yue WW,Oppermann U,et al.Dynamic protein methylation in chromatin biology[J].Cell Mol Life Sci,2009,66(3):407-422.
[13]Cloos PA,Christensen J,Agger K,et al.Erasing the methyl mark:histone demethylases at the center of cellular differentiation and disease[J].Genes Dev,2008,22(9):1115-1140.
[14]Christensen J,Agger K,Cloos PA,et al.RBP2belongs to a family of demethylases, specific for tri-and dimethylated lysine 4on histone 3[J].Cell,2007,128(6):1063-1076.
[15]Iwase S,Lan F,Bayliss P,et al.The X-linked mental retardation gene SMCX/JARID1Cdefines a family of histone H3lysine 4demethylases[J].Cell,2007,128(6):1077-1088.
[16]Lee MG,Norman J,Shilatifard A,et al.Physical and functional association of a trimethyl H3K4demethylase and Ring6a/MBLR,apolycomb-like protein[J].Cell,2007,128(5):877-887.
[17]Benevolenskaya EV,Murray HL,Branton P,et al.Binding of pRB to the PHD protein RBP2promotes cellular differentiation[J].Mol Cell,2005,18(6):623-635.
[18]Tahiliani M,Mei P,Fang R,et al.The histone H3K4 demethylase SMCX links REST target genes to X-linked mental retardation[J].Nature,2007,447 (7144):601-605.
[19]Barrett A,Madsen B,Copier J,et al.PLU-1nuclear protein,which is upregulated in breast cancer,shows restricted expression in normal human adult tissues:a new cancer/testis antigen?[J].Int J Cancer,2002,101(6):581-588.

