PARG基因沉默对大肠癌CT26细胞移植瘤生长与转移的影响
盛永涛 王娅兰 杨 怡 王洁琼
(重庆医科大学基础医学院病理学教研室分子医学与肿瘤研究中心 重庆 400016)
聚腺苷二磷酸核糖基化[poly-(ADP-ribosyl)ation,PAR]是生物体内聚腺苷二磷酸核糖多聚体在聚腺苷二磷酸核糖聚合酶催化下共价连接到接受体蛋白上去的过程,通过它实现蛋白质翻译后的修饰。PAR与细胞中许多重要事件密切相关,如基因稳定性的维持、转录的调控、DNA的修复、细胞分化、肿瘤发生等[1]。
聚腺苷酸二磷酸核糖转移酶[poly-(ADP-ribose)polymerase,PARP]和聚腺苷二磷酸核糖水解酶[poly-(ADP-ribose)glycohydrolase,PARG]是调控这一过程的两个重要酶类。PARG是目前所知的唯一一种能在细胞核内水解PAR的酶[2],它对于维持PAR的动态平衡至关重要。在小鼠体内已发现两种PARG亚型,即PARG110和PARG60,以PARG110尤为重要,主要定位在细胞核和细胞质[3]。已有大量研究表明,通过抑制PARP可以降低结肠癌[4-5]、肺癌[4-5]、乳腺癌[4]、卵巢癌[4]等肿瘤的生长、侵袭、转移能力,部分研究已经进入到临床试验阶段。相比PARP,PARG对于肿瘤影响的研究目前仍限于离体实验。
本课题组前期的一系列离体实验表明[6-8],通过药物或慢病毒载体转染等抑制大肠癌PARG基因的表达,可以影响PARP、AKT、NF-κb及其下游因子的表达,并进一步降低大肠癌血管的形成、癌细胞与血小板的黏附能力、癌细胞的侵袭能力等。但目前尚无在体实验数据来支持上述离体研究结果。基于此,本实验将PARG基因预先被干预的CT26细胞注射到BALB/c小鼠脾包膜下,建立大肠癌肝转移模型,并用 Western blot检测脾脏移植瘤内PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF、FGF-2的表达,通过在体实验进一步探讨PARG对大肠癌肝转移的影响。
材料和方法
实验动物 BALB/c小鼠,SPF级,18只,雌性,6~8周龄,体重18~20g,动物合格证号SCXK(渝20020001),购于重庆医科大学实验动物中心并由其饲养。
肿瘤细胞 小鼠结肠癌CT26细胞株由四川大学魏于全教授惠赠。由美国Sigma公司提供PARG-shRNA慢病毒转染载体,并经吴伟强等[9]转染筛选,获得PARG空载和沉默的稳定CT26细胞株。
实验试剂 抗PARG抗体(英国Abcam公司),抗 PARP-1抗体、抗 P-AKT473、抗 NF-κB p65抗体、抗 VEGF抗体、抗FGF-2抗体、抗β-actin抗体(美国Santa Cruz公司),抗AKT抗体(上海碧云天生物技术有限公司),HRP标记的兔抗羊和羊抗兔IgG抗体(北京中杉金桥生物技术有限公司)。
细胞培养 分别常规培养未转染PARG-shRNA慢病毒载体的CT26细胞、转染未搭载PARG-shRNA的慢病毒载体(空载体)的CT26细胞和转染PARG-shRNA慢病毒载体的CT26细胞。收集对数生长期细胞,制备成相应的1×107/mL的单细胞悬液。
小鼠结肠癌CT26细胞肝转移动物模型的建立将BALB/c小鼠随机分3组:未转染组、PARG空载组、PARG沉默组,每组6只,分别接种相应的CT26细胞。以未转染组、PARG空载组为对照组,沉默组为实验组。参照Liu等[10]的方法:右下腹偏外侧腹腔注射2%水合氯醛(0.3g/kg)麻醉BALB/c小鼠,仰卧固定,取左上腹腋中线切口进腹,暴露脾脏,以脾膈面下极为进针点,将预先制备的CT26单细胞悬液注射于脾脏包膜下,每只小鼠注射细胞数为5×105个(即1×107/mL×50μL),止血后关腹。接种14天后处死动物,观察脾脏移植瘤及肝转移瘤生长及分布情况,并取脾脏移植瘤进行后续相关指标的检测。肿瘤体积(v)的计算参考Huang等[11]的方法:v=ab2/2(a:肿瘤最大直径,b:肿瘤最小直径),肿瘤数目为多个时间点计算体积之和。肝脏转移瘤的分级参考Liu等[10]的方法分为4级:0级,肝脏转移瘤数目为0;Ⅰ级,肝脏转移瘤数目为1~5个;Ⅱ级,肝脏转移瘤数目为6~10个;Ⅲ级,肝脏转移瘤数目>10个或肿块融合无法计数。
Western blot检测脾脏移植瘤组织中PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF、FGF-2的表达 取冻存的各组脾脏移植瘤组织,按试剂说明提取总蛋白、核蛋白,并用BCA法检测蛋白浓度。8%SDS-PAGE凝胶电泳转膜(PVDF膜)、封闭后,用相应目的蛋白的抗体孵育,置于4℃冰箱过夜,其中对总蛋白分别用抗PARG、PARP-1、AKT、P-AKT473、VEGF、FGF-2、β-actin的一抗孵育;对核蛋白用抗NF-κB p65、β-actin的一抗孵育。次日复温0.5h后,辣根酶标记的二抗孵育2h,超敏ECL化学发光试剂检测膜上的免疫反应条带,BIO-RAD凝胶成像仪成像,Quantity One软件分析。用各蛋白与对应的内参照β-actin的积分光密度比值作为蛋白表达的相对含量。
统计学分析 应用SPSS 19.0软件进行相关数据分析。各组脾脏转移瘤体积及PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF、FGF-2的表达量用()表示,用单因素方差分析。各组肝脏转移瘤结节分级后采用Kruskal-Wallis法与Nemenyi法综合分析,P<0.05为差异有统计学意义。
结 果
各组小鼠结肠腺癌脾脏移植瘤和肝脏转移瘤的观察与比较 未转染组及空载组中所有小鼠脾脏接种处均见移植瘤形成,灰白色,结节数多为单个,偶见2~3个,其中未转染组脾脏移植瘤体积为0.988~1.913cm3。空载组脾脏移植瘤体积为1.078~2.113cm3。PARG沉默组脾脏接种处均见移植瘤形成,呈灰白色,单发,体积为0.270~0.565cm3。各组小鼠的脾脏转移瘤体积统计学分析显示,未转染组与空载组相比(P>0.05),差异无统计学意义;未转染组与沉默组相比(P<0.05),空载组与沉默组相比(P<0.05),差异均有统计学意义(图1、表1)。
未转染组及空载组所有小鼠肝脏均可见灰白色多发转移瘤形成,多在30个以上,部分肝转移瘤有融合结节形成,其他脏器未见转移瘤。沉默组中仅部分小鼠发生肝转移,转移瘤呈灰白色,无结节融合,其他脏器未见转移。对肝脏转移瘤结节分级后经统计学Kruskal-Wallis法与Nemenyi法综合分析,未转染组与空载组相比(P>0.05),差异无统计学意义;未转染组与沉默组相比(P<0.05),空载组与沉默组相比(P<0.05),差异均有统计学意义(图1、表1)。
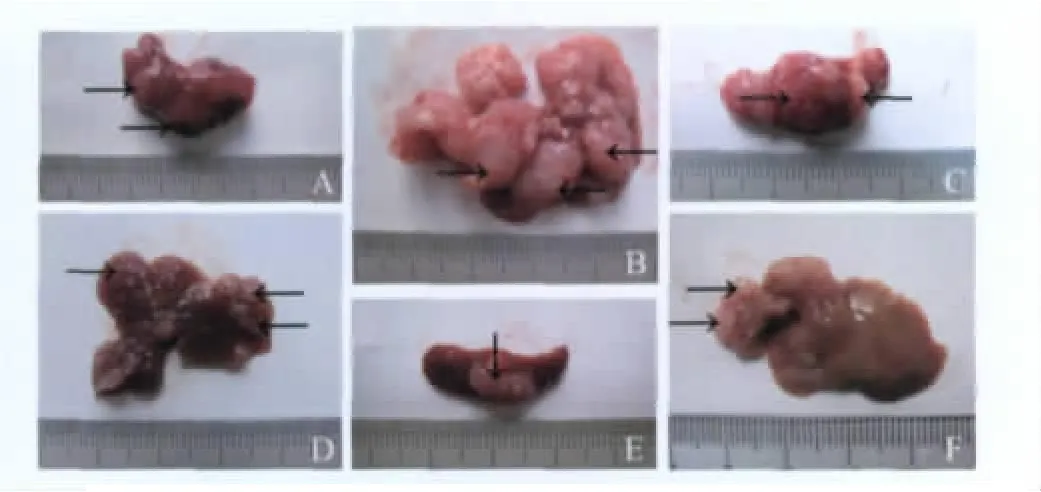
图1 各组小鼠脾脏移植瘤和肝脏转移瘤肉眼观Fig1 Photographs of tumor growth in the spleen and liver after transfection in various mice groups
各组小鼠脾脏移植瘤PARG、PARP-1、AKT、PAKT473、NF-κB、VEGF、FGF-2蛋白的表达 未转染组、PARG空载组和PARG沉默组脾肿瘤的PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF、FGF-2蛋白的相对表达量见图2、表2。除AKT外,沉默组与未转染组其余各蛋白表达量比较(P均<0.05),沉默组与空载组比较,P 均<0.05,差异均有统计学意义。沉默组与对照组的总AKT表达量比较(P>0.05),差异无统计学意义,说明PARG的改变对AKT总的表达影响不显著。所有检测蛋白空载组与未转染组比较(P均>0.05),差异无统计学意义,说明病毒本身对PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF、FGF-2蛋白的表达无明显影响。
表1 各组脾脏移植瘤体积、肝脏表面转移瘤结节数及等级Tab1 Volume of xenografted tumors in the spleen,quantity and grade of metastatic tumors in the liver after transfection in various groups (n=6,)
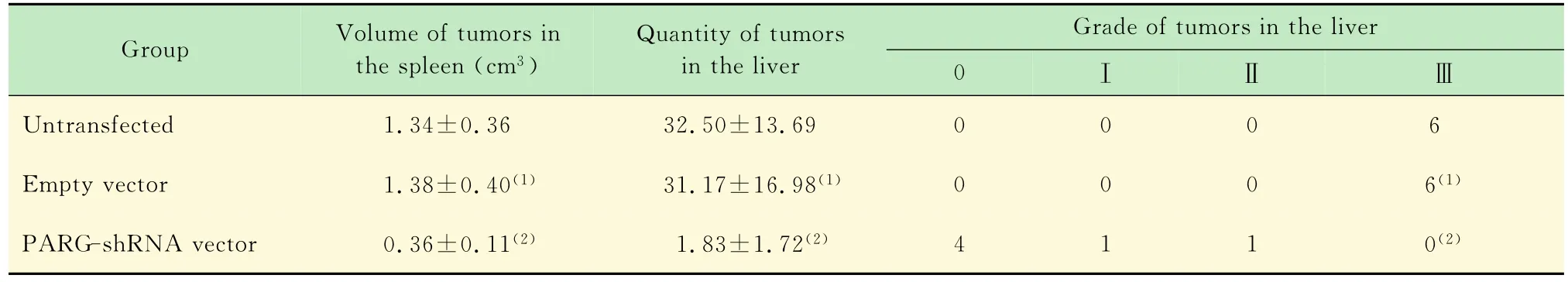
表1 各组脾脏移植瘤体积、肝脏表面转移瘤结节数及等级Tab1 Volume of xenografted tumors in the spleen,quantity and grade of metastatic tumors in the liver after transfection in various groups (n=6,)
(1)vs.untransfected group,P>0.05;(2)vs.untransfected group or empty vector group,P<0.05.
表2 各组小鼠脾脏移植瘤PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF及FGF-2蛋白的表达Tab2 Expressions of PARG,PARP-1,AKT,P-AKT473,NF-κB p65,VEGF and FGF-2protein in xenografted tumors in the spleen after transfection in various groups (n=6,)
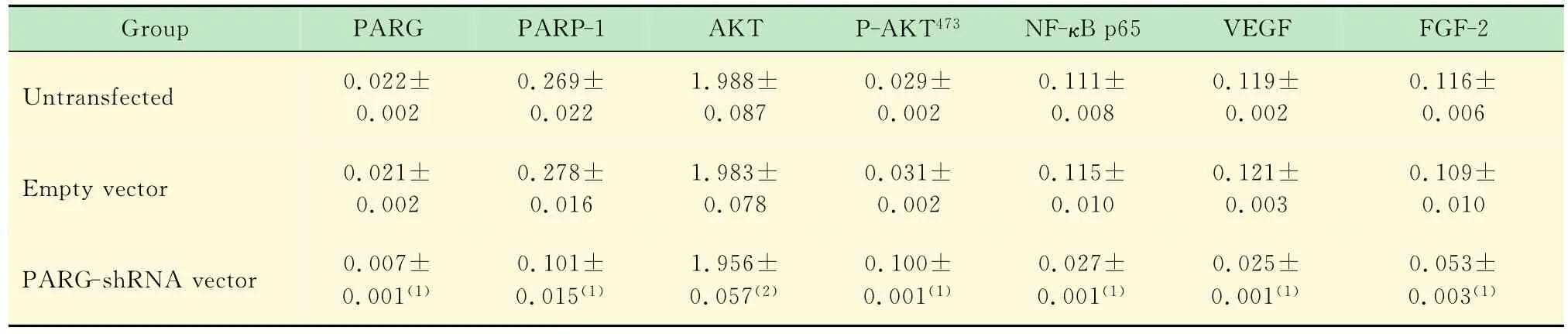
表2 各组小鼠脾脏移植瘤PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF及FGF-2蛋白的表达Tab2 Expressions of PARG,PARP-1,AKT,P-AKT473,NF-κB p65,VEGF and FGF-2protein in xenografted tumors in the spleen after transfection in various groups (n=6,)
vs.untransfected group or empty vector group,(1)P<0.05,(2)P>0.05.
讨 论
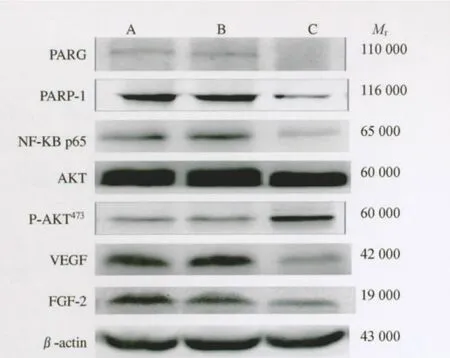
图2 各组小鼠脾脏移植瘤PARG、PARP-1、AKT、P-AKT473、NF-κB p65、VEGF及FGF-2蛋白表达的凝胶电泳Fig2 Gel electrophoresis results of PARG,PARP-1,AKT,P-AKT473,NF-κB p65,VEGF and FGF-2expressions in xenografted tumors in the spleen in various groups
PAR化是哺乳动物体内一个重要反应,需要PARP-1的参与。PARP结合聚ADP核糖基后处于失活状态,PARG水解聚ADP核糖基后可使PARP再次活化[12]。PARG与PARP的动态平衡对于维持PAR循环的可持续进行、保持受体蛋白活性稳定必不可少。PARG表达受抑制后,能进一步抑制PARP活性[13]。本课题组前期的离体实验结果[6-9]表明,在人、小鼠的大肠癌细胞中亦存在着PARG对PARP的调节。本次研究的在体试验结果显示:PARG基因沉默后PARP的表达也随之降低。提示在小鼠体内PARG与PARP的表达有关,结果与离体实验结果[6-9]一致。
当细胞的PARP基因被敲除或被药物抑制时,其DNA修复能力减弱,对相关损害如电离辐射、烷化剂、重金属等的敏感性增强,这会使肿瘤细胞修复能力减弱,对放疗、化疗的敏感性增强,起到抗肿瘤的作用,相关离体实验已经证明这一点[14-15]。Min等[16]研究进一步表明:对细胞和小鼠的PARG基因进行抑制,能够表现出与PARP沉默相同的效应。我们前期的研究结果显示,抑制PARP可以抑制小鼠CT26细胞脾脏移植瘤的肝转移,PARG基因沉默可抑制人大肠癌LoVo细胞侵袭、黏附能力[7]。但PARG基因沉默是否可抑制小鼠CT26细胞脾脏移植瘤的肝转移尚不清楚。在本实验中,沉默组小鼠脾脏移植瘤大小和肝转移瘤数量都明显弱于对照组,这一结果提示PARG基因沉默与小鼠大肠癌CT26细胞脾脏移植瘤的肝转移有关。
已有研究表明:PARP-1是 NF-κB通路的正性调节蛋白。目前已发现PARP-1对NF-κB转录活性的调节有两种方式:一种是通过促分裂原活化蛋白激酶级联反应和PI3K/AKT信号转导通路来调节[17];另一种是通过抑制 PARP-NF-κB-复合物的形成来降低 NF-κB 的转录活性[15]。Veres等[18]对小鼠败血病模型的研究结果进一步表明,PARP抑制后是通过激活PI3K/AKT通路来降低NF-κB的转录活性。本研究结果显示,抑制PARG后,PARP、NF-κB p65表达降低,P-AKT473表达升高,提示在大肠癌中,PARG在PI3K/AKT信号转导通路中可能发挥了作用,这与本课题组前期对大肠癌细胞的离体研究结果[7,19]一致。
VEGF、FGF-2是已知的 NF-κB下游因子,是促血管生成(包括肿瘤血管生成)的重要因子。在肿瘤发生时,两者均可由肿瘤细胞产生且表达明显高于正常[20-21]。VEGF、FGF-2均可以通过促进内皮细胞有丝分裂、迁移和增生,增加血管通透性来促进新生血管生成,部分肿瘤细胞自身尚可表达bFGFR,FGF-2可以通过自分泌直接刺激肿瘤细胞,促进肿瘤细胞增殖[21]。
血管生成是肿瘤生长和扩散的关键步骤[22]。基于此,本研究在观察各组脾脏移植瘤中PARG、PARP、AKT、P-AKT473、NF-κB p65表达的同时,也观察了VEGF、FGF-2的表达。结果显示:与对照组相比,沉默组PARG表达降低在抑制PARP的同时也抑制了 NF-κB p65、VEGF、FGF-2的表达,而P-AKT473的表达则增强,这与本课题组前期的离体实验结果[7,19]是一致的。我们推测PARG可能是通过调节PARP,进而改变PI3K/AKT、NF-κB p65的表达,最终影响 VEGF、FGF-2来降低肿瘤血管的生成,达到抑制肿瘤生长与扩散的效应。
[1]Quénet D,El Ramy R,Schreiber V,et al.The role of poly(ADP-ribosyl)ation in epigenetic events[J].Int J Biochem Cell Biol,2009,41(1):60-65.
[2]Hottiger MO,Hassa PO,Lüscher B,et al.Toward a unified nomenclature for mammalian ADP-ribosyltransferases[J].Trends Biochem.Sci,2010,35(4):208-219.
[3]Min W, Wang ZQ.Poly(ADP-ribose)glycohydrolase(PARG)and its therapeutic potential[J].Front Biosci,2009,14:1619-1626.
[4]Delaney CA,Wang LZ,Kyle S,et al.Potentiation of temozolomide and topotecan growth inhibition and cytotoxicity by novel poly(adenosine diphosphoribose)polymerase inhibitors in a panel of human tumor cell lines[J].Clin Cancer Res,2000,6(7):2860-2867.
[5]Miknyoczki SJ,Jones-Bolin S,Pritchard S,et al.Chemopotentiation of temozolomide,irinotecan,and cisplatin activity by CEP-6800,apoly(ADP-ribose)polymerase inhibitor[J].Mol Cancer Ther,2003,2(4):371-382.
[6]林玲,林晓,王娅兰.大肠癌组织中PARG与血管生成相关因子的关系[J].吉林大学学报:医学版,2010,36(3):339-442.
[7]李巧转,王娅兰,李娴.大肠癌细胞PARG、PARP与AKT磷酸化状态的关系[J].重庆医科大学学报,2010,35(3):321-323.
[8]Lin L,Li J,Wang YL,et al.Relationship of PARG with PARP,VEGF and b-FGF in colorectal carcinoma[J].Chin J CancerRes,2009,21(2):135-141.
[9]吴伟强,王娅兰,潘娟,等.PARG基因沉默抑制小鼠结肠癌CT26细胞系体外淋巴管形成[J].基础医学与临床,2011,31(6):625-629.
[10]Liu HY,Huang ZL,Yang GH,et al.Inhibitory effect of modified citrus pectin on liver metastases in a mouse colon cancer model.[J].World J Gastroenterol,2008,14(48):7386-7391.
[11]Huang W,Wu YL,Zhong J,et al.Angiotensin II type receptor antagonist suppress angiogenesis and growth of gastric cancer xenografts[J].Dig Dis Sci,2008,53(5):1206-1210.
[12]Davidovic L,Vodenicharov M,Affar EB,et al.Importance of poly(ADP-ribose)glycohydrolase in the control of poly(ADP-ribose)metabolism[J].Exp Cell Res,2001,268(1):7-13.
[13]Tikoo K,Bhatt DK,Gaikwad AB,et al.Differential effects of tannic acid on cis-platin induced nephrotoxicity in rats[J].FEBS Lett,2007,581(10):2027-2035.
[14]Sakamoto-Hojo ET,Balajee AS.Targeting poly (ADP)ribose polymerase I(PARP-1)and PARP-1interacting proteins for cancer treatment[J].Anticancer Agents Med Chem,2008,8(4):402-416.
[15]蔡莉,王娅兰,林晓.PARP抑制剂5AIQ对小鼠结肠癌CT26细胞PARP/NF-kB复合物和NF-kB活性的影响[J].基础医学与临床,2008,28(11):1156-1159.
[16]Min W,Cortes U,Herceg Z,et al.Deletion of the nuclear isoform of poly(ADP-ribose)glycohydrolase (PARG)reveals its function in DNA repair,genomic stability and tumorigenesis[J].Carcinogenesis,2010,31 (12):.2058-2065.
[17]Nakajima H,Nagaso H,Kakui N,et al.Critical role of the automodification of poly(ADP-ribose)polymerase-1in nuclear factor-kappaB dependent gene expression in primary cultured mouse glial cells [J].J Biol Chem,2004,279(41):42774-42786.
[18]Veres B,Radnai B,Gallyas F,et al.Regulation of kinase cascades and transcription factors by apoly(ADP-Ribose)polymerase-1inhibitor,4-hydroxyquinazoline,in lipopolysaccharideinduced inflammation in mice[J].Pharmacol Exp Ther,2004,310(1):247-255.
[19]颜佳欣,王娅兰,吴伟强.shRNA干扰PARG对大肠癌CT26细胞粘附因子表达的影响[J].重庆医科大学学报,2011,36(6):641-645.
[20]郑江华.血液中血管内皮生长因子和肿瘤的研究进展[J].中国普通外科杂志,2004,13(1):50-52.
[21]秦艳芳,向军俭,杨红宇.碱性成纤维细胞生长因子与肿瘤[J].国外医学肿瘤学分册,2001,28(4):256-259.
[22]Gasparini G,Toi M,Biganzoli E,et al.Thrombospondin21 and 22in node2negative breast cancer:Correlation with angiogenic factors,p53,cathepsin D,hormone receptors and prognosis[J].Oncology,2001,60(1):72-80.

