CA125、超声检查及恶性风险指数(RMI)对绝经后妇女卵巢肿瘤的诊断价值
梁 爽 任芸芸 李笑天
(复旦大学附属妇产科医院妇产科 上海 200011)
卵巢癌在妇科恶性肿瘤中发病率居第3位,死亡率则居首位,且绝大多数患者发病年龄>40岁,并随着年龄的增长呈递增趋势。由于其起病隐匿,临床表现缺乏特异性,故缺少早期诊断方法。因此,卵巢肿瘤尤其是绝经后妇女卵巢肿瘤已成为威胁妇女生命健康的重要危险因素。
目前,关于卵巢肿瘤的早期诊断及术前评估包括超声检查、血清学肿瘤标志物CA125的检测。近年来,有学者提出由绝经状态评分、超声检查评分和血清CA125测定值组成的简单回归方程——恶性风险指数(risk of malignancy index,RMI)。已有研究表明[1],RMI对卵巢肿瘤的临床诊断性能优于单项超声检查及CA125。但对于卵巢肿瘤,尤其绝经后妇女的卵巢肿瘤仍没有一种良好的临床诊断手段。本文将就CA125、超声检查、RMI-3及 RMI-4对于绝经后妇女卵巢肿瘤的临床诊断性能进行研究,探讨一种较为理想的预测指标,以鉴别卵巢肿瘤的良恶性,提高诊断性能。
资料和方法
研究对象 2008年1月至2010年2月本院病房手术治疗的绝经后卵巢肿瘤患者186例。所有患者术前均接受过腹部或经阴道超声检查,5例患者未接受血清CA125检测(未进入与CA125有关的统计)。入选标准:(1)闭经≥1年或年龄超过50岁的子宫切除术史者;(2)原发性肿瘤;(3)未进行放、化疗;(4)无其他恶性肿瘤;(5)术后均经病理学检查确诊。临床分期按FIGO标准,组织学分类按WHO标准。术后病理证实良病变95例,包括:浆液性瘤18例、黏液性瘤25例、勃勒纳瘤4例、黏液性瘤伴浆液性瘤1例、畸胎瘤30例、甲状腺肿1例、卵泡膜纤维瘤5例、卵泡膜细胞瘤3例、纤维瘤7例、肌腺瘤1例。恶性病变91例,包括:浆液性癌66例、子宫内膜样癌6例、透明细胞癌3例、黑色素细胞瘤1例,横纹肌肉瘤1例,绒癌1例,浸润性鳞状细胞瘤1例,颗粒细胞瘤2例、癌肉瘤2例。交界性肿瘤8例。由于交界性肿瘤具有低度恶性潜能,术前、术中及术后均需高度警惕,因此根据参考文献[2]将其归为恶性组(表1)。
表1 绝经后妇女卵巢肿瘤的临床特征Tab1 Clinical features of ovarian cancer in postmenopausal women ()

表1 绝经后妇女卵巢肿瘤的临床特征Tab1 Clinical features of ovarian cancer in postmenopausal women ()
研究方法 血清CA125的检测采用化学发光法。CA125>35 kU/L定义为阳性。超声检查包括5项指标:(1)病灶实质性。(2)是否双侧。(3)有无多房结构。(4)有无腹水。(5)有无转移灶。每项为1分进行评分,各项分数之和为其形态学总分,同时记录肿块最长径。超声评分≥2分定义为阳性。RMI的计算方法:RMI-3=U×M×CA125(U为超声评分,M为月经状态评分):(1)超声得分≤1时,U=1;超声得分≧2时,U=3。(2)M=3。(3)血清CA125数值直接代入公式。RMI-4=U×M×CA125×S:(1)超声得分≤1时,U=1;超声得分≧2时,U=4。(2)M=4。(3)血清CA125数值直接代入公式。(4)肿块最长径<7 cm时,S=1;肿块最长径≧7 cm时,S=2。界值确定:根据文献[3],RMI-3以 200为界值,RMI-4以450为界值。
统计学方法 选用SPSS 16.0统计软件,计数资料采用χ2检验,计量资料采用t检验,以P<0.05为差异有统计学意义。
结 果
各指标与病理检查结果关系 CA125、超声评分、RMI-3、RMI-4对卵巢肿瘤良恶性的检出率差异均有统计学意义 (P=0.00,表2)。
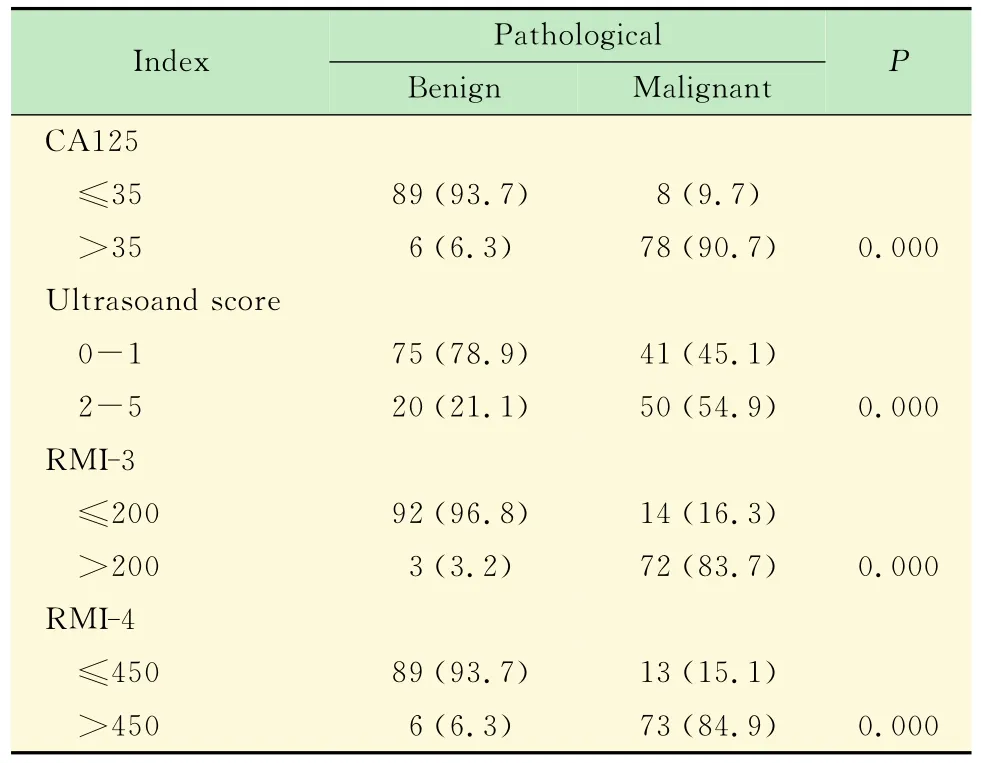
表2 各指标与病理检查结果关系Tab2 The relationship between indicators and pathological results [n (%)]
各指标对卵巢肿块诊断性能的ROC曲线CA125、超声评分、RMI-3、RMI-4的 ROC曲线下面积分别为:0.94、0.71、0.93、0.91(图1)。
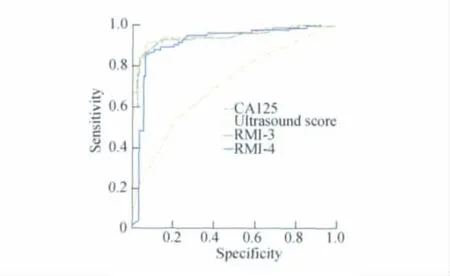
图1 4种指标的ROC曲线Fig1 ROC curves of 4index
各指标对卵巢肿块良恶性诊断性能的比较CA125、超声评分与 RMI-3、RMI-4的敏感性、特异性和YI 4种指标对卵巢肿瘤良恶性的诊断效能两两相比差异均有统计学意义(P=0.00,表3)。
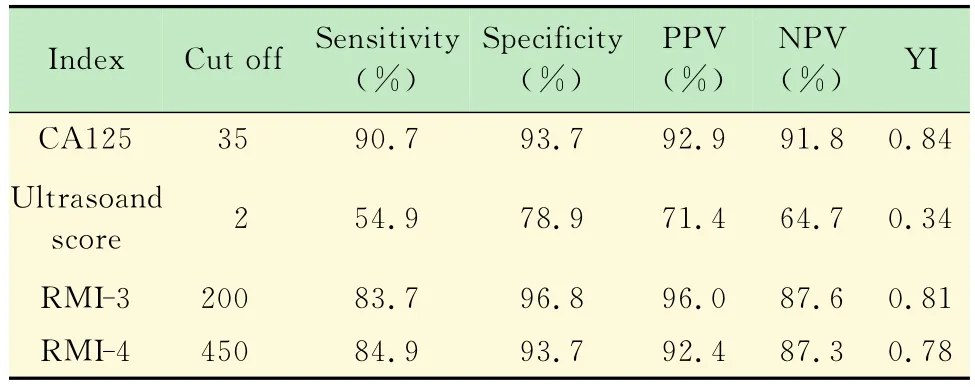
表3 各指标对卵巢肿块良恶性诊断性能的比较Tab3 Performance of index in the diagnosis of benign and malignant ovarian tumors
各指标对不同病理类型卵巢肿瘤的误诊率及漏诊率 在所有恶性病变中,CA125造成的8例假阴性病例中,上皮性癌3例,交界性癌4例,横纹肌肉瘤1例。超声评分造成的41例假阴性病例中,上皮性癌占30例,黑色素细胞瘤1例,浸润性鳞状细胞瘤1例,绒癌1例,颗粒细胞瘤1例,横纹肌肉瘤1例,交界性肿瘤6例。RMI-3造成的14例假阴性病例中,上皮性癌9例,交界性肿瘤4例,横纹肌肉瘤1例。RMI-4造成的10例假阴性病例中,上皮性癌9例,横纹肌肉瘤1例(表4)。在所有良性病变中,各指标对良性性索间质肿瘤的误诊率最高(表5)。
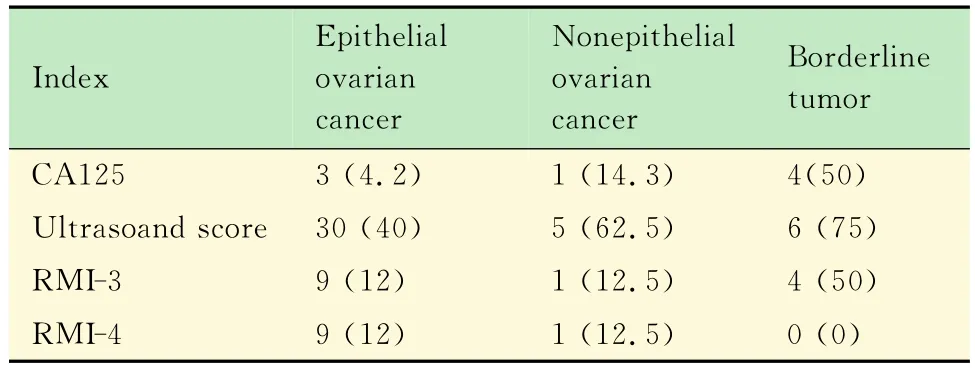
表4 各指标对不同病理类型卵巢恶性肿瘤的漏诊率Tab4 The rate of missed diagnosis of different pathological malignant adnexal mass using the 4index [n(%)]
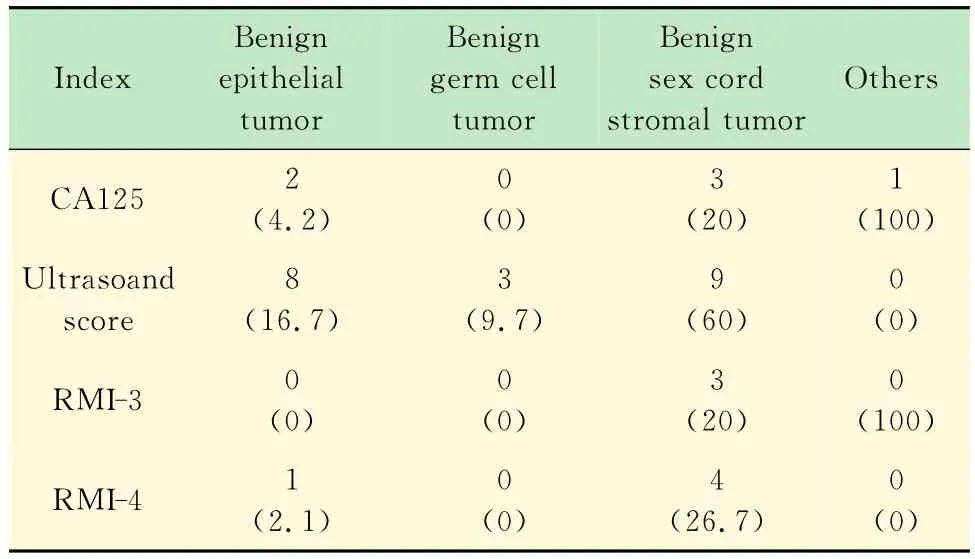
表5 各指标对不同病例病理类型良性肿块的误诊率Tab5 The rate of misdiagnosis of different pathological malignant adnexal mass using the 4index [n(%)]
讨 论
Jacobs等[4]在1990年首次提出了结合绝经状态、超声检查和血清CA125的恶性风险指数1(RMI-1)评分系统,后经2次改良,在1999年发展为 RMI-3评分系统[5]。2009年 Yamamoto等[4]在原有基础上加入了肿块最长直径最为第四项指标,提出了RMI-4。RMI克服了单一因素所致的假阳性和假阴性,提高了对卵巢恶性肿瘤术前诊断的特异性与敏感性,为卵巢肿物的诊断提供了另一新的方法。国外文献[6-7]报道,通过RMI判断附件肿块良恶性的敏感性为71%~85%、特异性为83%~91%,本研究 RMI-3及RMI-4的敏感性、特异性及YI指数分别为83.7%、96.8%、0.81和84.9%、93.7%、0.78,与国外研究基本一致。本组资料显示,良恶性组间RMI-3及RMI-4的检出率差异有统计学意义,其敏感性大于单项超声评分,但小于CA125,这与国外报道[1]RMI的诊断效能优于单项指标不一致。分析其中原因:其一,本组资料入选病例均为绝经后卵巢肿瘤,该人群中恶性上皮性肿瘤发病率较高。且在分析样本构成时笔者发现,本组资料中浆液性恶性肿瘤占卵巢恶性肿瘤的比例较高,为72.5%,与李艳娜等[8]报道一致。上皮恶性肿瘤血清CA125水平远远较非上皮恶性肿瘤和交界性肿瘤高,尤其是浆液性恶性肿瘤。因此,在绝经后妇女卵巢肿瘤的鉴别方面,由于恶性浆液性肿瘤的特殊性,CA125的重要性是否更大,值得进一步研究探讨。其二,RMI在统计学方法本身的某些局限性和评分系统中各指标的不足,可能导致CA125单项指标在绝经后妇女卵巢肿瘤的重要性被超声评分等减弱,进一步导致RMI整体预测能力降低。本组资料显示,CA125造成的8例假阴性病例中上皮性癌3例;RMI-3造成的14例假阴性病例中,上皮性癌9例;RMI-4造成的10例假阴性病例中,上皮性癌9例。提示2种RMI漏诊率最高的为上皮性肿瘤,而CA125对上皮性肿瘤的漏诊率则相对较低。这也证明了可能由于RMI的设计上未充分重视CA125的重要性,导致了2种RMI对上皮性肿瘤的漏诊率偏高。因此,RMI可以在原来设计的基础上适当调整各部分比例或者增加新的有意义的肿瘤标记物,并结合临床内分泌特征及遗传、环境易感因素等方面去改进计算方法,且有必要扩大样本进一步比较。
2种RMI在临床应用时存在一定的假阳性率。本研究发现,2种RMI在推荐界值下,对卵巢良性肿瘤发生假阳性的最主要原因是性索间质肿瘤,这部分病例多数发生囊性变,超声表现为多房囊实性结构,致超声评分升高,进一步导致RMI假阳性。提示当超声表现为多房囊实性结构时,要结合CA 125等指标,鉴别良性性索间质肿瘤与恶性肿瘤。
总之,鉴于绝经后卵巢肿瘤CA125的特殊性,有必要重新评估其在RMI中的重要性。RMI尚有一定的改良空间,可纳入新的元素,并扩大样本进一步比较,以提高其对绝经后卵巢肿瘤的诊断性能。
[1]Leelahakorn S,Tangjitgamol S,Manusiri-Vithaya S.Comparison of ultrasound score,CA125,menopausal status,and risk of malignancy index in differentiating between benign and borderline or malignant ovarian tumors[J].J Med Assoc Thai,2005,88 (Suppl 2):S22-S30.
[2]Ulusoy S,Akbayir O,Numanoglu C,et al.The risk of malignancy index in discrimination of adnexal masses[J].Int J Gynaecol Obstet,2007,96(3):186-191.
[3]Yamamoto Y,Yamada R,Oguri H,et al.Comparison of four malignancy risk indices in the preoperative evaluation of patients with pelvic masses[J].Eur J Obstet Gynecol Reprod Biol,2009,144(2):163-167.
[4]Jacobs I,Oram D,Fairbanks J,et al.A risk of malignancy index incorporating CA125,ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer[J].Br J Obstet Gynaecol,1990,97(10):922-929.
[5]Tingulstad S,Hagen B,Skjeldestad FE,et al.The risk-ofmalignancy index to evaluate potential ovarian cancers in local hospitals[J].Obstet Gynecol,1999,93(3):448-452.
[6]Geomini P,Kruitwagen R,Bremer GL,et al.The accuracy of risk scores in predicting ovarian malignancy:a systematic review[J].Obstet Gynecol,2009,113(2 Pt 1):384-394.
[7]Enakpene CA,Omigbodun AO,Goecke TW,et al.Preoperative evaluation and triage of women with suspicious adnexal masses using risk of malignancy index[J].J Obstet Gynaecol Res,2009,35(1):131-138.
[8]李艳娜,张军,李斌.148例绝经后卵巢肿瘤的临床分析[J].中华实用诊断与治疗杂志,2009;23(6):560-562.

