受体骨髓源性内皮祖细胞(EPC)对小鼠移植性动脉硬化的影响
杨兆华 洪 涛 朱仕杰 夏利民 王春生
(复旦大学附属中山医院心外科 上海 200032)
移植性动脉硬化是器官移植术后主要的远期并发症之一,常导致移植器官功能丧失而影响受体长期存活。当前,移植性动脉硬化的发病机制仍不明确,临床上也缺乏行之有效的治疗方法。内皮祖细胞(endothelial progenitor cell,EPC)由于具有潜在的血管损伤修复功能并在多种心血管疾病发病过程中发挥重要作用,正越来越受到研究者的重视[1-2]。近年来的多项研究证实,EPC同样参与移植性动脉硬化的发病过程[3-4]。本课题组在前期的研究中发现:移植性动脉硬化发病与外周血中EPC的数量明显减少密切相关[5]。但是,通过增加EPC数量是否可以减轻移植动脉内膜增生从而防治移植性动脉硬化,目前尚未见文献报道。因此,本实验取受体同品系小鼠骨髓单个核细胞(mononuclear cell,MNC)经体外诱导培养EPC,并输入小鼠移植性动脉硬化模型体内,旨在观察EPC对移植动脉内膜损伤修复及内膜增生的影响,进一步探讨移植性动脉硬化可能的发病机制。
材料和方法
实验动物 C57BL/6小鼠及BALB/c小鼠,雄性,体重20~25g,由复旦大学实验动物科学部提供。
实验试剂及器材 M199培养液、胎牛血清、胰蛋白酶(美国Gibco公司);小鼠淋巴细胞分离液(Ficoll液,Histopaque-1083,美国Sigma公司);人纤维连接蛋白(natural human fibronectin,美国Biosource/Invitrogen公司);重组小鼠血管内皮生长 因 子-165(vascular endothelial growth factor-165,VEGF-165,美国 Peprotech公司);DiI标记的乙酰化低密度脂蛋白(DiI-ac-LDL,美国 Molecular Probe公司);FITC标记的荆豆凝集素 (FITCUEA-1,德国Vector公司);兔抗小鼠vWf单克隆抗体、兔抗小鼠Flk-1单克隆抗体以及免疫荧光通用SABC试剂盒(武汉博士德公司);Evans blue染料(美国Sigma公司);Leica Qwin图像分析系统(德国Leica公司)。
实验方法
小鼠骨髓EPCs的分离、培养 无菌条件下取BALB/c小鼠双侧股骨,PBS冲洗骨髓腔收集细胞悬液。Ficoll密度梯度离心法收集白膜层的MNC,用M199培养液(含20%胎牛血清及20ng/mL VEGF)将其重悬后接种于包被纤连蛋白的6孔培养板中,然后置于含5%CO2的培养箱培养。72h后,用PBS洗去非贴壁细胞,更换培养液继续培养;此后,培养细胞每隔3天更换1次培养液。
DiI-ac-LDL摄取和 FITC-UEA-1结合荧光双染法鉴定EPC 将培养7天的贴壁细胞在含DiI-ac-LDL(10μg/mL)的 M199培养液中避光孵育4h,然后以1%多聚甲醛固定细胞膜蛋白10min;PBS漂洗2次后,再加FITC-UEA-1(10μg/mL)孵育1h,最后用DAPI对细胞核进行染色。荧光显微镜下显示蓝色荧光为细胞核;红色荧光为吞噬DiI-ac-LDL的细胞;绿色荧光为UEA-1染色阳性细胞;黄色荧光为UEA-1和ac-LDL双染色阳性细胞,可认为是正在分化的EPC。
免疫荧光染色鉴定EPC细胞表面标记Flk-1、vWf表达 免疫荧光染色操作步骤完全按照免疫荧光SABC检测试剂盒操作说明书进行。为排除假阳性结果,PBS代替一抗设阴性对照。
小鼠腹主动脉移植模型的建立 以C57BL/6小鼠为供体,BALB/c小鼠为受体建立小鼠同种异体腹主动脉移植模型。首先,供体小鼠以1%戊巴比妥钠(50mg/kg)腹腔内注射麻醉后,固定于手术板上,正中开腹并切取肾动脉水平至髂动脉起始水平腹主动脉(长约7mm)作为供体血管。然后,同样方法将受体小鼠麻醉,固定四肢并正中开腹,钝性分离后腹膜以暴露腹主动脉。以9-0丝线打活结分别在肾动脉水平及腹主动脉髂动脉分叉水平将腹主动脉阻断,切除两结扎线间的腹主动脉。用11-0血管缝线以端端间断吻合方式将供体腹主动脉原位移植于受体小鼠。缝合完毕后,松开血管上下阻断线,待吻合口无渗血、移植血管通畅后关腹。小鼠一般术后30min苏醒并可以自由活动。若小鼠动脉移植术后48h内出现双下肢瘫痪者,表明移植动脉管腔内或吻合口有血栓形成,视为手术失败,排除实验之外。
EPC细胞移植 细胞培养至第7天,经0.25%胰酶消化、离心后重悬于PBS中,调整细胞浓度为1×107/500μL备用。小鼠腹主动脉移植术后用随机数字法将其分为两组:A组为对照组(n=18),分别在模型完成后即刻、术后24h、48h依次通过尾静脉注入500μL生理盐水;B组为EPC输入组(n=18),分别在上述3个时间点通过尾静脉依次输入1×107个EPCs。
扫描电镜观察 术后2周,A组和B组随机各取2只小鼠处死,取出移植腹主动脉,生理盐水冲洗管腔后,纵形剖开血管,置入2.5%(质量分数)戊二醛中固定24h,再行梯度酒精脱水、醋酸异戊酯置换,临界干燥、黏脱和镀膜,在扫描电镜下观察。
Evans blue染色观察移植血管内皮覆盖情况 移植术后2周,A组、B组各取8只,经尾静脉注射浓度为1%(质量比)的Evans blue(25mg/kg)。30 min后处死取出移植动脉,在生理盐水中漂洗后,纵形剖开血管,平铺,暴露内膜面,置于显微镜下观察并拍照。内皮覆盖部分不被Evans blue着染,内皮剥脱部分可被Evans blue染成蓝色,并通过计算机图像分析软件(Imgae-proplus 6.0)测定内皮总面积和内皮覆盖面积。计算内皮覆盖面积与总面积之比,即内皮覆盖率。
移植动脉病理学观察及形态学分析 术后4周,A组和B组各取8只小鼠处死,开胸做左心室插管,经生理压下灌注适量肝素生理盐水冲洗并用4%(v/v)多聚甲醛作血管原位固定,开腹取出移植动脉。将动脉经HE染色及弹力纤维染色后,置于光学显微镜下观察、拍照,并将结果输入Leica Qwin图像分析系统,分别测量移植动脉管腔面积和内膜层面积。用血管狭窄率来反映移植动脉的内膜增生情况。血管狭窄率=内膜面积/(内膜面积+管腔面积)×100%。
结 果
骨髓EPC的培养与鉴定 新分离的骨髓MNCs显微镜下呈圆形,大小不一,胞体透亮,折光性好,悬浮于培养液中。培养72h,换液去除未贴壁细胞,见贴壁细胞体积增大呈纺锤形或椭圆形。培养至7天,贴壁细胞呈梭形,部分细胞变长呈线条状。用 DiI-ac-LDL摄取和 FITC-UEA-1结合荧光双染法对培养7天细胞进行鉴定,结果显示:绿色荧光细胞为FITC-UEA-1结合阳性细胞(图1A),红色荧光细胞为DiI-ac-LDL摄取阳性细胞(图1B),黄色荧光细胞为 DiI-ac-LDL和 FITC-UEA-1双染色阳性细胞,被认为是正在分化的EPC(图1C)。蓝色荧光为DAPI染色的细胞核,以此数量计算细胞总数。根据黄色荧光阳性细胞数量与细胞总数的比例,计算出EPC阳性率接近90%。用免疫荧光染色方法对细胞表面标记Flk-1及vWf表达情况进行检测,结果显示:阴性对照组则未见绿色荧光(图1D),染色阳性细胞发绿色荧光为免疫荧光,显示部位为胞质和细胞膜,分别表达Flk-1(图1E)、vWf因子(图1F)相关抗原。
EPC对移植腹主动脉内膜损伤修复的影响 扫描电镜结果 A组术后2周,内皮细胞覆盖不完整,呈虫蛀样改变,严重部位内皮细胞部分缺失,内膜下组织显露,并有炎症细胞和红细胞黏附(图2A);B组内皮细胞覆盖程度显著低于A组,部分区域内皮细胞呈片状脱落,细胞间隙增宽,可见内皮缺失部位有梭形细胞黏附、覆盖,伴有炎症细胞浸润(图2B)。
Evans blue染色 注入Evans blue染液后,正常内皮细胞无损伤的腹主动脉内膜不被染色(即呈白色,图3A),而内皮细胞有损伤的血管内膜则被染成蓝色(图3B、3C)。通过计算机图像分析软件对Evans blue染色后的血管内膜面积进行测定,结果显示:A组内皮覆盖率60.57%±5.23%和B组的内皮覆盖率46.03%±9.09%均显著低于正常对照(100%,P<0.01)。其中,B组与 A组比较,内皮覆盖率明显降低(P<0.01)。
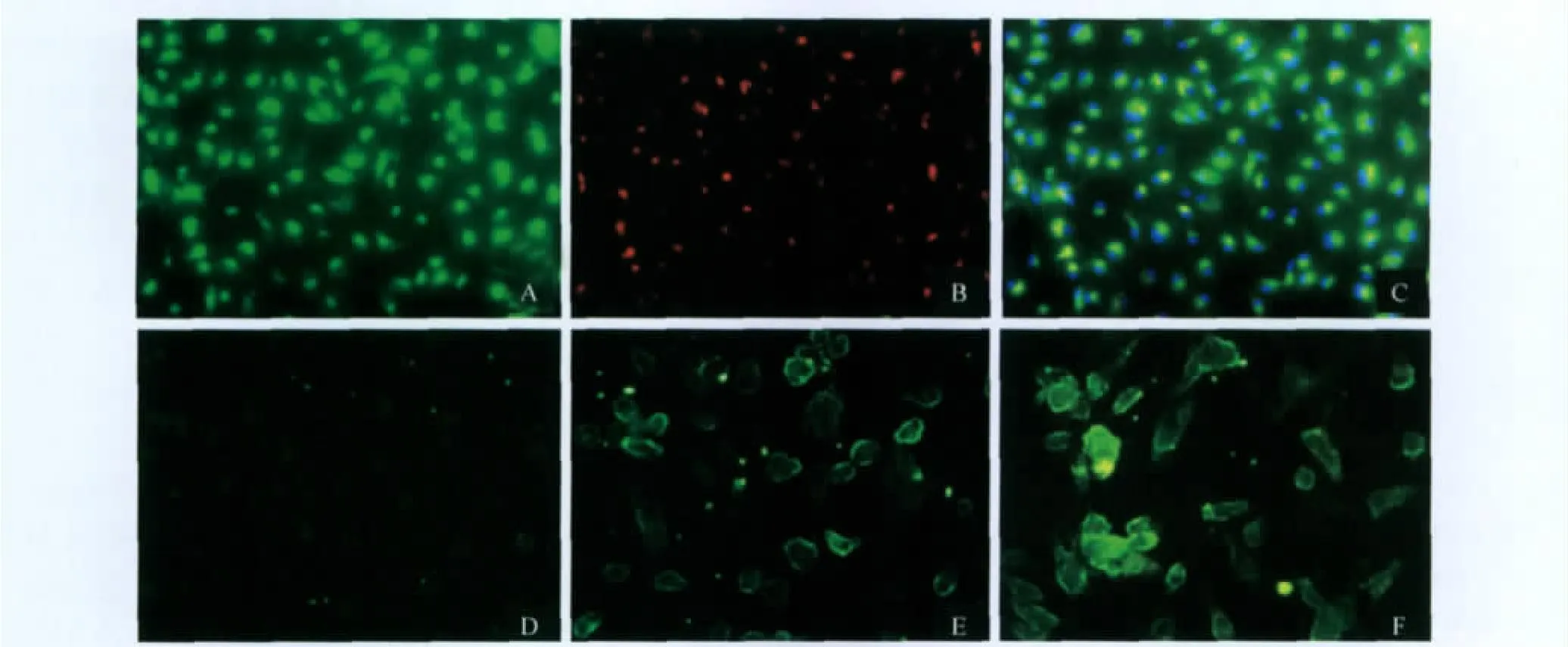
图1 小鼠骨髓源性MNC的EPC特性鉴定Fig1 Bone marrow-derived MNCs differentiated from cells with EPC,s characteristics in mice
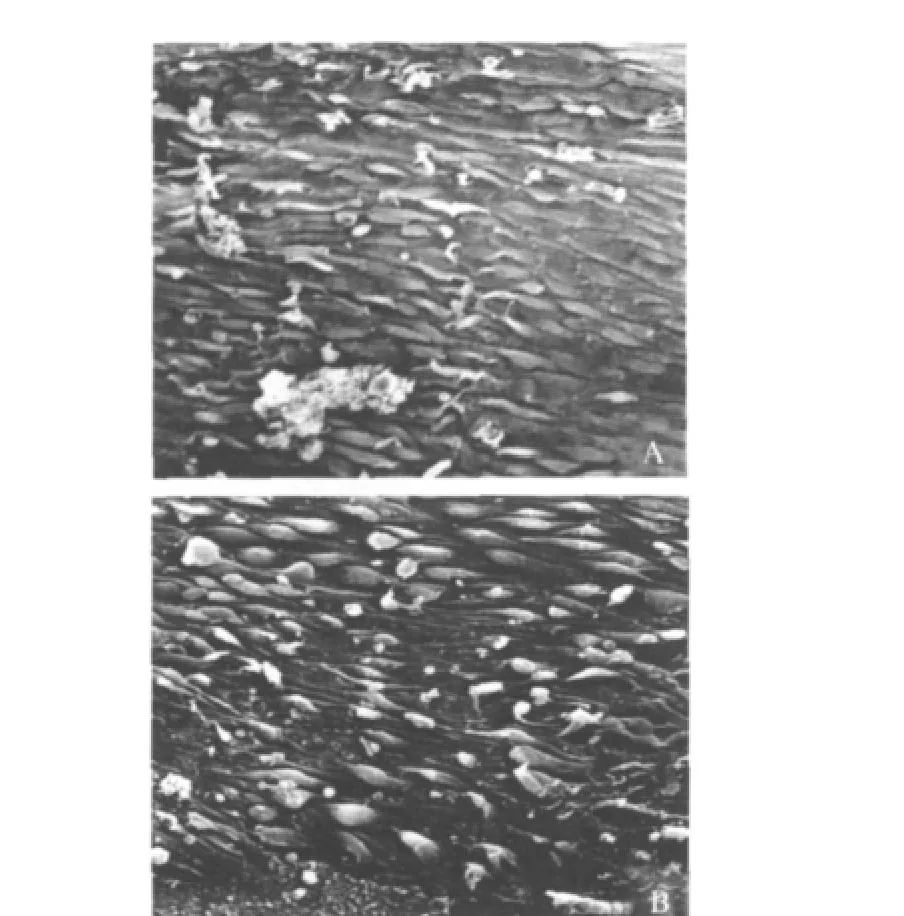
图2 小鼠移植动脉术后2周扫描电镜照片(×300)Fig2 Scanning electron microscopy findings of mouse aortic grafts 2weeks after surgery(×300)
EPC移植对移植动脉新生内膜形成的影响移植术后4周小鼠腹主动脉切片经HE染色及弹力纤维染色后置光镜下观察,A组移植动脉管壁明显增厚,其中以内膜增厚为主,血管管腔面积减少,血管中膜和外膜厚度则无明显变化,外膜有大量的炎症细胞浸润,局部炎症反应明显(图4A、4B)。B组移植动脉内膜增厚更加明显,管腔面积较A组显著减少(图4C、4D)。B组移植动脉狭窄率(57.1±4.69)%与A组(36.3±3.16)%比较有明显增高,差异有统计学意义(P<0.05)。

图3 小鼠移植动脉术后2周Evans blue染色Fig3 Evans blue staining of vascular endothelial cells in mouse aortic graft 2weeks after surgery
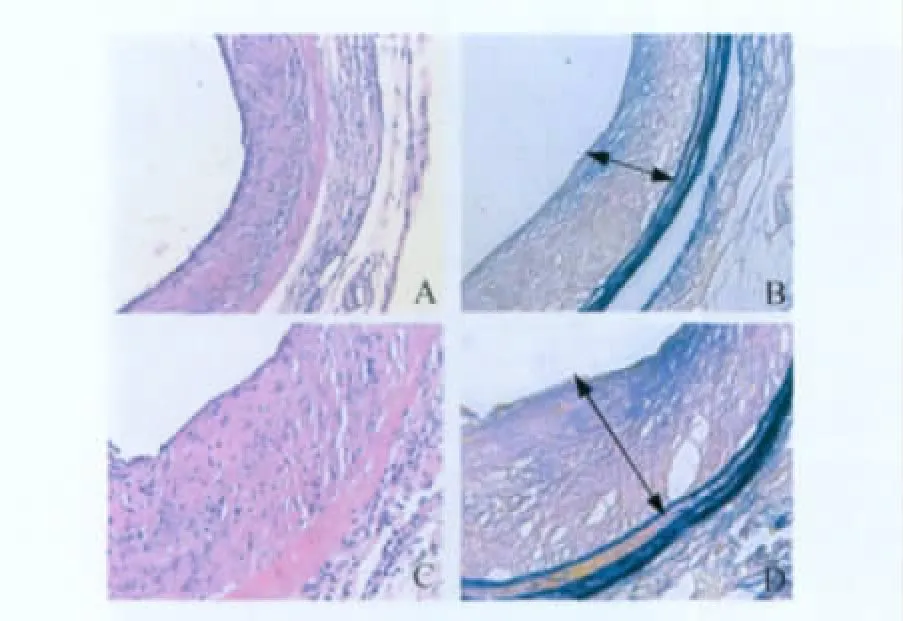
图4 小鼠移植动脉术后4周病理改变(×200)Fig4 The pathological changes of mouse aortic grafts under optical microscope 4weeks after surgery(×200)
讨 论
移植性动脉硬化是慢性排斥反应的主要病理学特征,也是目前导致移植物丧失功能的主要原因。然而,关于移植性动脉硬化确切的发病机制仍未阐明。一般认为,移植性动脉硬化主要是由免疫因素引起,多种非免疫因素共同作用造成血管内膜反复损伤,邻近损伤部位的内皮细胞和血管中层平滑肌细胞对损伤的过度修复所致。然而,近年来越来越多的研究文献证实:受体循环池中的EPC也参与移植性动脉硬化病变过程[6-8],但具体作用仍不清楚。
本课题组前期的研究结果显示:移植性动脉硬化病变过程中外周血EPC数量明显减少,提示移植性动脉硬化的发病与外周血EPC的数量变化具有一定相关性[4]。临床研究也发现,移植性冠状动脉硬化患者外周血EPC数量显著降低[8]。Hutter等[9]研究结果表明,当EPC数量不足使血管机械性损伤后内膜再内皮化延迟,导致血管新生内膜形成、管腔发生再狭窄。通过增加EPC数量可以促进再内皮化,减轻血管内膜增生。那么,在移植性动脉硬化发病过程中,增加EPC数量能否抑制移植动脉内膜增生,减轻移植性动脉硬化?为了验证上述的假设,本研究通过建立同种异品系小鼠腹主动脉移植模型,将体外扩增培养的EPC(与受体同品系)输入到模型体内,观察EPC对移植血管内膜损伤后再内皮化及新生内膜形成的影响。
国外文献报道,骨髓、脐血、外周血及脾脏均可培养出EPC[1-2]。由于骨髓中含有丰富的成体干细胞资源,其干细胞或前体细胞的含量远远高于外周血,且取材方便。因此,本实验将骨髓作为培养EPC的主要来源。结果显示:小鼠骨髓单个核细胞在含有VEGF的M199培养基中培养7天后,能够获得形态呈梭形的内皮样贴壁细胞,并具有内皮细胞的 功 能:能 够 吞 噬 DiI-ac-LDL 和 结 合 FITCUEA-1,同时还表达内皮细胞标志 Flk-1和vWf。证实了培养的细胞为EPC。
将EPC输入小鼠移植性动脉硬化模型2周后,扫描电镜显示:与手术对照组比较,输入EPC非但没有促进损伤血管内膜再内皮化,反而进一步加重内膜损伤。进一步通过对血管内膜进行Evans blue染色,结果也发现:EPC输入组移植动脉血管内皮覆盖率明显低于手术对照组。上述结果充分表明,增加受体来源的EPC数量并不能修复损伤内膜,反而进一步加重内皮细胞的损伤。Raemer等[10]通过研究发现,EPC在一定条件下可表现出与单核细胞相似的特性,不但具有很强的抗原处理、递呈功能,而且还可刺激T淋巴细胞分化和增殖。Lagaaij等[11]通过研究也证实,受体来源的内皮细胞可参与对移植物的排斥反应。因此,结合本研究的结果,可以认为其主要原因可能与EPC参与了受体对移植血管的免疫排斥反应,加重受体对移植动脉内膜的损伤有关。
通过对移植术后4周小鼠腹主动脉进行病理形态学分析发现,手术对照组移植动脉硬化明显,表现为管壁厚度明显增加,其中主要以内膜增厚为主,血管内外膜有大量炎症细胞浸润,基本符合临床移植性动脉硬化的病理改变特点。EPC输入组与对照组相比,新生内膜厚度明显增加,血管狭窄率显著提高,表明通过增加循环中EPC的数量,非但没有抑制或减轻移植动脉新生内膜形成,反而促进移植动脉内膜增生,提示受体源性EPC对移植性动脉硬化病变起促进作用。
上述的研究表明,移植性动脉硬化的发生并非与EPC数量不足、损伤血管内膜再内皮化延迟有关。相反,EPC通过参与或加强了受体对移植血管的免疫排斥损伤,对移植性动脉硬化病变起促进作用。因此,通过动员受体骨髓EPC或输入体外扩增的EPC,对于防治移植性动脉硬化并无益处。以EPC为干预靶点,通过减少EPC数量或抑制其生物学功能,可能成为今后防治移植性动脉硬化的一条新途径。
[1]Brandes RP,Ushio-Fukai M.Endothelial progenitor cells(EPC)elemental pernicious complexity [J].Antioxid Redox Signal,2011,15(4):911-914.
[2]Ramcharan KS,Lip GY,Stonelake PS,et al.The endotheliome:a new concept in vascular biology [J].Thromb Res,2011,128(1):1-7.
[3]Thomas HE,Parry G,Dark JH,et al.Circulating endothelial progenitor cell numbers are not associated with donor organ age or allograft vasculopathy in cardiac transplant recipients [J].Atherosclerosis,2009,202(2):612-616.
[4]Xu Q.Stem cells and transplant arteriosclerosis[J].Circ Res,2008,102(9):1011-1024.
[5]杨兆华,洪涛,朱仕杰,等.腹主动脉移植后小鼠外周血内皮祖细胞数量的动态变化及意义[J].中华器官移植杂志,2011,32(4):231-234.
[6]Hillebrands JL,Onuta G,Rozing J.Role of progenitor cells in transplant arteriosclerosis[J].Trends Cardiovasc Med,2005,15(1):1-8.
[7]Sathya CJ,Sheshgiri R,Prodger J,et al.Correlation between circulating endothelial progenitor cell function and allograft rejection in heart transplant patients[J].Transpl Int,2010,23(6):641-648.
[8]Mitchell RN,Libby P.Vascular remodeling in transplant vasculopathy[J].Circ Res,2007,100(7):967-978.
[9]Hutter R,Carrick FE,Valdiviezo C,et al.Vascular endothelial growth factor regulates reendothelialization and neointima formation in a mouse model of arterial injury[J].Circulation,2004,110(16):2430-2435.
[10]Raemer PC,Haemmerling S,Giese T,et al.Endothelial progenitor cells possess monocyte-like antigen-presenting and T-cell-co-stimulatory capacity [J].Transplantation,2009,87(3):340-349.
[11]Lagaaij EL,Cramer-Knijnenburg GF,van Kemenade FJ,et al.Endothelial cell chimerism after renal transplan-tation and vascular rejection [J].Lancet,2001,357(9249):33-37.

