溃克灵加减方对TNBS结肠炎模型大鼠IGF-1、TGF-β1、CTGF表达的影响
许 佳,于成功
(南京中医药大学中西医结合鼓楼临床学院,江苏 南京 210008)
炎症性肠病(inflammatory bowel disease,IBD)是一种以持续的肠黏膜损害和增殖性炎症改变为特点的疾病,致纤维化因子分泌增加刺激细胞不断增殖、分化,导致胶原沉积在肠壁上而发生纤维化。中药溃克灵对结肠炎模型大鼠有一定的预防和保护作用[1],已于临床应用,治疗IBD效果显著。本研究通过建立TNBS诱发的实验性结肠炎大鼠模型,观察溃克灵加减方对结肠炎模型大鼠肠道胶原沉积的影响,初步探讨其抗IBD肠壁纤维化的可能机制。
1 材料与方法
1.1 实验动物 SD大鼠40只,雄性,6~8周龄,体质量(180±20)g,购自南京江宁区青龙山动物繁殖场,饲养于南京鼓楼医院动物模式中心二级动物房。
1.2 药品和试剂 药品:KKL由猴头菌、半枝莲、败酱草、马齿苋、白芍、槐花、厚朴、土茯苓等按特定剂量比例组成,为南京市鼓楼医院消化科课题组原创组方,MKKL加减方由原方减去马齿苋、土茯苓、半枝莲等药味,加入丹参、九香虫和炙甘草化裁而来。中药制剂购自江阴天江药业有限公司,95 ℃水浴浓缩(KKL中使每毫升含原药材0.667 g,MKKL中使每毫升含原药材0.608 g)。药物制成后,高压灭菌消毒分装,4 ℃冰箱保存备用。TNBS(产品编号:P2297)购自美国Sigma公司。试剂:Masson三色染色试剂盒购于南京凯基生物科技有限公司(产品编号:KGMST-8003),兔抗大鼠IGF-1多克隆抗体、兔抗大鼠TGF-β1多克隆抗体和山羊抗大鼠CTGF多克隆抗体购自Santa Cruz公司(产品编号分别为SC-9013、SC-146和SC-14939)。IGF-1(PV-9001)、TGF-β1(PV-9001)兔超敏二步法免疫组化检测试剂盒和CTGF(PV-9003)山羊超敏二步法免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 造模 40只大鼠在SPF级环境下适应性喂养1周,观察大鼠进食、饮水、活动、大小便情况,确定大鼠健康后,全部大鼠禁食不禁水48 h,随机分为造模组(30只)和对照组(10只)。用乙醚麻醉后,将一根直径2 mm的橡胶软管插入大鼠结肠距肛门8~10 cm处,以TNBS 80 mg/kg+等体积的无水乙醇溶液缓慢推入结肠,将大鼠头向下倾斜45 °,放置1 min,然后保持平躺状态,自然清醒。对照组10只大鼠予上述方法以等量的生理盐水灌肠。
1.3.2 药物制备 KKL成人用药40 g/d,以成人体质量60 kg估算,剂量为0.667 g/kg。通过体表面积换算,大鼠按照成人用量的10倍计算,即6.67 g/kg,KKL药物用蒸馏水配成667 g/L。MKKL成人用药36.5 g/d,MKKL药物用蒸馏水配成608 g/L。大鼠灌胃给药体积为10 mL/kg。
1.3.3 分组与给药 造模后第3天,将造模组大鼠按体质量分层随机法分为3组:模型组(M),溃克灵原方组(Y)和加减方组(J),每组10只;对照组(D)10只。同时开始按照上述剂量给药,对照组及模型组给等体积蒸馏水,每天1次灌胃,连续给药14 d。
1.4 观察指标和方法
1.4.1 一般情况 实验过程中,每日观察大鼠的饮食、饮水、活动、大便、体质量变化。
1.4.2 结肠黏膜组织病理学评分 大鼠禁食不禁水24 h后,断头处死大鼠,迅速剖腹,取出距肛门以上8 cm处结肠段,沿肠系膜缘剪开肠腔,体式显微镜观察大体损伤后,留取病变最明显处,对照组在直乙交接处,中性甲醛固定16~24 h,石蜡包埋后切片进行HE染色,光镜下观察炎症浸润情况,参照Dielemen[2]积分标准进行组织学损伤评分,见表1。

表1 组织学评分标准
1.4.3 胶原纤维密度检测 采用Masson三色染色法,步骤:组织脱蜡至蒸馏水;Weigert铁苏木精液染核10 min;盐酸乙醇分化;Masson复合染色液5 min,蒸馏水冲掉染液;磷钼酸5 min,甩干;苯胺蓝10 min,蒸馏水稍洗;分化液30 s/次,共2次;蒸馏水2 min;乙醇脱水,二甲苯透明,封固。结果:肌肉红色,胶原纤维蓝色,核紫黑色。胶原纤维密度测定:在100倍的显微镜下,每张Masson切片随机选择3个视野,采集图像,用Image-Pro plus 6.0图像分析软件分析所拍照片,计算胶原纤维所占视野的百分比。
1.4.4 结肠黏膜组织IGF-1、TGF-β1、CTGF的表达 采用免疫组织化学SP法检测,并进行图像分析。步骤:石蜡切片常规脱蜡至水;用pH 6.0 0.01 mol/L柠檬酸盐缓冲液高压修复,自然冷却,PBS洗3×3 min;0.3% H2O2抑制内源性过氧化物酶37 ℃水浴箱20 min,PBS洗3次,每次3 min;滴加适当稀释一抗,4 ℃冰箱过夜,PBS洗3次,每次3 min;滴加二抗,37 ℃水浴箱20 min,PBS洗3次,每次3 min;DAB显色,苏木精衬染,氨水返蓝,树脂封固;镜下观察,并照相记录。免疫组织化学阳性产物呈棕黄色或棕褐色,核呈紫蓝色。图像分析采用Image-Pro plus 6.0图像分析系统,在200倍显微镜下,每张切片随机选取3个视野检测平均吸光度,取均值进行统计学分析。
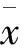
2 结果
2.1 大鼠一般情况、体质量变化比较
2.1.1 大鼠一般情况 正常组大鼠饮食、活动正常,无腹泻、便血表现;模型组、原方组和加减方组大鼠造模后第1天都明显出现饮食、活动减少,体质量下降,精神萎靡,出现不同程度的腹泻,主要为黄色稀便,部分见肉眼血便。经过溃克灵、溃克灵加减方治疗8 d后饮食、活动逐渐增多,精神好转,腹泻逐渐减轻,大便成形,模型组各种情况未见明显好转。
2.1.2 大鼠体质量变化 见图1。
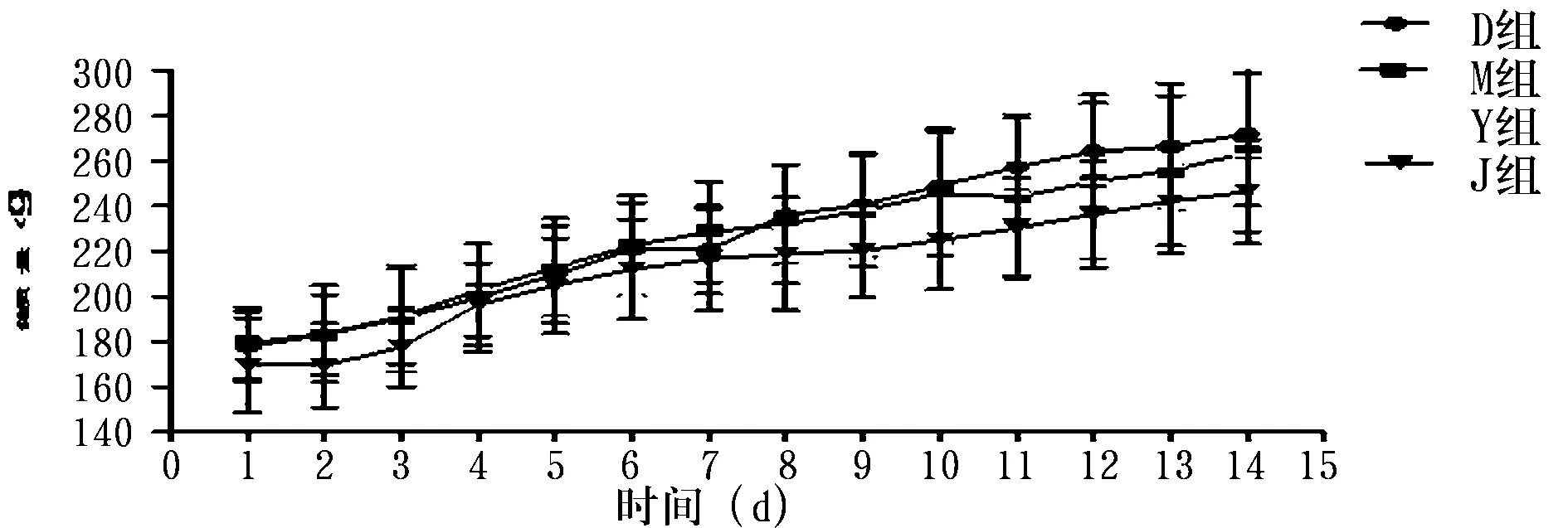
图1 体质量变化
图1示:灌胃第9~14天,原方组、加减方组与对照组比较P<0.05;其余时间点各组体质量变化无统计学意义。
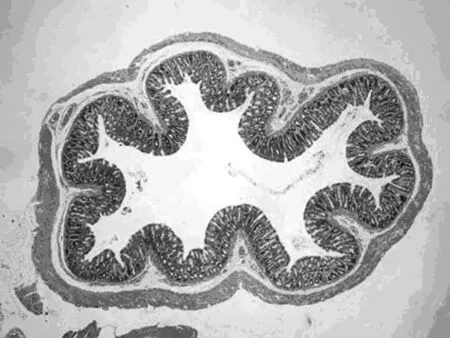
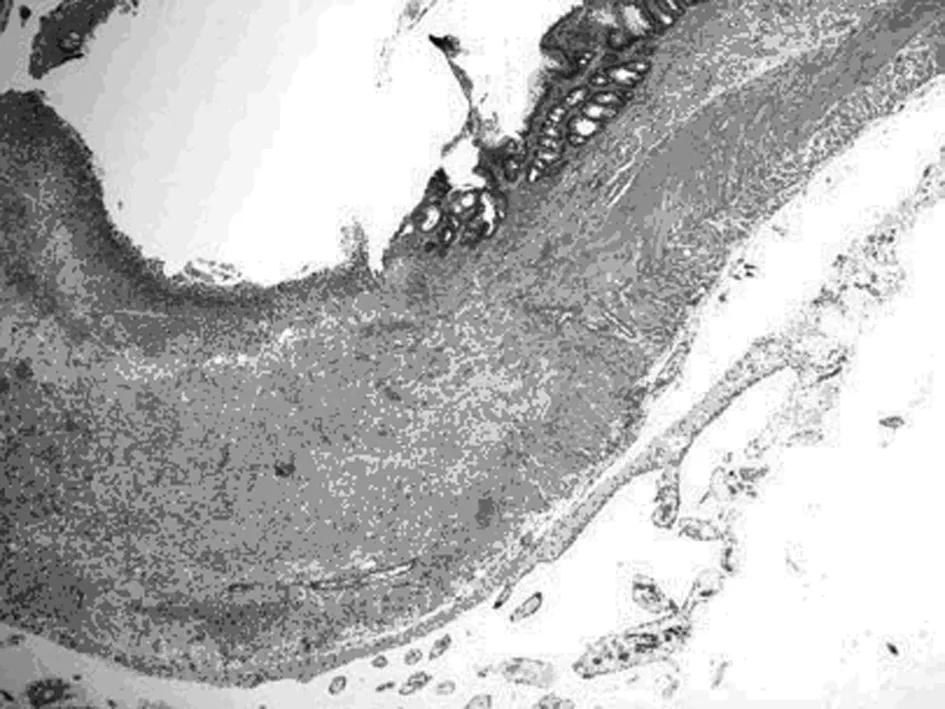
2.2 结肠黏膜组织病理学比较 对照组大鼠结肠黏膜上皮完整,腺体排列整齐,黏膜下血管正常,无充血水肿(图2,D组)。模型组大鼠结肠黏膜层缺失,其余各层结构紊乱,大量炎性细胞浸润,“树丛样”增生小血管,血管壁增厚,浆膜层渗出明显,肠管呈“铅管样”改变(图2,M组)。原方组、加减方组大鼠结肠黏膜上皮大部分缺失,大量炎性细胞浸润,腺体破坏甚至消失,黏膜下层可见增生的血管,肌层增宽(图2,Y组和J组)。模型组、原方组、加减方组组织学评分明显高于正常组(P均<0.01)。原方组、加减方组组织学评分低于模型组,但无明显统计学意义,见表2。
2.3 胶原纤维密度比较 见表2。
D组

M组
J组
表2 各组大鼠结肠组织病理学评分及胶原纤维密度比较(±s)
2.4 大鼠结肠组织IGF-1、TGF-β1、CTGF表达比较 见表3。

表3 各组大鼠结肠IGF-1、TGF-β1和CTGF的表达(±s)
3 讨论
炎症性肠病属于中医“肠风”“痢疾”“泄泻”“肠痈”“肛瘘”“便血”等范畴。基本病机为脾阳受损、痰湿胶结于肠道、血脉瘀阻,后期则可发展成脾肾阳虚的滑脱重症。治疗上应辨证施治,采取清热利湿、散寒化湿、行气活血、疏肝扶脾、温肾健脾、固肠止脱等法则。溃克灵加减方是由经验方溃克灵化裁而来,以猴头菌为君药,助消化、利五脏,具有抗炎抗氧化、增强免疫细胞活性调节免疫机制的作用, 方剂中的黄连、白芍、苍术、地榆炭具有抗菌消炎、敛疮生肌、调节肠道功能等作用,并加入丹参、九香虫和炙甘草活血理气、温阳止痛,全方共奏补脾解毒、调气和血、温阳止痢之功。
IGF-1参与体内多种细胞的生长与分化和某些功能的调节,也参与了肠道纤维化的形成。CD纤维化过程中具有成纤维细胞/肌成纤维细胞表型的细胞数量增加,同时它们分泌IGF-1亦增加。IGF-1可以促使肠道成纤维细胞、肌成纤维细胞和平滑肌增殖并刺激它们合成胶原[3]使纤维化加重。本实验模型组胶原纤维大量增生,免疫组化图片可见大量棕黄色颗粒,为强阳性结果,提示IBD纤维化形成。
多数学者[4]认为TGF-β是控制胶原合成和介导肠纤维化的重要生长因子,从CD病人黏膜样本分离的肌成纤维细胞体外培养实验中TGF-β1的生物活性水平明显升高。TGF-β1可提高肠道肌成纤维细胞的增殖能力及细胞外基质的合成能力,在肠壁炎症致纤维化形成过程中,TGF-β1上调IGF-1 mRNA的表达,IGF-1可以有效地刺激TGF-β1活化后的肌成纤维细胞,它们相互作用调节细胞的增殖、胶原的合成及细胞表型的改变[5]。
结缔组织生长因子(connective tissue growth factor,CTGF)是TGF-β致纤维化特性的一个有代表性的下游效应分子[6]。CTGF促进成纤维细胞增殖、迁移和黏连,引起细胞外基质的重构,它的过表达在致纤维化的通路中(尤其是在TGF-β依赖型通路中)起着重要的作用[7]。CTGF能促进Ⅰ型胶原和纤维蛋白的表达、增加 TGF-β1转录水平,从而促进纤维化形成。
本实验结果表明,溃克灵及其加减方对结肠病理组织学变化具有一定的改善作用,均能降低肠道的胶原纤维密度,抑制IGF-1、TGF-β1、CTGF蛋白的表达,其中溃克灵加减方组对抑制IGF-1、TGF-β1蛋白的表达作用显著优于溃克灵组。结果提示溃克灵加减方对结肠炎模型大鼠具有一定的抗IBD纤维化的作用,其作用机制可能是通过抑制致纤维化因子IGF-1、TGF-β1、CTGF蛋白的表达,减少胶原在肠壁的沉积,从而阻滞或延缓肠道纤维化的进程。
[1]龚黎,于成功,杨臖.中药预处理对结肠炎模型大鼠的免疫调节效应[J].胃肠病学,2008,13(6):364-367.
[2]Dieleman LA,Palmen M,Akol H,et al.Chronic experimental colitis induced by dextran sulphate sodium (DSS)is characterized by Th1 and Th2 cytokines[J].Clinical and Experimental Immunology,1998,11(3):385-391.
[3]Xin X,Hou YT,Li L,et al.IGF-I increases IGFBP-5 and collagen alpha(l)mRNAs by the MAPK pathway in rat intestinal smooth muscle cells[J].Am J Physiol Gastmintest Liver Physiol,2004,286(5):777-783.
[4]Warnaar N,Hofker HS,Maathuis MH,et al.Matrix metalloproteinases as profibrotic factors in terminal ileum in Crohn's disease[J].Inflamm Bowel Dis,2006,12:863-869.
[5]Simmons JG,Pucilowska JB,Keku To,et al.IGF-I and TGF-beta1 have distinct effects on phenotype and proliferation of intestinal fibroblasts[J].Am J Physiol Gastmintest Liver Physiol,2002,283(3):809-818.
[6]Leask A,Holmes A,Abraham DJ.Connective tissue growth factor:a new and important player in the pathogenesis of fibrosis[J].Curr Rheumatol Rep,2002,4(2):136-142.
[7]Moussad EE,Brigstock DR.Connective tissue growth factor:What's in a name[J].Mol Genet Metab,2000,71(1):272-292.

