基于双向固体发酵技术的灵青菌质发酵动态变化研究
刘学湘,陈建伟,苏 洁
(南京中医药大学中药学一级学科,江苏 南京 210046)
马兜铃科植物青木香(Radixaristolochiae)是中医临床常用的一种中药。作为理气药,中医认为它具有平肝止痛,解毒消肿的作用,用于眩晕头痛,胸腹胀痛,痈肿疔疮,蛇虫咬伤。现代药理[1-3]实验证明具有抗炎、镇痛、解痉、降压和抗菌等多种活性。青木香所含毒性成分为马兜铃酸类(aristolochic acid,AA)物质,因“马兜铃酸肾毒性”导致2004年SFDA已取消了其药用标准。鉴于此目前处方和制剂以土木香替代青木香,但文献调研结果显示土木香的植物来源、亲缘关系、功效主治、化学成分、药理作用和临床应用等方面都与青木香有很大的差异[4],所以替代使用仍存在一定争议。目前对于含AA成分的药物减毒主要采取炮制[5]和中药配伍[6]等手段。本研究出发点基于上世纪80年代后期庄毅研究员提出的药用真菌“新型固体发酵工程”的理论。前期实验根据真菌与发酵基质组合双方的发酵情况,初步判定灵芝、红栓菌、白僵菌、槐耳等13种真菌与青木香药材基质基本相适应,组成13种发酵组合。本实验研究的是灵芝菌与青木香的发酵组合产物灵青菌质中基质转化率、总马兜铃酸和马兜铃酸Ⅰ的含量随不同发酵时间的动态变化,为判定灵青菌质的发酵终点及其质量标准的制定提供了科学依据和实验基础。
1 实验材料
LC-10AT高效液相色谱仪(日本岛津公司);UV-2401 PC紫外可见分光光度仪(日本岛津公司);立式压力蒸汽灭菌器LDZX-50KB(上海申安医疗器械厂);超净工作台403(江苏无锡县空气净化设备厂);隔水式电热培养箱PYX-DHS(上海医疗器械七厂);SYZ-A石英亚沸高纯水蒸馏器(江苏金坛国胜仪器厂);AE240电子天平(METTLER公司);202型电热恒温干燥箱(上海索普仪器有限公司);FW80型微型高速万能试样粉碎机(河北省黄骅市齐家务科学仪器厂)。
青木香药材,购自南京鹿江中药饮片厂,批号:20070728,经南京中医药大学陈建伟教授鉴定为马兜铃科植物马兜铃AristolochiadebilisSieb.etZucc.的干燥根;马兜铃酸Ⅰ对照品,购自中国药品生物制品检定所,批号:110746-200305,供含量测定用;灵芝菌种由南京中医药大学药用菌与中药生物技术研究中心提供。
乙腈为色谱纯,自制重蒸水,其他试剂均为分析纯。
2 方法与结果
2.1 PDA斜面培养基配制及其灵芝菌的活化 按以下配方常规配制PDA斜面培养基,配方:马铃薯200 g(去皮切块),葡萄糖20 g,琼脂18~20 g,加水至1 000 mL,pH自然。无菌条件下将灵芝菌接种于PDA斜面上,27~28 ℃避光培养4 d,待灵芝菌白色菌丝长满斜面,取出,置4 ℃冰箱保存,待用。
2.2 青木香基质的制备 将青木香粉碎,过10目筛,填装干净试管,加适量水湿润,pH自然,混合均匀后,扎口,121 ℃高压灭菌30 min,冷却,待用。
2.3 固体发酵 从活化后的灵芝菌菌种斜面上切取一小块菌丝连同培养基,转入青木香基质表面,扎口,置(28±1)℃培养箱中,定期观察并记录菌丝体生长情况。
2.4 灵青菌质的处理 每隔1周从试管中掏出青木香的灵芝菌发酵产物,即灵青菌质,置烘箱内,60 ℃干燥,称取菌质干重,计算基质转化率(%)。基质转化率(%)=菌质干重(g)/青木香基质干重(g)×100%。
2.5 HPLC法测定马兜铃酸Ⅰ含量
2.5.1 色谱条件 色谱柱为Water X Terra C18(5 μm,4.6 mm×250 mm);流动相:乙腈-1%醋酸水溶液(51∶49),流速:1.0 mL/min;检测波长:315 nm;柱温:30 ℃;进样量:20 μL。该条件下对照品峰与样品中其他色谱峰基本达到基线分离。
2.5.2 对照品溶液的制备 精密称取马兜铃酸Ⅰ对照品4 mg,置10 mL量瓶中,加甲醇约7 mL,置水浴上微热使溶解,放冷,加甲醇至刻度,摇匀,即得(每毫升含马兜铃酸Ⅰ为0.4 mg)。
2.5.3 线性关系的考察 精密吸取对照品溶液25、50、100、200、250 μL,分别置1 mL量瓶中,加甲醇至刻度,摇匀,即得浓度分别为10、20、40、80、100 μg/mL的马兜铃酸Ⅰ溶液。照前述色谱条件分别进样10 μL,测定,记录峰面积值(mAbs)。以峰面积为纵坐标(Y)、对照品浓度(μg/mL)为横坐标(X),绘制标准曲线。结果表明:回归方程为Y=3.74×106X-13 916(r=0.999 5),马兜铃酸Ⅰ在10~100 μg/mL范围内线性关系良好。
2.5.4 供试品溶液的制备 取干燥的灵青菌质1 g,粉碎(过40目筛),精密称定,置于100 mL圆底烧瓶中,加10倍量60%甲醇20 mL,浸泡30 min后,水浴回流1 h,滤过,滤液蒸干,残渣以甲醇定容至25 mL,0.45 μm滤膜滤过,滤液作为供试品溶液。
2.5.5 马兜铃酸Ⅰ的含量测定 精密吸取供试品溶液20 μL,注入高效液相色谱仪中,按上述色谱条件测定,外标法计算供试品中马兜铃酸Ⅰ的含量(mg/g)。
2.6 紫外分光光度法测定总马兜铃酸含量[7]
2.6.1 线性关系的考察 精密量取马兜铃酸Ⅰ对照品溶液(浓度为0.4 mg/mL)30、60、120、150、210 μL,分别置10 mL量瓶中,加甲醇至刻度,摇匀(浓度分别为1.2、2.4、4.8、6.0、8.4 μg/mL),照紫外分光光度常规法操作,在250 nm波长处测定样品吸收度,以对照品吸收度(Abs)为纵坐标、浓度(μg/mL)为横坐标(C),绘制标准曲线。结果表明:回归方程为A=0.100 7 C+0.001(r=0.999 2),马兜铃酸Ⅰ在1.2 ~ 8.4 μg/mL范围内呈现良好线性关系。
2.6.2 总马兜铃酸的含量测定 精密吸取上述供试品溶液(1 g→25 mL)60 μL,稀释并定容至10 mL,混匀,参照以上测定方法,以甲醇为参比溶液,在波长250 nm处测定样品吸光度值,标准曲线法计算供试品中总马兜铃酸的含量(%)。
2.7 实验结果
2.7.1 不同发酵时间对青木香基质转化率的影响 以发酵时间(d)为横坐标,基质转化率(%)为纵坐标,绘制灵芝菌发酵青木香的基质转化动态曲线(见图1)。结果表明发酵至第28天灵青菌质的重量小幅下降,第28~35天相对稳定,此后菌质重量又大幅下降。
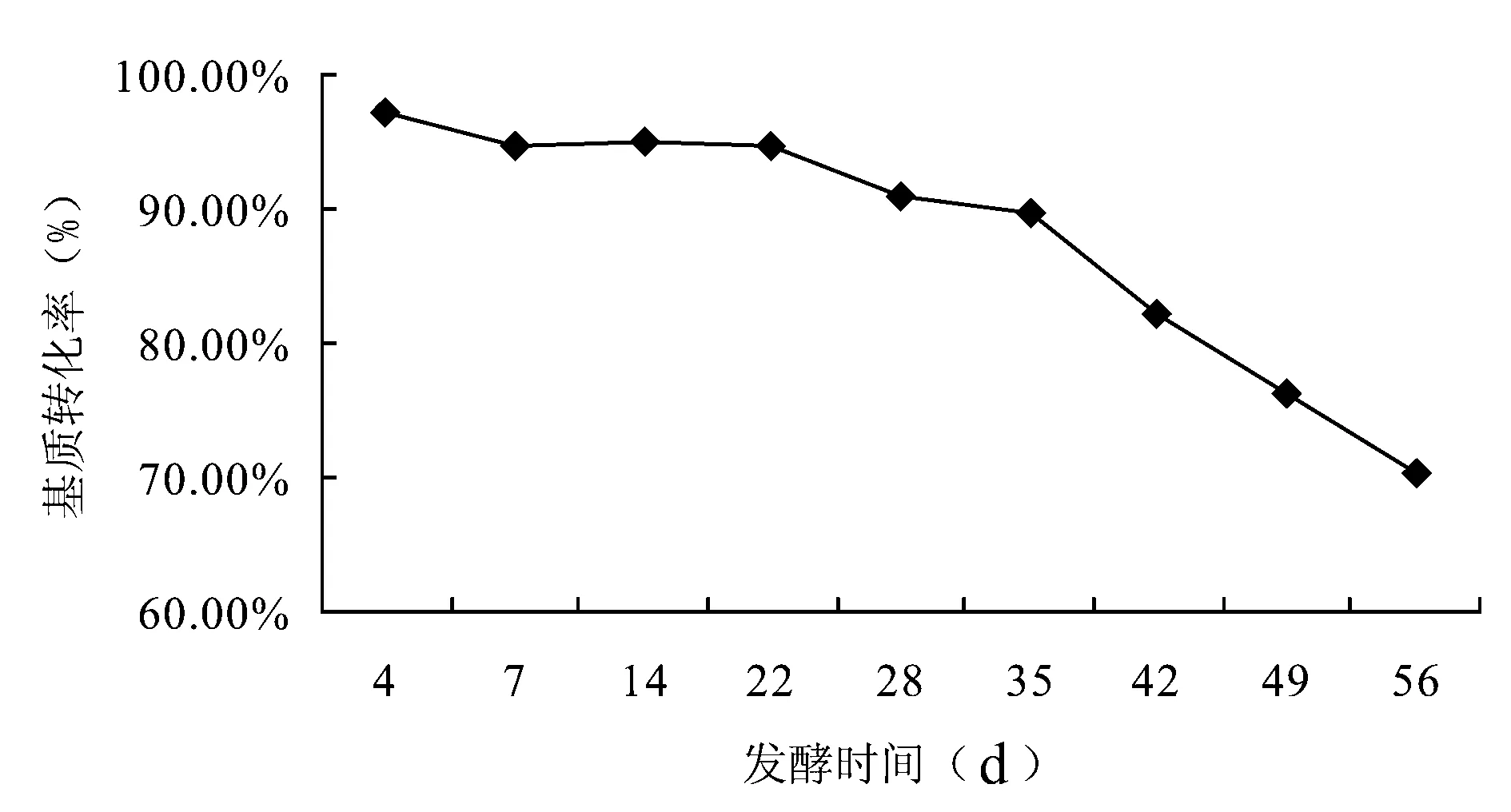
图1 灵青菌质发酵时间-基质转化率的动态曲线图
2.7.2 不同发酵时间对灵青菌质中马兜铃酸Ⅰ含量的影响 以发酵时间(d)为横坐标,马兜铃酸Ⅰ含量(mg/g)为纵坐标,绘制灵芝菌发酵青木香的马兜铃酸Ⅰ含量动态曲线(见图2)。HPLC法测定结果表明,第0~28天马兜铃酸Ⅰ的含量基本没有变化;第28天后马兜铃酸Ⅰ含量开始明显下降,直至第56天。各发酵时间点的样品与发酵空白比较,马兜铃酸Ⅰ含量均有不同程度的下降。
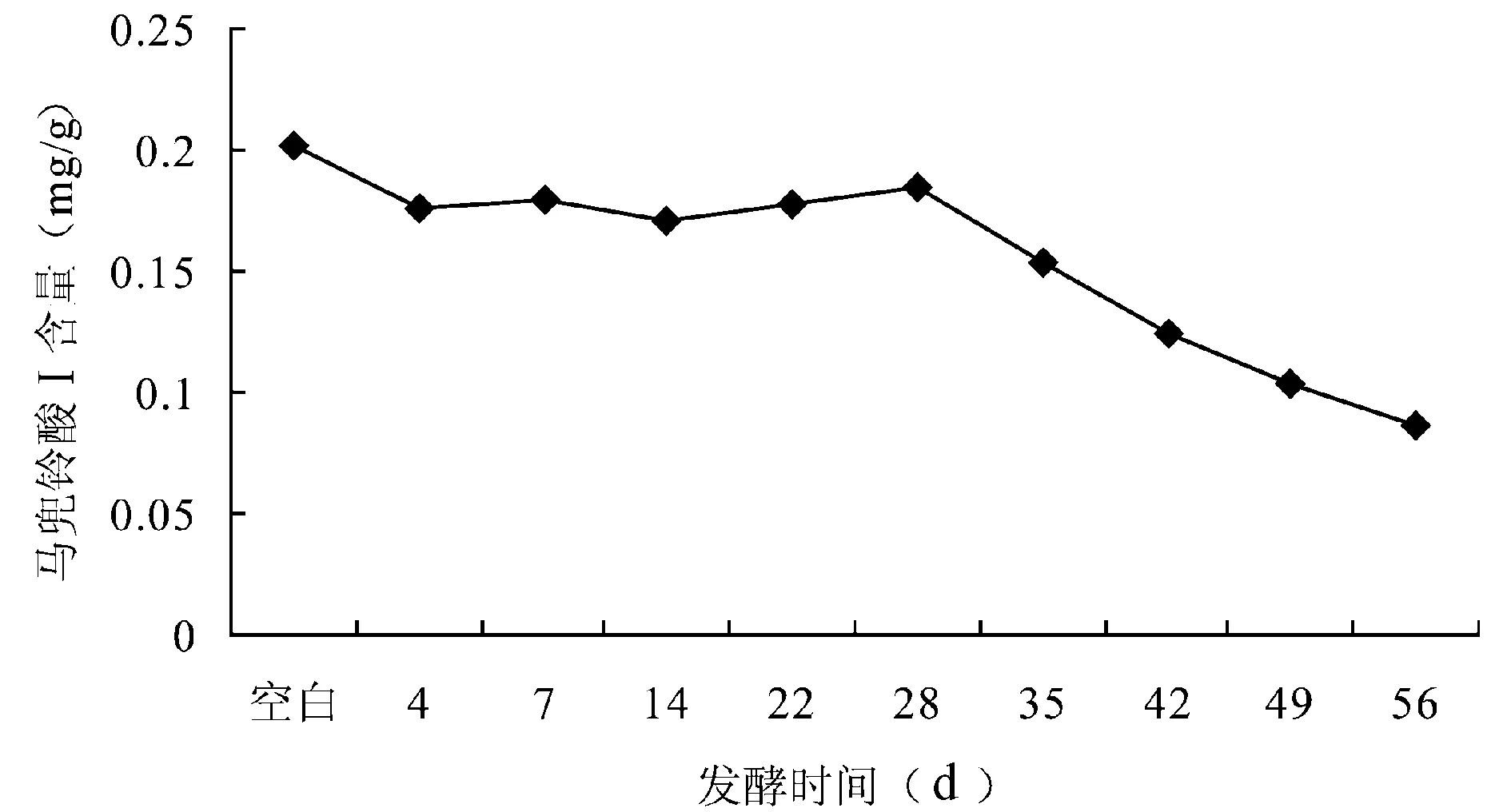
图2 灵青菌质发酵时间-马兜铃酸Ⅰ含量的动态曲线图
2.7.3 不同发酵时间对灵青菌质中总马兜铃酸含量的影响 以发酵时间(d)为横坐标,总马兜铃酸含量(%)为纵坐标,绘制灵芝菌发酵青木香的总马兜铃酸含量动态曲线(见图3)。UV法测定结果表明,第0~28天总马兜铃酸的含量保持下降的趋势,至第28~35天后总马兜铃酸含量基本保持恒定,35 d后总马兜铃酸含量又开始上升。各发酵时间点的样品与发酵空白比较,总马兜铃酸的含量均有不同程度的下降。
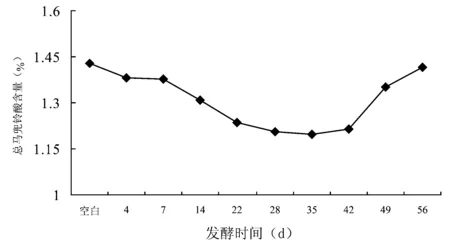
图3 灵青菌质发酵时间-总马兜铃酸含量的动态曲线图
3 结论
根据不同发酵时间基质转化率、马兜铃酸Ⅰ含量和总马兜铃酸的含量测定结果可判定第28~35天左右为灵芝菌发酵青木香的发酵终点。在合理的发酵周期内,采用优化可控的发酵参数进行固体发酵,可为灵芝菌固体发酵青木香获得灵青菌质的制备工艺提供科学的实验依据。
药理实验已证实发酵35 d的灵青菌质与青木香药材比较保持了较好的镇痛与抗炎活性,且毒性明显降低(另文发表),说明运用双向固体发酵技术灵芝菌发酵青木香的研究,确实达到了减毒持效的作用。该技术是现代生物技术在中药研究中的应用,为含马兜铃酸类的中药及其复方制剂的减毒研究提供借鉴。
[1]秘琳,王金华,王智民,等.青木香挥发油药效学研究[J].中国中药杂志,2007,32(21):2324-2325.
[2]王金华,王智民,姜旭,等.青木香炮制前后的药效及毒理学比较研究[J].中国中药杂志,2007,32(5):428-431.
[3]吕金海,舒孝顺,胡兴,等.青木香的抗菌活性[J].怀化学院学报,2007,26(2):69-71.
[4]高卫东,李卫民,高英,等.土木香能否代替青木香用药的探讨[J].中国药房,2006,17(7):556-557.
[5]王智民,由丽双,姜旭,等.利用炮制技术去除关木通毒性成分的方法学研究[J].中国中药杂志,2005,30(16):1243-1246.
[6]李春香,丁里玉,李国川,等.复方配伍减低关木通肾毒性的实验研究[J].中医杂志,2006,47(9):694-697.
[7]李琳,王智民,高慧敏,等.含马兜铃酸类中药材中马兜铃总酸的含量[J].中国实验方剂学杂志,2006,12(2):11-13.
——凹脉马兜铃

