胃安宁含药血清对人胃癌MGC-803细胞COX-2 mRNA、VEGF mRNA表达的影响
颜延凤,许 立,陈 超,许尤琪
(1.南京市中西医结合医院,江苏 南京 210014;2.南京中医药大学,江苏 南京 210046;3.南京中医药大学第二附属医院,江苏 南京 210017)
胃癌(gastric cancer)是临床常见恶性肿瘤之一,而我国是胃癌的高发地区,有报道[1]我国胃癌年患病率和病死率均是世界平均水平的2倍。本实验试从肿瘤转移的角度出发,通过体外实验,观察南京市中西医结合医院抗胃癌经方胃安宁颗粒含药血清对人胃癌MGC-803细胞COX-2 mRNA、VEGF mRNA表达的影响,从而为其进一步研发提供一定的理论依据。
1 材料
1.1 实验动物及细胞株 SD大鼠40只,清洁级,体质量180~220 g,雌雄各半,浙江,实验动物合格证号SCXK(浙)2008-0033。实验动物使用许可证号:SYXK(苏)2007-0030。MGC-803细胞株由南京凯基生物有限公司提供。
1.2 药品和试剂 胃安宁颗粒,由南京市中西医结合医院制剂室制,批号:20090513;PBS,福州迈新恒武技术开发有限公司,批号:11030202Y;1640培养液,Thermo,批号:NWE04009;胰酶,Gibco,批号2011/04;胎牛血清,杭州四季青,批号:110311;双抗,Gibco,批号:15140;Trizol,Invitrogen公司;1382739;COX-2 mRNA、VEGF mRNA引物合成,上海生工生物工程技术有限公司。
1.3 仪器 JA-1203电子天平:上海天平仪器;CO2培养箱:日本SANYO;立式压力蒸汽灭菌器,上海申安医疗器械厂;中科美菱超低温冰箱,中科美菱低温科技有限公司;ELS-10T生命科学型超纯水机,南京易普易达科技发展有限公司;80-2型台式离心机,上海医疗器械有限公司手术器械厂;倒置显微镜,Olympus,CHK-213;Western 电泳仪,Bio-Rad,America,164-5051;多用脱色摇床,江苏金坛市正基仪器厂,HY-4;高速冷冻离心机,美国科俊仪器公司,SH03014;GDS8000凝胶扫描系统,Syngene Corporation,England。
2 实验方法
2.1 细胞的复苏与传代培养 将冻存的人胃癌细胞(MGC-803)传代细胞株取出,快速置于40 ℃水浴解冻,并转移细胞液于离心管中,加入适量培养液(1640+10%胎牛血清),1 000 r/min离心3 min,弃上清,加入适量培养液重悬细胞,将细胞悬液接种入培养瓶,置37 ℃、5%CO2培养箱、饱和湿度下培养,待细胞完全贴壁后,用PBS液清洗细胞3遍,更换培养液。1~2 d换液1次。每日倒置显微镜下观察,当细胞生长状态良好,铺满瓶底时采用25%胰酶按常规方法消化、传代。
2.2 含药血清的制备 取SD健康大鼠40只,适应性饲养1周,随机分为胃安宁低(2 g/kg)、中(4 g/kg)、高(8 g/kg)剂量组及对照组,每组10只,灌胃给药,给药体积为10 mL/kg,对照组给予等体积饮用水,每日给药1次,连续7 d,末次灌胃后1 h在无菌条件下,腹主动脉采血,将血液离心制备成含药血清,56 ℃灭活30 min,分装,-20 ℃保存备用。
2.3 RT-PCR法测定MGC-803细胞COX-2 mRNA、VEGF mRNA表达量 选择处于对数生长的MGC-803细胞,用0.25%胰酶消化并收集细胞。以1640培养液(含10%FBS)制成细胞悬液,并调整细胞的密度为1×105/mL,接种于6孔板中,待长到80%融合时,收取含药血清培养48 h细胞及空白血清培养细胞,进行mRNA抽提、标记、杂交和扫描检测:分别取2组细胞,加适量Trizol匀浆,3 000 r/min,离心10 min,取上清液加入氯仿,振荡后放置3 min,向上清液中加异丙醇充分混匀再3 000 r/min,离心10 min,加入2次75%乙醇,离心弃上清,加入Milli-Q(Rnase-free)完全溶解RNA沉淀,-80 ℃保存。取1 μg总RNA行RT-PCR扩增,操作步骤按试剂盒要求进行。COX-2引物序列为:上游引物5’-CCATGTCAAAACCGTGGTGAAT-3’,下游引物5’-ATGGGAGTTGGGCAGTGATCA-3’,片段长度为374 bp。VEGF引物序列为:上游引物5’-GGTGAGAGGTCTAGTTCCGAAC-3’,下游引物5’-CCATGAACTTACTGCTCTTCTT-3’,片段长度为115 bp。内对照为β-actin引物序列为:上游引物5’-AACCCTAAGGCCAACCGTGAAAAG-3’,下游引物5’-TCATGAGGTAGTCTGTCAGGT-3’引物由上海生工生物工程技术有限公司合成。反应条件为:94 ℃预变性5 min,94 ℃预变性45 s;72 ℃延伸30 s,退火温度为58 ℃、时间30 s;循环30次;取6 μL PCR产物于1.5%琼脂糖中电泳。EB染色后在紫外灯下,用凝胶成像分析系统对凝胶电泳照片进行量化分析,每个标本以β-actin为内对照进行标准化分析后,比较它们的表达量的变化。
3 实验结果
采用RT-PCR法测定MGC-803细胞COX-2 mRNA、VEGF mRNA表达量,结果显示胃安宁含药血清干预MGC-803细胞48 h后,小、中剂量含药血清组中COX-2 mRNA表达量明显降低,与空白血清对照组比较差异有统计学意义(P<0.05);大剂量含药血清组中COX-2 mRNA表达量的变化不明显(P>0.05),见图1。胃安宁含药血清干预MGC-803细胞48 h后,各剂量含药血清组中VEGF mRNA表达量与空白血清对照组比较无统计学意义(P>0.05),见图2。
4 讨论
胃癌是我国发病率最高的消化道恶性肿瘤,其病理机制是一多因素参与的复杂过程,而转移是恶性肿瘤最具破坏性的本质所在,因此探讨胃癌转移机制,寻求抗胃癌转移新靶点及药物已成为当今医学界的研究热点。
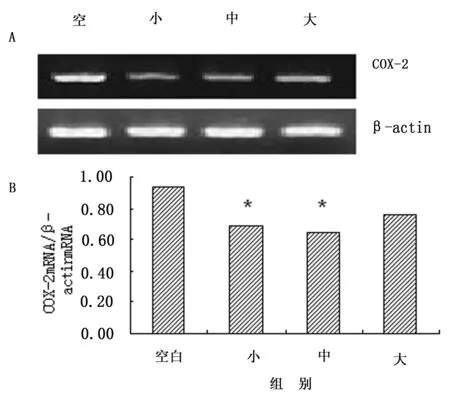
A:电泳图;B:电泳图光密度比值;与对照组比较,#P<0.05。
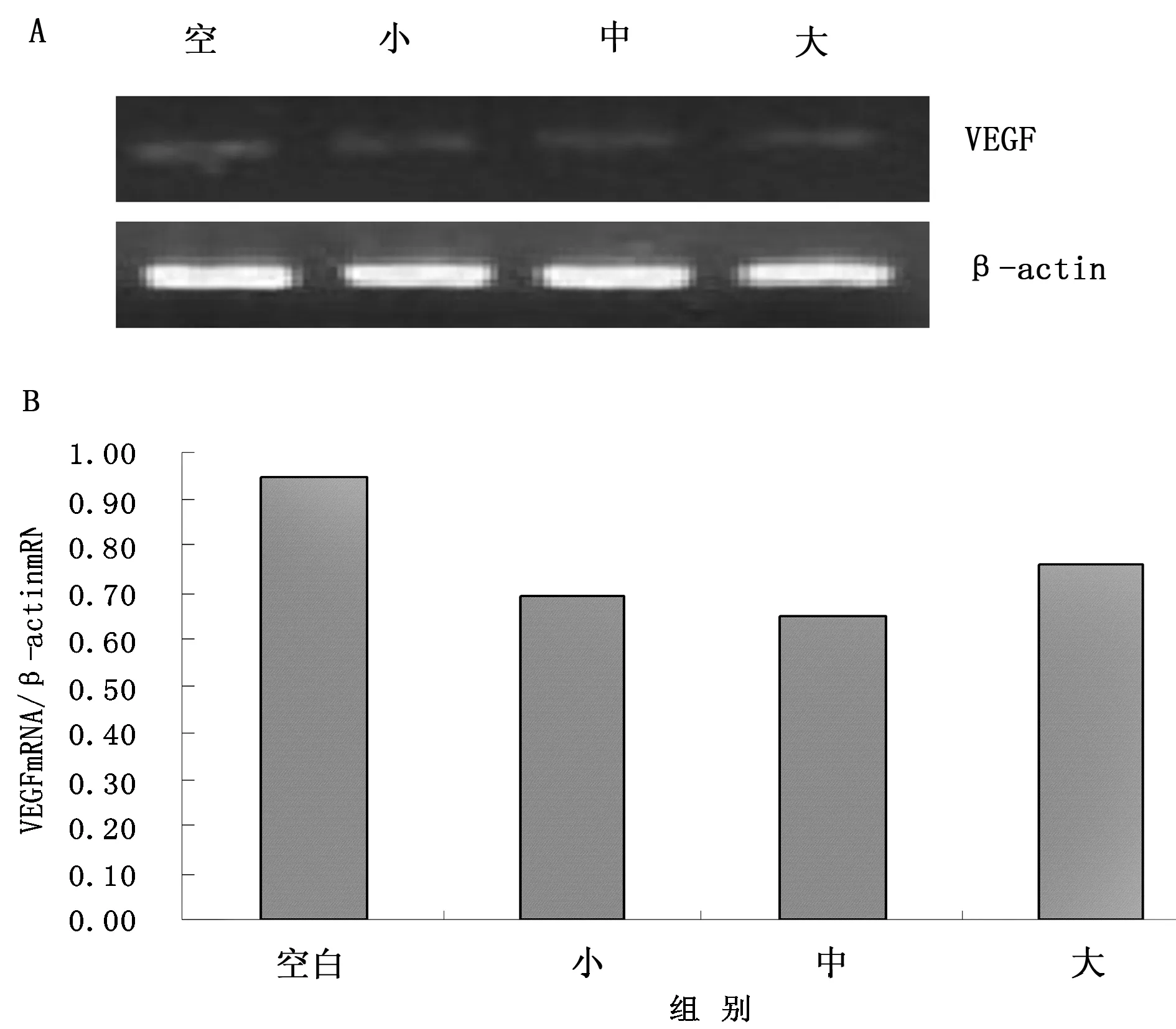
A:电泳图;B:电泳图光密度比值。
COX-2(环氧化酶-2)是炎症过程中的一个重要诱导酶,与COX-l共同参与前列腺素(prostaglandin,PG)的生物合成。有研究表明COX-2 可使e-黏连素和转化生长因子P(TGF-P)的受体下调,也可诱导基质金属蛋白酶(MMP-2)和膜型金属蛋白酶,而促进癌细胞的脱落和在周围的淋巴管、淋巴结中黏附,增强肿瘤的致癌力和侵袭力。并且通过以上机制增加胃癌细胞的侵袭力而促进淋巴结浸润和转移。因此,COX-2可能参与了胃癌淋巴结转移过程中的关键环节。如Tsujii等[2]研究发现,在COX-2高表达的肿瘤细胞可伴有MMPs表达的显著增高,并发现其转移侵袭活性较不伴有MMPs表达者增强,该作用在体外可被特异性COX-2抑制剂所逆转。马丹等[3]研究发现COX-2抑制剂SC236能明显抑制裸鼠胃癌原位移植瘤模型移植瘤的生长及转移。但目前为止,COX-2促进肿瘤浸润、转移的确切分子作用机制尚不清楚。VEGF是目前已识别的新生血管因子中最重要的一种,其表达与肿瘤的恶性程度和转移潜能呈正相关。VEGF通过与内皮细胞上特殊受体作用,直接刺激内皮细胞分化增殖和迁移,增加微血管通透性,促使血浆纤维蛋白外渗,诱导蛋白溶解酶的生成,降解细胞外基质,为转移灶的形成提供必要的途径和血供,从而促进肿瘤的发生发展。
胃安宁颗粒是课题组针对胃癌术后转移脾胃虚弱、气血亏损、瘀毒内结这一病机,在长期临床实践中,不断精炼而成的中药抗癌复方颗粒剂,主要具有健脾活血解毒功效。其主要组成包括黄芪、白花蛇舌草、苦参、薏苡仁、仙鹤草、玄参等中药[4]。方中白花蛇舌草、苦参、仙鹤草、玄参等经研究有明确的抗癌作用,如曾永长等[5]对白花蛇舌草水提部位体内外抗肿瘤实验研究,发现白花蛇舌草在体外可显著抑制HepG2、HCT-116肿瘤细胞的增值,体内能抑制荷瘤小鼠S180肉瘤生长。本课题组前期研究表明胃安宁能下调人胃癌MGC-803细胞的Bcl-2蛋白表达,抑制细胞增殖,诱导MGC-803细胞早期凋亡;本次实验结果显示胃安宁含药血清能抑制COX-2 mRNA的表达,但对VEGF mRNA表达量未见有明显的影响。
综合以上,胃安宁的抗胃癌复发转移作用可能与下调COX-2的表达相关,但肿瘤转移这一生物过程受到多种细胞因子和肿瘤相关基因的控制,因此其具体作用机制还有待进一步深入研究。
[1]何立丽,孙桂芝,张培影.胃癌的病因病机研究进展[J].北京中医,2009,28(3):234-236.
[2]Tsujii M,Dubios RN,Alterations in cellular adhesion and apotosis in epithelial cells over expressing prostaglandin endoperxide synthase 2[J].Cell,1995,83(3):493-501.
[3]马丹,刘敏,梁平.环氧合酶-2抑制剂抑制胃癌转移的实验研究[J].重庆医学,2006,35(20):1875-1876.
[4]颜延凤.许尤琪教授治疗胃癌经验[J].长春中医药大学学报,2011,27(6):943-944.
[5]曾永长,梁少瑜,罗佳波,等.白花蛇舌草水提部位体内外抗肿瘤实验研究[J].中药新药与临床药理,2011(5):521-524.

