植物乳杆菌亚硝酸盐还原酶基因在大肠杆菌中表达
龚钢明,何婷婷,2,高 能
(1.上海应用技术学院,上海 201418;2.上海师范大学 生命与环境科学学院,上海 200234;3.浙江理工大学生命科学学院,浙江 杭州 310018)
亚硝酸盐还原酶(Nitritereductases)是催化亚硝酸盐还原的酶。亚硝酸盐广泛存在于传统腌腊肉制品和腌渍蔬菜中,近年来大量施用氮肥也可导致蔬菜硝酸盐和亚硝酸盐含量升高[1-2]。亚硝酸盐对人体有危害,它能与蛋白质代谢物反应生成强致癌物亚硝胺。SUNJ等[3]研究发现0~50mmol/L亚硝酸钠可以促进胃癌细胞分泌TGF和IL-6等细胞因子,使癌细胞增殖。随着亚硝酸盐对人体危害的认识不断进展,食品中亚硝酸盐污染状况及如何防治也成为食品安全问题的热点之一。利用微生物及其酶降低或消除食物中亚硝酸盐的研究逐渐受到重视。目前这方面研究较多的是关于分解亚硝酸盐的乳酸菌分离及乳酸菌发酵中亚硝酸盐含量的变化规律[4-6]。此外,郑怀忠等[7]研究了巨大芽孢杆菌发酵产亚硝酸还原酶的条件优化和酶在食品中应用。NEUBAUERH[8]在发酵香肠中发现肉糖葡萄球菌(Staphylococcus carnosus)能通过亚硝酸还原酶还原亚硝酸盐。JACOBG等[9]从发酵香肠、烟熏烤肠和腌肉中,筛选出9种可以发酵产生亚硝酸还原酶的葡萄球菌(Staphylococcus)。但迄今有关乳酸菌亚硝酸盐还原酶基因的的研究报道极少。
论文以植物乳杆菌基因组为模板,扩增出亚硝酸盐还原酶基因,再连接到表达载体上,经鉴定、转化、诱导表达,拟获得亚硝酸盐还原酶基因克隆和具有酶活性的重组表达蛋白。这对于研究亚硝酸盐还原酶性质及其应用途径提供有益的参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂
T4DNA连接酶、限制性内切酶(BamHⅠ、XhoⅠ)购自Fermentas公司;DNA Marker;细菌基因组DNA提取试剂盒购自OMEGA公司;DNA凝胶回收试剂盒购自TaKaRa公司;Taq DNA聚合酶、IPTG购自上海生工生物公司;BCA蛋白定量试剂盒购自Biomige公司;亚硝酸盐还原酶总活性检测试剂盒购于GENMED公司。其它化学试剂均为国产分析纯。
1.1.2 菌株与质粒
植物乳杆菌(Lactobacillusplantarum)h2由上海应用技术学院生物工程实验室保存。大肠杆菌(Escherichia coli)TG1、BL21(DE3);pET-32a(+)质粒由天津国际生物医药联合研究院提供。
1.1.3 PCR引物
[10-11],根据不同类型NiR的保守序列设计PCR引物,引物序列为:
P1 5′-GCGGATCCATGAGTCAAAGCTTATG-3′(下划线BamHⅠ酶切位点);
P2 5′-CCGCTCGAGTTAATTCCGTACACTG-3′(下划线XhoⅠ酶切位点)。引物由北京六和华大基因科技股份有限公司合成。
1.2 方法
1.2.1 目的基因PCR扩增与重组质粒构建
提取植物乳酸菌基因组DNA用作模板,加引物P1、P2进行目的基因PCR扩增。反应条件为:90℃,4min;94℃,45s;61℃,45s;72℃,45s;30个循环;72℃,10min。PCR产物用1%琼脂糖凝胶电泳检测。纯化PCR产物,用BamHⅠ、XhoⅠ双酶切,与经相同限制酶酶切的pET-32a(+)质粒连接,重组质粒转化E.coliTG1感受态细胞,提取质粒进行双酶切、凝胶电泳鉴定和质粒PCR、凝胶电泳鉴定,成功构建的重组质粒命名为pET-30a(+)-nir-Lp。具体操作分别参照相应的产品说明和参考文献[12]。
1.2.2 重组质粒在大肠杆菌中表达
参照文献[12]将pET-30a(+)-nir-Lp转化E.coliBL21(DE3)感受态细胞,挑取单菌落培养后用PCR鉴定,筛选含质粒pET-32a(+)-nir-Lp的阳性菌株以1:100接入LB培养基(含50μg/mL氨苄青霉素),35℃培养至OD600为0.5时,加入诱导剂IPTG至终浓度为1mmol/L,200r/min继续培养4h,诱导表达。培养液4℃,5000r/min离心15min收集菌体,用0.2mol/L磷酸盐缓冲液(pH值为7.4)洗涤2次,再重悬于缓冲液中,用超声波法破碎细胞,4℃、10000r/min离心15min收集上清液,用SDS-PAGE电泳检测表达结果。
1.2.3 粗酶液的活性测定
方法1.2.2中破碎菌体离心收集的上清液即可作为粗酶液。用细菌亚硝酸盐还原酶总活性比色法定量检测试剂盒检测粗酶液的酶活性。具体操作按照该试剂盒使用说明。
2 结果
2.1 目的基因扩增
用PCR扩增出亚硝酸盐还原酶目的基因,PCR产物经1%琼脂糖凝胶电泳分析,结果显示(见图1),在接近1600bp处出现单一的条带,该基因初步认定为目的基因扩增产物。
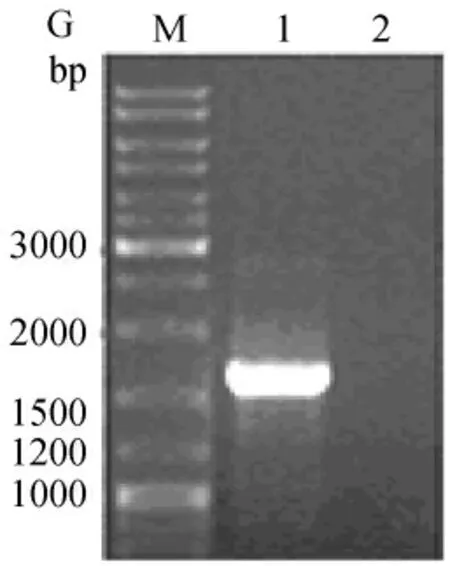
图1 目的基因PCR扩增产物鉴定Fig.1 Electrophoresis of PCR amplification of the targeted gene
2.2 重组质粒构建与鉴定
PCR产物用纯化试剂盒纯化,经BamHⅠ、XhoⅠ双酶切后,与载体pET-32a(+)连接,连接产物转化E.coliBL21(DE3),筛选阳性克隆,提取重组质粒,经BamHⅠ、XhoⅠ双酶切后,琼脂糖凝胶电泳鉴定结果中可获得一个约1600bp插入片段和约6000bp片段(图2)。这与预期结果相符合,表明目的基因已经连接到载体pET-32a(+)上。构建的重组质粒命名为pET-32a(+)-nir-Lp。

图2 重组质粒双酶切鉴定图Fig.2 Double restriction enzyme digestion of recombinant plasmid
2.3 重组质粒表达与目的蛋白鉴定
用重组质粒pET-32a(+)-nir-Lp转化的表达菌BL21(DE3)经IPTG诱导培养后,制备菌体裂解蛋白的样品,进行SDS-PAGE电泳分析(图3),图中显示出一个特异性蛋白条带(箭号所指处),而对照组没有显示该特异性条带。据此可认重组质粒携带的基因获得了表达。所出现的特异性条带可能是亚硝酸盐还原酶蛋白。
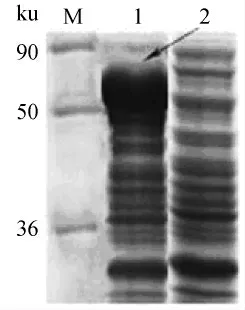
图3 SDS-PAGE分析重组蛋白的表达Fig.3 Analysis of expression of recombinant proteins by SDS-PAGE
2.4 重组质粒表达产物酶活性测定
用细菌亚硝酸盐还原酶活性检测试剂盒(GENMED公司)对重组质粒诱导表达产物和非诱导表达产物(阴性对照)的酶活性进行测定,结果见图4。阴性对照样品的检测结果显示在0~300s测定时间段OD600值没有明显变化,而重组质粒诱导表达产物的样品在测定时间0~300s段,OD600值发生了明显变化。这表明重组质粒诱导表达产物具有亚硝酸盐还原酶的活性。该试剂盒检测原理是亚硝酸盐还原酶催化NaNO2与还原型甲基紫精(蓝色)反应生成氧化型甲基紫精(无色)。反应液的OD600值大小与还原型甲基紫精和NaNO2的含量称正比。
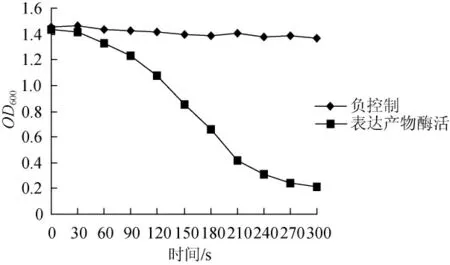
图4 目的基因表达产物的酶活测定结果Fig.4 Enzyme activity of expression product
3 讨论
从研究腌制蔬菜等发酵过程中的亚硝酸盐的变化中发现一些乳酸菌具有消除亚硝酸盐的能力。利用这些菌种人工接种发酵食品能有效控制腌制品中亚硝酸盐的含量以保障这类食品安全[13-14]。关于乳酸菌发酵消除亚硝酸盐的机制还没完全阐明。据张庆芳等[15]的研究认为乳酸菌对亚硝酸盐的降解作用分为酶促反应和酸反应两个阶段,在发酵初期pH值大于4.5时,亚硝酸盐降解作用主要是以亚硝酸还原酶的酶促反应为主,随发酵时间延长,乳酸菌产生大量乳酸,使培养液pH值降低,当pH值小于4.0后,亚硝酸盐迅速分解,并且这种降解作用随着pH值的降低而增强,因此推断在乳酸菌发酵后期,亚硝酸盐的降解主要以酸降解为主。但OH CK等[16]研究发现分离自韩国泡菜的植物乳杆菌在发酵时亚硝酸盐的消除很大程度上取决于温度,而不是pH值,乳酸的作用相对较小。从克隆和表达乳杆菌亚硝酸盐还原酶结构基因的角度进行探索。实验用的植物乳杆菌经过盐酸萘乙二胺法检测结果显示有较强的亚硝酸盐还原能力[17]。从该菌株基因组中克隆出了假定的亚硝酸盐还原酶基因,并成功插入到大肠杆菌蛋白表达系统pET-32a(+)载体中。所构建了的重组质粒,经转化大肠杆菌和IPTG诱导,克隆的目的基因有效表达了重组目的蛋白,对表达菌体蛋白采用了亚硝酸盐还原酶总活性检测试剂盒检测,发现假定亚硝酸盐还原酶基因表达的目的蛋白有显著的还原亚硝酸盐的功能。据此认为这个表达蛋白是亚硝酸盐还原酶。进而表明该乳杆菌基因组中包含有亚硝酸盐还原酶的基因。实验结果可为深入探讨植物乳杆菌亚硝酸盐还原酶奠定重要的基础。
参考文献:
[1]郭金芝,金东日,杜长青.施肥对大棚蔬菜地土壤水及地下水硝酸盐和亚硝酸盐污染的研究[J].延边大学学报,2009,35(2):156-159.
[2]侯 晶,陈振楼,姚春霞.上海浦东地区蔬菜硝酸盐与亚硝酸盐污染现状分析[J].华南农业大学学报,2006,27(2):17-19.
[3]SUN J,AOKIK,WANG W.Sodium nitrite induced cytotoxicity in cultured human gastric epithelial cells[J].Toxicol In Vitro,2006,20(7):1133-1138.
[4]夏岩石,孙春凤.乳酸菌降解亚硝酸盐的动态研究[J].湖南科技学院学报,2008,29(8):44-46.
[5]王昌禄,隋志文,武晋海.亚硝酸盐降解菌的分离及其降解特性[J].中国酿造,2008,27(9):33-36.
[6]蒋欣茵,李晓晖,张伯生,等.腌制食品中降解亚硝酸盐的乳酸菌分离与鉴定[J].中国酿造,2008,27(1):13-16.
[7]郑怀忠,陈发河,李淑燕,等.亚硝酸还原酶高产菌株的筛选及发酵条件优化[J].中国农业科技导报,2009,11(3):81-87.
[8]NEUBAUER H,PANTEL I,GOETZ F.Molecular characterization of the nitrite-reducing system ofStaphylococcus carnosus[J].J Bacteriol,1999,181(5):1481-1488.
[9]JACOB G.Relationship between nitrate/nitrite reductase activities in meat associated staphylococci and nitrosylmyoglobin formation in a cured meat model system[J].Int J Food Microbiol,2007,120(1):303-310.
[10]BRAKER G,FESEFELDT A,WITZEL KP.Development of PCR primer systems for amplification of nitrite reductase genes(nirK and nirS)to detect denitrifying bacteria in environmental samples[J].Appl Environ Microb,1998,64(10):3769-3775.
[11]HALLIN S,LINDGREN PE.PCR detectction of gene encoding nitrite reductase in denitrifying bacteria[J].Appl Environ Microb,1999,65(4):1652-1657.
[12]萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].北京:科学出版社,2005.
[13]YAN PM,XUE W T,TAN SS.Effect of Inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese Paocai[J].Food Control,2008(19):50-55.
[14]李洁芝,陈 功,张其圣,等.直投式乳酸菌发酵青菜时亚硝酸盐的动态变化与控制[J].食品与发酵工业,2009,35(8):64-68.
[15]张庆芳,迟乃玉,郑 燕,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):55-60.
[16]OH CK,OH M C,KIM SH.The depletion of sodium nitrite by lactic acid bacteria isolated from kimchi[J].Med food,2004,7(1):38-44.
[17]龚钢明,管世敏,邵 海,等.降解亚硝酸盐乳酸菌的分离鉴定[J].食品工业,2009(5):12-13.

