产低温脂肪酶菌株的筛选、纯化及其部分酶学性质研究
王春雨,迟乃玉*,张庆芳
(大连大学 生命科学与技术学院,辽宁 大连 116622)
低温脂肪酶具有高效、耐热、作用周期短等优势,在应用上具有中高温脂肪酶无法取代的优越性,因此低温脂肪酶广泛的应用在食品、轻纺、皮革、香料、化妆品、洗涤剂、有机合成、医药等领域上。国外研究者对其中几种典型的脂肪酶如来源于Candida rugosa[6]、Candida antarcticaA[7]、CandidaantarcticaB[8]、Rhizomucor miechei[9]、Thermomyces lanuginosus[10]的脂肪酶的应用进行了详细的综述,这些脂肪酶在油脂加工和食品工业、寿星药物合成、生物能源、医药和化妆品等行业显示出良好的前景。相比于国外,国内目前只有作为洗涤剂的碱性脂肪酶,而酯化或转酯化用的脂肪酶还是空白。
本文从大连大黑山和渤海湾采样,筛选产低温脂肪酶的菌株,并对其产酶条件进行研究。
1 材料与方法
1.1 土样来源
渤海湾海水和大连大黑山土样。
1.2 培养基
Luria-Bertani(LB)培养基[11]:胰蛋白胨1.0%,酵母提取物0.5%,NaCl 1.0%,琼脂1.5%,pH7.0。
初筛培养基:蛋白胨1.0%,酵母粉0.5%,NaCl 0.5%,CaCl20.02%,Tween80 1.0%,pH7.2。
发酵培养基:酵母膏0.5%,(NH4)2SO40.5%,KH2PO40.2%,NaCl 0.3%,MgSO4·7H2O 0.05%,橄榄油2%(v/v),pH7.0。
在教学中,建立关系的前提是师生之间发生交流和交往,但现在的许多课堂,只是单向的教师讲授、学生接收。教师的注意力主要在“教”,没有注意到在“教”的过程中与学生发生交流和交往,建立某种超越客观知识的情感关系。我试图强调的是,在“教”的过程“之中”发生了什么。当前,我们没有很好地区别什么是教师关注自己的教学本身,什么是关注教学“之中”发生的事情。这个区别不是特别明显,但同时这个区别又是巨大的。
牛肉膏蛋白冻培养基:牛肉膏0.3%,蛋白胨1.0%,Na-Cl 0.5%,琼脂1.8%,pH7.0。
1.3 产低温脂肪酶菌株的初筛
样品稀释至10-7后,接种于初筛培养基平板上,20℃培养4d。产脂肪酶的菌株能分解Tween80在菌落周围形成白色沉淀圈。将产生白色沉淀圈的菌株活化后,分别接种于初筛培养基平板上,记录菌落直径与沉淀圈直径之比。
1.4 产低温脂肪酶菌株的复筛
将待测菌株活化后,接种于种子液中,20℃、160r/min培养12h,转接于100mL发酵液中,20℃、160r/min培养2d,测其酶活。
1.5 产低温脂肪酶菌株的紫外诱变
选出一株菌落直径与沉淀圈直径之比和酶活最大的菌株,将其制成种子液,在20℃、160r/min培养12h。把菌液稀释到适当梯度,置于磁力搅拌器上,在紫外灯的功率15W,照射的距离为30cm的条件下,照射不同时间进行紫外诱变。分别吸取不同照射时间的稀释液均匀涂布到初筛培养基上,装入黑布袋中,倒置于恒温箱中,在20℃培养3d,取出计算菌落数,并观察白色沉淀圈。
1.6 脂肪酶活性测定方法
取3mL 50mmol/L磷酸盐缓冲液(pH值为7.0)和1mL橄榄油,放入水浴恒温磁力搅拌37℃中预热5min,加入0.1mL酶溶液,磁力搅拌10min,立即加入8mL笨,继续搅拌2min,终止反应,同时萃取生成的脂肪酸。将溶液转移至离心管中,4000r/min离心10min,有机相和水相分离澄清。取上层有机相4mL于小锥形瓶中,加入1mL显色剂,磁力搅拌上搅拌3min,4000r/min离心10min,取上层含有脂肪酸铜的苯溶液,用分光光度计在波长710nm处测OD值。
由脂肪酶活力定义得活力计算公式:脂肪酶活力(单位/mL)=CV/TV’,公式中C脂肪酶的浓度(μmol/mL);V脂肪酸/苯溶液的体积(mL);T作用时间(min);V’酶液的用量(mL)。
1.7 产脂肪酶菌株的鉴定
1.7.1 形态学、生理生化特征
产脂肪酶菌株的形态学观察、生理生化实验参照文献[12]方法进行。
1.7.2 16SrDNA序列测定和分析
以菌株CZWOO1总DNA为模板,利用真细菌的16SrDNA通用引物进行PCR,产物经琼脂糖凝胶电泳分析,得到一条1.5bp左右的条带(见图1)。以Seq Forward、Seq Internal和16SSeqF1为引物进行DNA测序。序列分析结果表明,菌株CZWOO1的16SrDNA序列得到有效扩增,其大小为1429bp。进入NCBI主页,应用BLAST程序与数据库中的已有细菌16S rDNA序列进行相似性比较分析。利用ClustalX1.83进行匹配比对,然后用MEGA5.05软件构建系统发育树。

图1 3%琼脂糖凝胶电泳Fig.1 3% Agarose gel electrophoresis
2 结果
2.1 菌种筛选
从59株来自大连大黑山土样和渤海湾海水的细菌中筛选到10株产低温脂肪酶的菌株,其中以菌株007的直径比最大且酶活最高,其酶作用温度最低(25℃)。对该菌株进行紫外诱变,当诱变130s时,致死率达到90.7%,得到一株直径比和酶活明显高于原菌株的菌株,命名为CZWOO1。
2.2 菌种鉴定
2.2.1 形态学、生理生化特征
菌株CZWOO1在LB培养上20℃培养3d,菌落乳白色、圆形、隆起、不透明、表面光滑、湿润、边缘整齐,直径约0.9cm。菌体革兰氏阴性、短杆状。常规生理生化特征见表1。
2.2.2 分子生物学鉴定
序列分析结果表明,菌株CZWOO1的16SrDNA序列全长为1429bp。将序列输入GenBank进行BLAST相似度比较,下载相似度序列,利用ClustalX进行多序列匹配比对,通过MEGA5.05软件计算出序列的系统进化距离,采用Neighbor-Joining构建系统进化树(见图2)。菌株CZWOO1与Bacillusthuringiensis(NR 043403.1)亲缘关系最近,同源性达到100%,因此菌株CZWOO1属于芽孢杆菌属中的苏云金芽孢杆菌,命名为BacillusthuringiensisCZWOO1。
2.3 脂肪酶的分离纯化及二级结构预测

表1 菌株CZWOO1 生理生化特征Table 1 Physiological and biochemical characteristics of the strain CZWOO1

图2 菌株CZWOO1基因系统发育进化树Fig.2 Phylogenetic trees for 16S rDNA sequence of CZWOO1
苏云金芽孢杆菌CZW001脂肪酶发酵上清经65%硫酸铵沉淀,用0.05mol/LTis-Hcl缓冲液(pH8.2)溶解,并用相同的缓冲液4℃透析12h获得粗酶液。经截留分子量为10ku的中空纤维柱超滤浓缩,将浓缩液加到预先用Tis-Hcl缓冲液(0.05mol/L pH8.2)平衡好的DEAE-纤维素-52层析柱(Φ1.6×30cm)上,用250mL 0~1mol/L的NaCl线性梯度洗脱。利用平板定性检测脂肪酶活性,收集含脂肪酶各管,测定其酶活,合并含酶活各管。将样品过Sephadex G-100(Φ1.6×50cm)柱,用0.05mol/L Tis-Hcl缓冲液(pH8.2)洗脱,收集有酶活性部分,结果见图3。蛋白曲线呈现一个小峰和一个大峰,而低温脂肪酶酶组分主要集中在大峰内,25管~45管范围内的蛋白峰酶活性比较高,说明Sephadex G-100凝胶柱已经除去了一部分高分子量和低分子量的蛋白,将目的酶蛋白同其他杂蛋白分离开来。
苏云金芽孢杆菌CZW001脂肪酶发酵上清液经硫酸铵沉淀、超滤离心、DEAE-纤维素-52离子交换层析和Sephadex G-100凝胶过滤层析等纯化步骤,脂肪酶纯化倍数为75.5倍,活性回收率为37.6%。其中DEAE-纤维素-52离子交换层析效果最佳,仅此一步就纯化了56倍(纯化效果见表2)。SDS-PAGE凝胶电泳[9]显示纯化后的脂肪酶为单一条带(见图4),分子量约为40ku。纯化倍数为75.5倍,活性回收率为37.6%,跑12%SDS-PAGE电泳为单一条带(见图4),分子量约为40ku。
对多次分离纯化的低温脂肪酶进行圆二色谱分析,见图5。用Jascow32软件分析及Yang-chen公式计算其二级结构成分:α-螺旋10.6%,β-折叠40.1%,β-转角18.8%,无规则卷曲30.5%。

图3 Sephadex G-100 凝胶过滤Fig.3 Gel filtration chromatogram of Sephadex G-100

表2 脂肪酶的纯化Table 2 Purification of Bacillus thuringiensis CZWOO1 lipase

图4 12%SDS-PAGE电泳图Fig.4 12% SDS-PAGE of enzyme solution
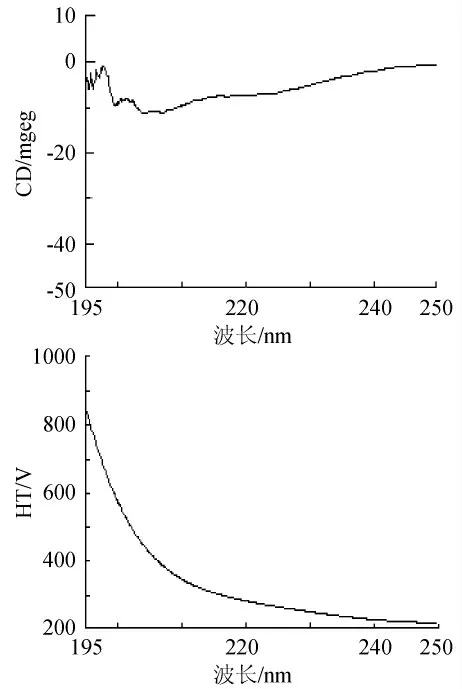
图5 低温脂肪酶圆二色谱图Fig.5 The CD spectrum of cold-active amylase
2.4 脂肪酶性质
2.4.1 pH值对CZWOO1脂肪酶活力的影响
在30℃、不同pH值条件测定菌株CZWOO1脂肪酶活力,结果见图6。该酶的适宜作用pH值范围在7~9,最适pH值为8。
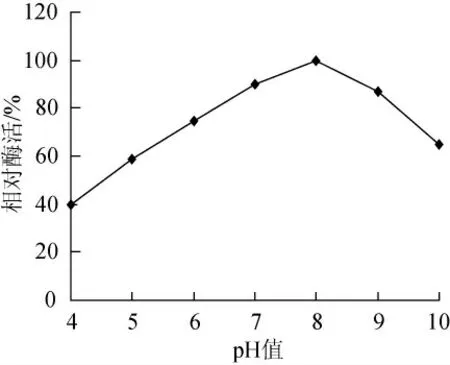
图6 p H值对CZWOO1脂肪酶活力的影响Fig.6 Effects of pH value on lipase activity of CZWOO1
2.4.2 温度对CZWOO1脂肪酶活力的影响

图7 温度对CZWOO1脂肪酶活力的影响Fig.7 Effects of temperature on lipase activity of CZWOO1
在pH8.0条件下,测定10℃~45℃温度范围酶活力与温度的关系,结果见图7。CZWOO1脂肪酶活力在25℃达到最高,在10℃是仍具有较高的酶活,相对酶活达到38%。
2.4.3 温度对CZWOO1脂肪酶稳定性的影响
将酶液在不同温度中保温30min,在25℃、pH8.0条件下,测定CZWOO1脂肪酶残余活力。结果见图8,CZWOO1脂肪酶稳定性较差,在60℃处理30min,酶活损失达70%。
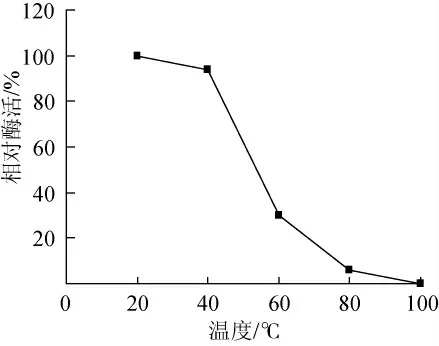
图8 温度对CZWOO1脂肪酶稳定性的影响Fig.8 Effects of temperature on lipase stability of CZWOO1
3 讨论
菌株CZWOO1为革兰氏阴性短杆菌,兼性厌氧,不能水解淀粉、明胶、纤维素和尿素,能水解油脂,使阿拉伯糖、木糖和甘露糖产酸,吲哚和柠檬酸盐试验阴性。从菌株CZWOO1基因系统发育进化树看,菌株CZWOO1与Bacillus thuringiensis(NR 043403.1)亲缘关系最近,同源性达到100%,因此菌株CZWOO1属于芽孢杆菌属中的苏云金芽孢杆菌,命名为BacillusthuringiensisCZWOO1。
苏云金芽孢杆菌CZW001脂肪酶发酵上清液经硫酸铵沉淀、透析、超滤离心、DEAE-纤维素-52离子交换层析和Sephadex G-100凝胶过滤层析得到电泳纯的脂肪酶,跑12%SDS-PAGE电泳为单一条带,分子量约为40ku。对纯化后的低温脂肪酶进行圆二色谱分析,结果表明,其二级结构成分:α-螺旋10.6%,β-折叠40.1%,β-转角18.8%,无规则卷曲30.5%。对该脂肪酶二级结构的预测给其适冷机制的研究奠定基础。
对BacillusthuringiensisCZW001分泌的脂肪酶的初步研究表明,该脂肪酶的适宜作用pH值范围在7~9,最适pH值为8,最适作用温度为25℃,对热敏感,60℃处理30min仅残留30%酶活性。该低温脂肪酶在低温下具有良好的催化活性,作用pH值偏碱性(pH7~9)等特点,应在环境治理、洗涤业等领域有着良好的应用前景,并且其对热敏感等特点,从而避免高温灭活对食品品质产生的破坏,在食品工业也有良好的应用潜力。
[1]QU YEN D T,SCHMIDT-DANNERT C,SCHMID RD.High-level expression of alipasefromBacillusthermocatenulatusBT L2 inPichia pastorisand some properties of the recombinant lipase[J].Prot Expr Pur,2003,28(1):102-110.
[2]林学政,边 际,何培青.极地微生物低温适应性的分子机制[J].极地研究,2003,15(1):75-82.
[3]RASHID N,SHIMADA Y,EZAKIS,et al.Low-temperature lipase from psychrotrophicPseudomonassp strain KB700A[J].Appl Environ Microb,2001,67(9):4064-4069.
[4]LEEHK,AHNMJ,KWAK SH,et al.Purification and characterization of cold active lipase from psychrotrophicAeromonassp.LPB 4[J].J Microbiol,2003,41(1):22-27.
[5]TRIPATHIM K,ROY U,JINWAL U K,et al.Cloning,sequencing and structural features of a novelStreptococcuslipase[J].Enzyme Microb Technol,2004,34(5):437-445.
[6]BENJAMIN S,PANDEY A.Candida rugosalipases:molecular biology and versatility in biotechnology[J].Yeast,1998,14:1069-1087.
[7]DOMINGUEZ DE M P,CARBONI-OERLEMANS C,TUIN B,et al.Biotechnological applications ofCandida antarcticalipase A:stateof the art[J].J Mol Catal B:Enzym,2005,37:36-46.
[8]ANDERSON E M,LAARSSON K M,KIRK O.One biocatalyst many applications:theuseofCandidaB-lipaseinorganic synthesis[J].Biocatal Biotransf,1998,16:181-204.
[9]RODRIGUE S R C,FERNANDEZ-LAFUENTE R.Lipase fromRhizomucor mieheias an industrial biocatalyst in chemical process[J].J Mol Catal B:Enzyme,2010.
[10]FERNANDEZ-LAFUENTER.Lipase fromThermomyces lanuginosus:usesand prospectasan industrial biocatalyst[J].J Mol Catal B:Enzym,2009,62(3):197-212.
[11]SAMBROOK J,FRISH E F,MANIATIS T.Molecular.Molecular Cloning:Alaboratory Manual[M].Second Edition.New York:Cold Spring Harbor Laboratory Press,1989.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.

