PLGA/ECM神经支架性质的体外评价
刘彬,可金星,蔡绍皙,李校堃,张路,陈文琦1,,5,张耀光
1 淡水鱼类资源与生殖发育教育部重点实验室,重庆 400715
2 第三军医大学中心实验室,重庆 400030
3 重庆大学生物工程学院,重庆 400030
4 吉林农业大学 生物反应器与药物开发教育部工程研究中心,吉林 长春 130118
5 西南大学生命科学学院,重庆 400715
周围神经缺损替代修复是一个复杂且难度较高的问题,生物组织工程支架是解决这一难题的有效途径。材料问题一直是神经支架所面临的重要问题之一,很多材料都被应用这一领域的研究中[1-8]。单一材料在体现其优势的同时,通常也体现出一些缺陷,因此采用多种材料制备复合材料作为神经支架以促进周围神经损伤修复,是目前普遍认可的方法。新鲜猪皮中水分含量为55.5%,脂肪含量为13.56%,猪皮中的胶原含量约为24.35%,其余部分主要为细胞内容物[9]。以猪皮为原料制备细胞外基质 (ECM) 的实质是去除脂肪和具有免疫原性的细胞内容物。猪皮来源的ECM主要由胶原构成,除此之外还含有层粘连蛋白、纤维结合蛋白等有益于神经再生的物质,具有良好的生物相容性[1]。其中,胶原为三股螺旋结构,α1和α2链的分子量约为100 kDa,β链的分子量约为200 kDa,变性温度为37.5 ℃。胶原分子主要包含甘氨酸、脯氨酸和羟脯氨酸,不含色氨酸和胱氨酸[9-10]。猪皮在厚度及其面积方面的优势决定了猪皮来源的ECM更易于加工成神经支架所需要的形态。NGF在神经损伤修复中的作用得到了广泛的认同,但是,NGF缓释体系的合理性直接决定了NGF功能的发挥[1]。在以猪皮来源的ECM制备对NGF具有缓释功能的神经支架的过程中,需要一种包封剂。PLGA良好的生物相容性及其生物可降解性等性质,都表明它适合作为这种包封剂。PLGA在体内降解过程中,会释放弱酸性物质,从而为组织环境pH的稳定造成一定的压力[11],本研究拟采用一种弱碱性物质,即赖氨酸[12-13]来克服这一问题。
本研究以猪皮为原料制备 ECM,用 PLGA将NGF和赖氨酸复合在ECM上,以构建一种对NGF具有缓释功能,并可以在一定程度上中和PLGA酸性降解产物的复合材料。通过形态学观察、力学测试、降解试验、细胞学试验,在体外评价其作为神经支架的可行性。由于本材料仅供体外测试使用,故其形态未与周围神经的几何形态相匹配。
1 材料与方法
1.1 猪皮来源ECM的制备与观测
取猪肩背部新鲜猪皮,去毛,温水清洗,切割成条状 (2 mm×2 mm×100 mm),用NaOH溶液脱脂,用NaCl进行高渗透压处理,用纯净水进行低渗透压处理,用胰蛋白酶 (Sigma公司)破坏细胞成分、细胞连接,疏松胶原,用5 mmol/L Tris-HCl (pH 8.0) +2%TritonX- 100中在37 ℃下振荡浸泡3 d,室温下用清水冲洗2 d,用Trix-100 (Sigma公司) 进行去垢处理,纯净水漂洗;用冷冻干燥机 (Flexi-Dry μP,FTSSYSTEM,USA) 脱水;分别进行扫描电子显微镜 (AMRAY 1000B,USA) 和 HE染色观测去细胞效果以及内部形态[14]。
1.2 NGF明胶微球的制备
在明胶 (Bloom strength,225;pI:4.7;Sigma)水溶液中加入NGF (ß-NGF,Human,Sigma),加入植物油 (37 ℃) 乳化,冷冻到−20 ℃,在冷冻离心机中分离,沉淀物用丙酮洗涤,除去植物油和水,冷冻干燥,筛分备用 (400目)[15-20]。
1.3 神经支架的制备
将NGF明胶微球、赖氨酸、猪皮来源ECM置于3% (W/V) PLGA (8020 mole ratio of lactide to glycolide;Sigma) 的二氯甲烷溶液中,振荡混合后,负压抽干。
1.4 内部形态观察及孔隙率测定
用扫描电子显微镜 (AMRAY 1000B,USA)观察神经支架的表面及断面的形态;用文献报道的方法测定孔隙率和密度[21]。
1.5 力学测试
用材料力学测试机 (INSTRON 1011,USA)检测神经支架的力学性质 (加载速度为10 mm/min)。
1.6 体外降解测试
取神经支架 (300±1) mg (以猪皮来源ECM和 PLGA为对照),置于安培瓶中,分别加入10 mL三蒸水或PBS (Sigma公司),置于摇床(50 r/min) 在生化培养箱 (37 ℃) 中持续处理8周,期间不更换降解液,每周取样1次。用pH计 (DELTA320) 在各时间点检测降解液pH值。在前4周分别称量各样品的湿重和干重 (经冷冻干燥),称重后将样品重新放回原降解液中。对于进行SEM观察的样品做相同的处理。
1.7 对NGF的持续释放作用
取50 mg神经支架,加入10 mL PBS,置于摇床 (40 r/min) 在生化培养箱 (37 ℃) 中持续处理30 d每次取样1 mL,同时回加1 mL新鲜的PBS。期间,在起始12 h中,每间隔2 h取样1次,在此后的2 d内,每12 h取样1次,之后,每天取样1次。对各样品进行−70 ℃保存。待全部取样完成后,统一用β-NGF (human) ELISA kit (Sigma) (按试剂盒使用说明书) 对各样品进行处理。神经支架对NGF的累计释放率的计算公式为:
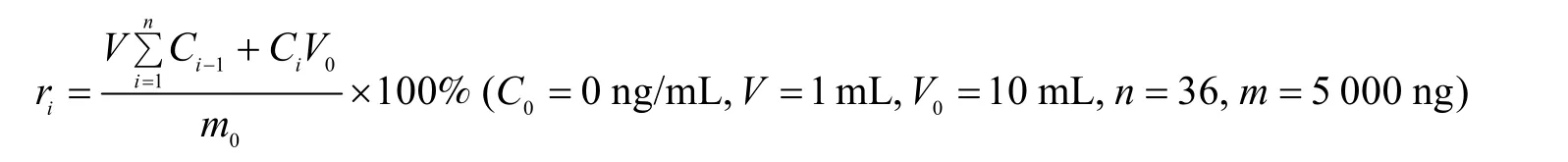
1.8 雪旺氏细胞在神经支架上的粘附与增殖
雪旺氏细胞的分离、培养与纯化,及 MTT法均参照文献报道的方法进行[22-23]。在神经支架与雪旺氏细胞共培养15 d后,取出材料进行SEM观察。
2 结果
2.1 猪皮来源ECM观察
苏木精-伊红 (HE) 染色,是一种传统而经典的组织学方法,可以将细胞核物质染成紫色,将其余物质染成粉红色。从图1可以看出,新鲜猪皮 (图1A) 相对致密,其中零星分布着一些细胞,ECM (图1B) 较为疏松,无细胞。这可以说明本研究中所使用的 ECM 实现了去细胞的目的。SEM观察结果显示,与新鲜猪皮 (图1C) 相比,ECM (图1D) 中胶原纤维的排列较为疏松,纤维的直径为1~10 μm左右,纤维间缝隙的宽度为5~50 μm左右,这就为制备内部具有相互联通的蜂窝状结构的神经支架提供了充分的前提条件,同时也为NGF 明胶微球进入其内部以构建NGF缓释体系创造了条件。
2.2 神经支架的形态和结构
本神经支架的孔隙率为 68.3%~81.2%,密度为0.62~0.68 g/cm3。空隙率是神经支架的重要指标之一。但是并不能直接地用于评价神经支架的优劣。因为支架内部孔隙的大小、相互间的连通性、均质程度,才与雪旺氏细胞和轴突是否能够顺利地在支架内部穿行和进行物质交换直接相关。同时,在支架的降解过程中,以及在巨噬细胞的吞噬过程中,支架内部会有新的空隙形成。再者,过高的孔隙率意味着支架质地过于疏松,会导致质地脆弱,难以耐受移植过程中的手术操作,以及术后的组织压迫和牵拉。所以,孔隙率的指标需要与支架的力学性质及内部结构相结合,以评价神经支架形态的合理性。
SEM观察显示,PLGA在神经支架表面 (图2A) 形成膜状结构,同时在表面形成一系列分布较为均匀的直径介于1~5 μm的孔隙。这些孔隙主要是在材料制备过程中,在负压作用下由溶质挥发所形成的。这种尺度的孔隙允许神经支架内部横向就近与组织环境进行物质交换,但细胞无法通过。这种结构或许可以改善神经损伤修复中,移植体内部与组织环境间的物质交换问题,这无疑会有益于轴突的再生。细胞无法在这些孔隙中通过,对轴突的有序生长是有益的。因此本神经支架的表面形态符合神经再生的要求。
神经支架的断面 (图2B) 很难发现ECM中的胶原纤维,这表明PLGA已经渗入ECM内部,并在孔隙内表面形成膜状结构,由此推测,NGF明胶微球和赖氨酸也被 PLGA包封起来从而形成一种有效的NGF、赖氨酸缓释体系。断面 (图2B) 中可以观察到直径为8 μm左右的圆球状颗粒,这是完整的NGF明胶微球。还可以观察到直径为0.5 μm左右的粉末状颗粒,它们可能是明胶微球在支架加工成型过程中崩解所造成的。这些粉末可能是 NGF、明胶、赖氨酸的混合物。不过,仍有理由相信,它们也被 PLGA在表面进行了轻度的覆盖。它们的存在可能会导致支架在降解的早期对NGF暴释。在支架的断面 (图2B) 中体现出了众多远大于10 μm的孔隙,这为雪旺氏细胞及轴突的侵入提供了足够的内部空间。
2.3 力学性质
材料的力学性质也是神经支架的重要性质之一。在移植过程中需要耐受手术操作而保持形态,在移植后也需要耐受肌肉收缩等原因所导致的拉伸和挤压。猪皮来源的ECM主要由于胶原纤维构成,具有很好的机械强度。PLGA具有较好的刚性。在ECM和PLGA所组成的复合材料中,韧性主要由胶原所决定,硬度由PLGA决定。二者的含量以及混合的均匀程度都会导致复合材料力学性质的变化。本神经支架的断裂强度为8.308 MPa,断裂伸长率为38.98%,弹性模量为97.27 MPa. 这说明其强度高,具有一定的弹性,硬度适中。
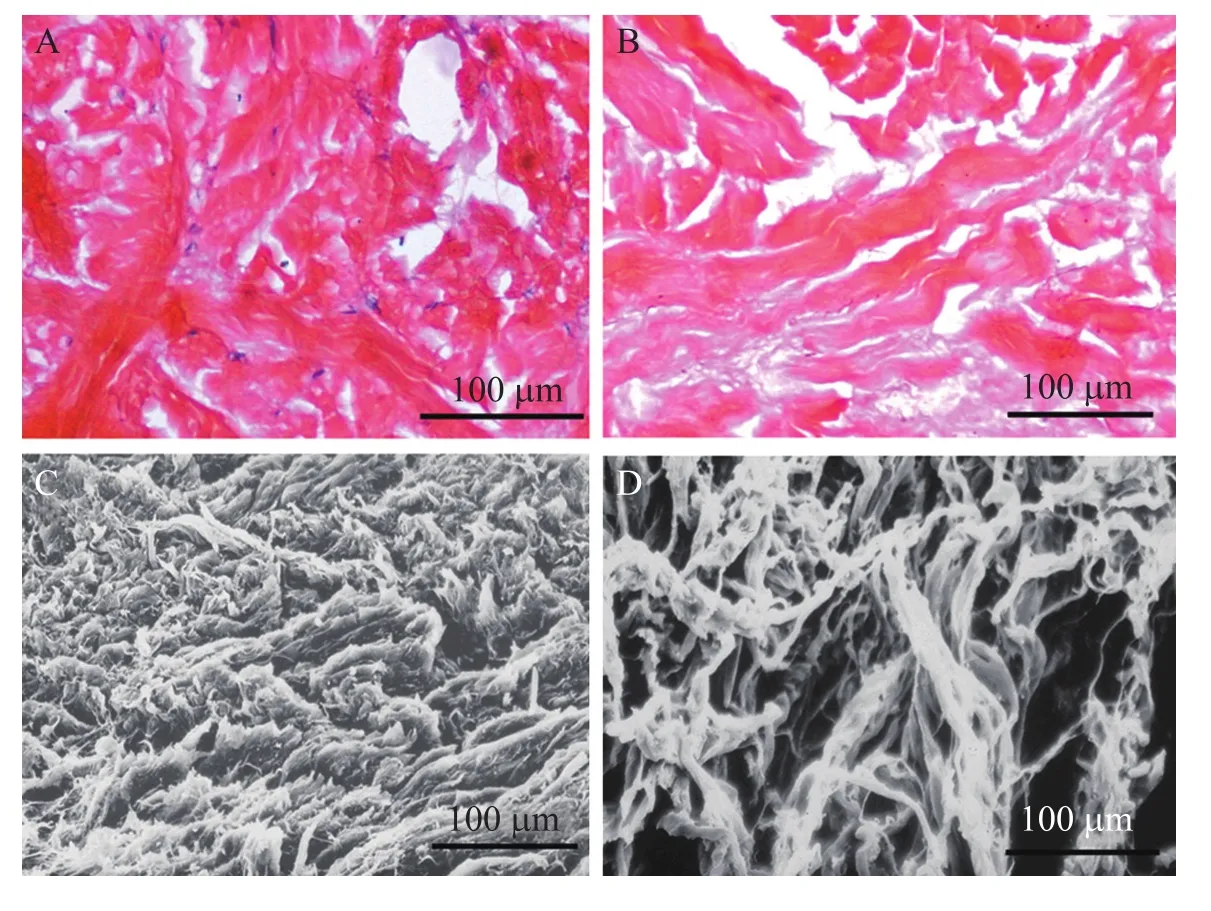
图1 新鲜猪皮与猪皮来源的ECM的内部形态Fig. 1 Morphology of fresh pigskin and acellular pigskin. (A) Fresh pigskin (HE staining). (B) ECM (HE staining). (C) Fresh pigskin (SEM). (D) ECM (SEM).

图2 神经支架的形态Fig. 2 Structure of the scaffold (SEM). (A) Surface. (B) Cross section.
2.4 降解性质
在PBS中降解4周后发现,神经支架的最大吸水率为126%,最大失重率为43.3%,而对照组猪皮来源的ECM的最大吸水率为300%,最大失重率为9.9% (图3)。支架中的PLGA逐步降解,在第4周时几乎仅剩下ECM的成分 (图4)。这表明此时的支架应该已经不具备对 NGF和赖氨酸的持续释放功能,如果希望要延长这样的过程,则在支架的制备中需要增加PLGA的含量。在8周的考察期中 (图5),降解液中的pH体现出了一个逐步缓慢降低的趋势,相对于对照组 (PLGA) 而言,支架组的pH 降低的趋势较为平缓。这表明赖氨酸在支架中的添加能中和PLGA降解过程中所释放的弱酸性物质,以稳定环境pH。赖氨酸的释放应该在4周左右结束 (图4D),但是,在4~8周的降解过程中 (图5),支架组降解液的pH仍略高于对照组 (PLGA),这或许是猪皮来源ECM的降解性质所决定的。
2.5 支架对NGF的缓释性质
支架对NGF的缓释曲线 (图6) 显示,在第1天属于NGF的暴释期,累积释放量占整个考察期 (30 d) 累积释放率 (38%) 的40%左右。在开始1周的累积释放量占考察期 (30 d) 累积释放率 (38%) 的60%左右。
2.6 雪旺氏细胞在神经支架上的粘附与增殖
将支架与雪旺氏细胞共培养7 d,以单独培养的雪旺氏细胞作为对照 (Control),同时在另一实验组中一次性添加NGF。结果 (图7) 显示,在各组中雪旺氏细胞的增殖趋势相同,但是仍体现出细胞数量的不同。细胞增殖速度由低到高的排列顺序依次为:对照组、支架组、单独添加NGF组。这一结果表明支架中NGF保持了生物活性。将支架与雪旺氏细胞通过15 d的共培养,能够观察到雪旺氏细胞在支架表面的粘附 (图8)。
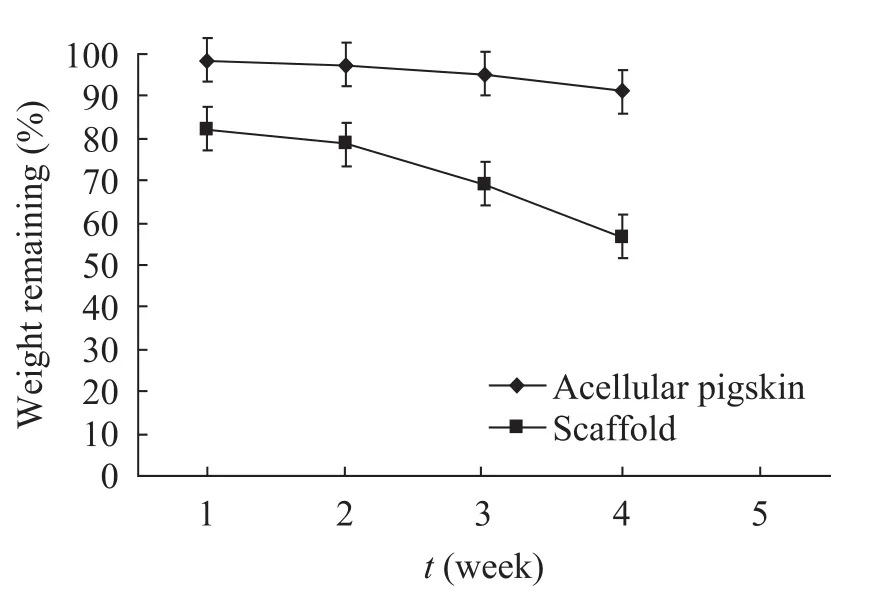
图3 神经支架质量的残留率 (失重率)Fig. 3 Weight remaining of the scaffolds and PLGA.
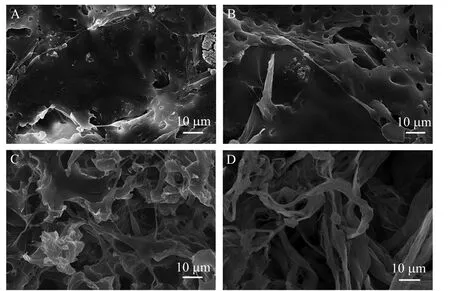
图4 支架在降解过程中的形态变化Fig. 4 Changes of the scaffold surface during degradation in PBS solution. (A) 1 week. (B) 2 weeks. (C) 3 weeks. (D) 4 weeks.
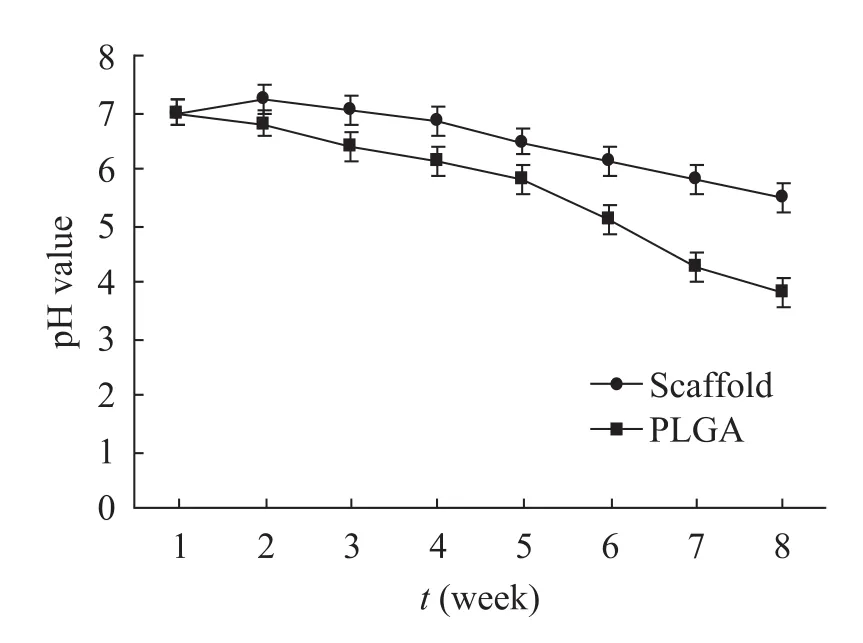
图5 支架在水中降解的过程中环境pH的变化Fig. 5 Changes of pH value in degradation solution.

图6 支架对NGF的缓释作用Fig. 6 NGF release ratio of the scaffold.
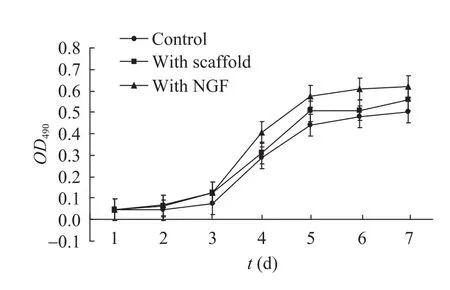
图7 雪旺氏细胞的MTT试验Fig. 7 MTT assay of schwan cells.
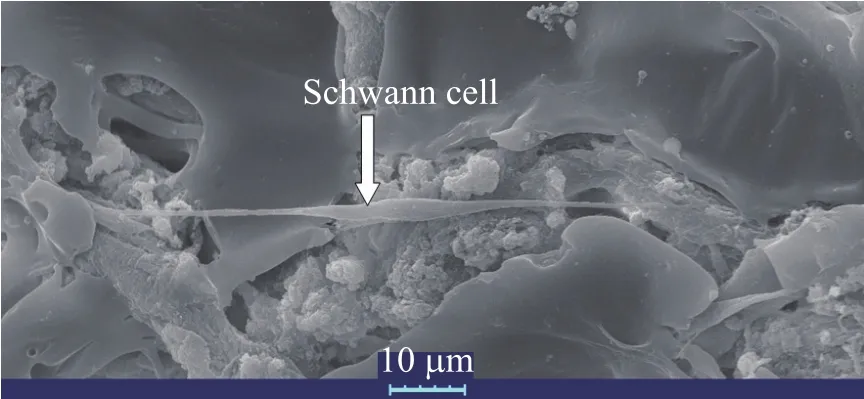
图8 雪旺氏细胞在支架表面的粘附Fig. 8 Schwann cell adhering to the scaffold.
3 结论
研究结果表明,本研究所制备的复合材料具有如下性质:适宜的强度、弹性和硬度;内部蜂窝状结构;易降解;对NGF的缓释功能;保持了NGF的生物活性;对PLGA降解过程中所产生的酸性物质具有一定的中和作用;对雪旺氏细胞有较好的亲和性。这些性质都是神经支架所需要满足的条件,因此有望成为一种新型的促周围神经损伤修复支架。
REFERENCES
[1] Schmidt CE, Leach JB. NEURAL TISSUE ENGINEERING: strategies for repair and regeneration. Annu Rev Biomed Eng, 2003, 5: 293−347.
[2] Xu HF, Shao ZW, Wu YC, et al. Effects of self-assembled IKVAV peptide nanofibers on olfactory ensheathing cells. Chin J Biotech, 2009, 25(2): 292−298.徐会法, 邵增务, 吴永超, 等. 自组装 IKVAV多肽纳米纤维支架凝胶及其对嗅鞘细胞的作用. 生物工程学报, 2009, 25(2): 292−298.
[3] Li M, Wu BY, Hu XY, et al. Genipin crosslinked preparation of new peripheral nerve tissue engineered scaffolds and comparison of their biological characteristics. Chin J Trauma, 2010, 26(2): 165−170.李沫, 吴邦耀, 胡学昱, 等. 以京尼平交联制备新型人工神经支架材料及其生物学特性的对比研究. 中华创伤杂志, 2010, 26(2): 165−170.
[4] Tang ZP, Chen XY, Tang RH. Current application of scaffold materials for nerve tissue engineering. J Clin Rehabil Tissue Eng Res, 2008, 12(1): 189−192.唐洲平, 陈兴泳, 唐荣华. 神经组织工程生物支架材料的应用现状. 中国组织工程研究与临床康复, 2008, 12(1): 189−192.
[5] Zheng HY, Huang JF, Chen ZH, et al. Experimental rarely of nerve allograft through the application of slow-releasing film with FK506/NGF/RGD composites. Chin J Clin Anat, 2009, 27(2): 212−215.征华勇, 黄继锋, 陈庄洪, 等. 复合FK506/NGF/RGD缓释膜应用于同种异体神经移植的实验研究. 中国临床解剖学杂志, 2009, 27(2): 212−215.
[6] Xie XT, Zhang CQ. Biological and artificial nerve conduit for repairing peripheral nerve defect. Neural Regen Res, 2006, 1(4): 372–374.
[7] Shi ZD, Liu MW, Qin ZZ, et al. Appcation of a venous conduit as a stent for repairing rabbit facial nerve injury. Neural Regen Res, 2007, 2(12): 717–721.
[8] Gu XS, Ding F, Yang YJ, et al. Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration. Prog Neurobiol, 2010, 93(2): 204–230.
[9] Zhao S, Gong X, Li GY. Influence of different pigskin degreasing methods on collagen yield. Chin Leath, 2007, 36(9): 33−36.赵帅, 巩旭, 李国英. 猪皮的不同脱脂方法对胶原提取率的影响. 中国皮革, 2007, 36(9): 33−36.
[10] Gao ST, Deng ZS, Li BJ, et al. Comparison of different chemical methods for preparation of acellular nerve scaffold. Chin J Rep Recon Surg, 2008, 22(7): 851−853.高嵩涛, 邓展生, 李宝军, 等. 不同去细胞神经支架制备方法的对比研究. 中国修复重建外科杂志, 2008, 22(7): 851−853.
[11] Kitchell JP, Wise DL. Poly (lactic/glycolic acid) biodegradable drug-polymer matrix systems. Methods Enzymol, 1985, 112: 436−448.
[12] Li J, Yan QJ, Xu Y, et al. Preparation and characterization of nerve graft material poly[LA-(Glc-Lys)]/NGF/β-TCP. Funct Mater, 2007, 38(Suppl): 1851−1853.李娟, 严琼姣, 徐盈, 等. 人工神经支架材料聚(羟基乙酸-L-赖氨酸-乳酸)/NGF/β-TCP复合膜的制备及性能研究. 功能材料, 2007, 38(Suppl): 1851−1853.
[13] Dong NR, Huang JF, Zheng HY, et al. Regeneration of rat sciatic nerve promoted by sustained-release diaphragm of RGD peptide grafted poly[LA-(Gic-Lys)], FK506 and nerve growth factor. Chin J Orthop Trauma, 2008, 10(11): 1066−1069.董能让, 黄继锋, 征华勇, 等. 乳酸-羟基乙酸-L-赖氨酸多肽接枝聚复合 FK506和神经生长因子缓释膜促进大鼠坐骨神经再生的实验研究. 中华创伤骨科杂志, 2008, 10(11): 1066−1069.
[14] Liu B, Cai SX, Ma KW, et al. Fabrication of a PLGA-collagen peripheral nerve scaffold and investigation of its sustained release property in vitro. J Mater Sci: Mater Med, 2008, 19: 1127−1132.
[15] Li SH, Cai SX, Liu B, et al. In vitro characteristics of poly (lactic-co-glycolic acid) microspheres incorporating gelatin particles loading basic fibroblast growth factor. Acta Pharmacol Sin, 2006, 27(6): 754−759.
[16] Zhou JQ, Chen SG, Zhu ZK. Kinetics model of spherical immobilized cellulase. Chin J Biotech, 2005, 21(5): 799−803.周建芹, 陈实公, 朱忠奎. 微球载体固定化纤维素酶的反应动力学模型研究. 生物工程学报, 2005, 21(5): 799−803.
[17] Gates BD, Xu QB, Stewart M, et al. New approaches to nanofabrication: molding, printing, and other techniques. Chem Rev, 2005, 105(4):1171–1196.
[18] Ainslie KM, Desai TA. Microfabricated implants for applications in therapeutic delivery, tissue engineering, and biosensing. Lab Chip, 2008, 8(11): 1864–1878.
[19] Feng L, Wu HL, Ma P, et al. Development and optimization of oil-filled lipid nanoparticles containing docetaxel conjugates designed to control the drugmrelease rate in vitro and in vivo. Int J Nanomed, 2011, 6: 2545–2556.
[20] Caldorera-Moore M, Guimard N, Shi L, et al. Designer nanoparticles: Incorporating size, shape, and triggered release into nanoscale drug carriers. Expert Opin Drug Deliv, 2010, 7(4): 479–495.
[21] Hsu YY, Gresser JD, Trantolo DJ. Effect of polymer foam morphology and density on kinetics of in vitro controlled release of isoniazid from compressed foam matrices. J Biomed Mater Res, 1997, 35(1): 107−116.
[22] Ivanov AE, Kumar A, Nilsang S, et al. Evaluation of boronate-containing polymer brushes and gels as substrates for carbohydrate-mediated adhesion and cultivation of animal cells. Colloids Surf B Biointerfaces, 2010, 75(2): 510−519.
[23] Wang Z, Luo J, Wang W, et al. Characterization and culture of isolated primary dairy goat mammary gland epithelial cells. Chin J Biotech, 2010, 26(8): 1123−1127.王桢, 罗军, 王伟, 等. 奶山羊乳腺上皮细胞的分离、培养及鉴定. 生物工程学报, 2010, 26(8): 1123−1127.

