转基因动物生物安全研究与评价
许建香,李宁
中国农业大学 农业生物技术国家重点实验室,北京 100193
自从20世纪80年代以来,生物安全问题深受国际上的广泛关注。经过近20年的讨论,《卡塔赫纳生物安全议定书》于2000年5月出炉,旨在解决转基因生物 (Genetically modified organism,GMO) 的潜在危害。GMO包括转基因微生物和动植物,其中转基因动物的生物安全性受到了国际动物健康组织的极大关注。此后,各国研究机构和组织非常关注转基因动物的生物安全性,政府也出台了相应的法律、法规来规范转基因动物及其产品的研究与应用。
随着动物转基因技术的发展和应用,转基因动物及其产品的安全性已受到了人们的广泛关注,其核心问题集中于环境安全、动物健康与福利、人类健康与食品安全等方面。此外,人们在转基因生物安全的研究与评价中,逐渐摸索出了一套公认的生物安全评价原则,在此基础上,各国也逐渐形成了相应的生物安全评价政策和程序,以下对这些内容分别进行阐述。
1 转基因动物生物安全研究与评价的主要内容
1.1 转基因动物的研究与应用
各国对转基因动物的研究与应用集中于农业、医学、工业等方面。总体来说,转基因动物的研究与应用主要包括新品种培育、异种器官移植、动物生物反应器和疾病模型等。
1.1.1 新品种培育
“超级小鼠”的研究成功掀起了转基因动物新品种培育的研究热潮。目前,人们已在转基因动物新品种培育方面取得了可喜的成果,比如转植酸酶基因猪 (环保猪)[1],可分泌植酸酶 (肌醇六磷酸酶),把磷元素释放出来,用于猪的生长发育,同时可降低猪排泄物中的含磷水平,降低磷对环境的污染;Aquabounty公司生产的转生长激素基因鲑鱼 (Aquadvantage salmon,AAS)[2],可提高鲑鱼的生长速度,缩短鲑鱼的生长周期,具有良好的经济价值;朊蛋白 (Prion protein,PRNP) 基因敲除牛[3],可很好地抵抗疯牛病的传染;表达短发卡RNA的转基因鸡[4-5],可抑制或阻断流感病毒多聚酶,从而阻止禽流感的传播等。
1.1.2 异种器官移植
供体器官来源不足和人类移入的器官往往会发生免疫排斥现象一直是困扰医学界的难题。猪作为人类器官移植的供体,在解剖、组织和生理等方面与人类最为接近,其器官和人的器官大小相仿,并且具有易饲养、易操作等优势,因此已成为人们研究异种器官移植的理想材料。目前,人们已通过基因打靶和体细胞核移植技术,成功获得了α-1,3-半乳糖苷酶基因敲除猪[6],可直接阻止猪细胞表面α-1,3-半乳糖的合成,从而消除猪器官移入人体后发生的一个主要障碍——免疫排斥反应。
1.1.3 动物生物反应器
人们可通过转基因动物来生产珍贵的多肽或蛋白类药物,这种转基因动物被称为动物生物反应器,主要包括乳腺、膀胱、血液、唾液、禽蛋、家蚕等类型的生物反应器。其中,乳腺生物反应器是目前发展最成熟的一种模式,也是一种具有高额经济利润的新型产业。比如目前人们可利用动物乳腺生物反应器来生产功能性因子IX[7]、人因子 VIII[8]、人因子 IX[9],人抗血栓素[10]等各种药物蛋白和重组抗体[11];改善奶的营养成分[12-16];生产用于手术缝合线或国防装备的新型生物材料 (生物钢)[17-18];生产高附加值的工业品[19-21]等。
1.1.4 动物疾病模型
转基因动物疾病模型的研究可用于阐释人类疾病的发生机制,从而建立有效治疗措施的实验动物模型。动物转基因技术的出现,可为人类精确地研究基因与疾病的相互关系提供可能,而且可在个体发生的每个阶段中使用任何个体进行遗传功能分析。因此,转基因动物疾病模型的开发已成为转基因动物研究的热点之一。
转基因动物疾病模型在研究人类疾病中起着非常重要的作用,其优点在于可避免人体实验造成的危害,提供发病率低、潜伏期长、病程长的疾病材料,从而可代替传统的动物模型进行药物筛选、肿瘤研究、病毒性疾病探索、代谢性和传染性疾病研究、基因治疗等方面。目前,转基因动物疾病模型可在整体水平上从时空四维角度同时观察基因表达功能和表型效应,已成为人类疾病研究的良好动物疾病模型。
1.2 转基因动物生物安全的研究与评价
各国在研究转基因动物的同时,也非常关注转基因动物及其产品对环境安全、动物健康与福利、人类健康与食品安全等方面的潜在威胁。
1.2.1 环境安全评价
转基因动物环境安全性涉及动物逃逸、基因水平转移、木马基因效应等因素。
1) 动物逃逸对环境的影响
转基因动物在放牧饲养、散养或逃逸时与同类野生动物交配可以将转入的基因遗传下去,从而会对生物多样性造成影响。
已有报道认为[22],转基因动物中昆虫逃逸的可能性是最高的,其次是鱼类,转基因家畜相对来说逃逸的可能性小。
就目前的研究水平来说,即使对于转基因昆虫和鱼类这样一些逃逸可能性最大的动物来说,也可通过物理、生理和生物等技术手段来综合控制[23]。转基因鱼类尚且如此,那么转基因家畜逃逸对环境的影响具有很高的可控性,即可通过物理等控制措施防止其逃逸。
2) 基因水平转移对环境的影响
基因水平转移 (Horizontal gene transfer,HGT) 常见于微生物之间,植物和动物虽然发生HGT的现象很少,但也存在HGT的可能性,比如转基因动物有可能会通过肠道系统将外源基因转入肠道菌中;转基因动物在饲养过程中有可能会通过接触、交配、分娩和泌乳等行为产生HGT现象。当然,人们可通过各种方式将HGT对环境影响的可能性降到最低,比如上文所述的各种控制动物逃逸的措施。目前已有的研究结果尚未发现转基因动物发生HGT的现象,我们的研究证明了转基因奶牛中的外源基因不会通过基因水平转移现象转移到奶牛肠道菌群和土壤微生物群落中[24],Wheeler等的研究证明了转基因猪中的外源基因不会通过接触、交配、分娩和泌乳等行为发生基因水平转移现象[25]。
3) 木马基因效应对环境的影响
木马基因效应 (Trojan gene effect) 是用来形象地描述转基因的有意或无意释放对环境造成的毁灭性影响。研究表明,快速生长的转基因鱼虽然具有野生鱼无法比拟的繁殖优势,但这种鱼的后代死亡率却很高 (约为野生鱼死亡率的 3倍),利用计算机模型将此结果进行模拟得出的结论是,如果有60尾转基因鱼进入60 000尾野生鱼群中,只要40代时间就可导致该种群灭绝。因此,Muir等将转入的基因比喻为“木马基因(Trojan genes)”,意指转入鱼体内的外源基因会像特洛伊木马攻克特洛伊城一样导致野生鱼类种群的灭绝[26-27]。
事实上,木马基因效应只是计算机模拟所得的假说,由于生态风险评价的复杂性,至今还没有令人信服的实验证据证明快速生长的转基因鱼对鱼类种质资源和生态环境具有破坏性。为避免可能的风险问题,将转基因鱼培育成不育的三倍体可能是一种切实可行的手段,比如Aquabounty公司生产的转基因鲑鱼 (AAS),研究人员将其培育成了不育的三倍体鱼,这种鱼即使逃逸到环境中也不会与其他鱼类杂交而造成基因扩散与污染[23]。
1.2.2 动物健康状况分析
评价转基因动物的健康状况时要考虑以下内容。
1) 基因整合位点和细胞体外过程对动物健康的影响:目前转基因动物生产中应用最多的两种方法是原核显微注射法和体细胞核移植(Somatic cell nuclear transfer,SCNT) 技术。这两种技术的缺点是对外源基因的行为无法控制,外源基因的整合位点是随机的,整合拷贝数也是无法控制的,因此这种外源基因的随机整合可能会对动物健康带来潜在风险:① 掩盖邻近调控元件,发生异常的表达模式 (位点效应),包括不表达、过量表达和异常表达等[28]。② 当基因碰巧整合进具有重要功能的基因之中时,就干扰了基因的正常表达 (沉默整合),从而影响转基因动物的正常发育与代谢。当基因的整合激活有害基因表达时 (毒性整合),会导致胚胎畸形或死亡。
细胞的体外过程可能会导致动物生长缺陷、基因甲基化增加、蛋白表达受挫等异常现象的发生[29]。有些异常表现还可能会遗传给后代[30]。也可能会引起机体有害的副反应,如“超级后代综合征 (Large offspring syndrome,LOS)”,LOS会导致妊娠期流产率提高、先天性畸形增加、出生体重增加、妊娠期延长和产后死亡率提高等
现象[31-32]。
事实上,随着转基因动物研究的深入和发展,以上问题目前均可得到控制,新近发展起来的基因打靶技术 (也叫定点基因重组) 可实现基因的定点整合[33-36],从而解决基因随机整合带来的问题;LOS主要是血清中的IGF2引起的,目前可通过使用无血清培养基来防范 LOS的发生[37]。
2) 插入基因表达对动物健康的影响有:① 插入基因突变会导致动物发育畸形甚至死亡[38-39];② 外源基因插入可能会使动物体内严格的基因表达调控发生变化,导致异位或异时表达,从而影响动物健康[40];③ 转基因的过表达可能会导致动物发育异常、行为异常、泌乳异常等现象。
3) 转基因的非预期性效应对动物健康的影响:非预期性效应 (Unintentional effect) 是指科学家难以预测的、不确定性因素和长期效应。转基因的这种非预期性效应只能通过长期的实践研究和统计观察来反映。
综上所述,只有彻底了解转基因对动物健康造成的危害,才能开发出新的技术和方法来从根本上解决这些危害,比如新出现的基因打靶技术,可解决基因随机整合对动物健康造成的危害。转基因的非预期性效应只能经过生物安全的长期研究和分析来规避。
1.2.3 动物福利问题
动物福利概念由 5个基本要素组成:1) 生理福利,即无饥渴之忧虑;2) 环境福利,也就是要让动物有适当的居所;3) 卫生福利,主要是减少动物的伤病;4) 行为福利,应保证动物表达天性的自由;5) 心理福利,即减少动物恐惧和焦虑的心情。
按照国际公认标准,动物被分为农场动物、实验动物、伴侣动物、工作动物、娱乐动物和野生动物六类。世界动物卫生组织尤其强调了农场动物和实验动物的福利,指出农场动物是供人吃的,但在成为食品之前,它们在饲养和运输过程中,或者因卫生原因遭到宰杀时,其福利都不容忽视;实验动物是供科研用的,但在科研过程中,要践行善待动物的理念。
转基因动物属于实验动物,在其福利问题上很难同时兑现以上5个基本要素,损害它们的健康往往是研究的必经过程。
转基因动物的福利研究是与转基因动物的健康研究紧密相关的,任何影响转基因动物健康的因素也是影响转基因动物的福利状况的重要原因 (比如插入突变、转基因的过表达或异位表达、转基因的操作技术等)[28]。
目前,各国都非常重视动物福利问题,尤其是转基因技术对动物福利带来的影响备受关注。在动物痛苦与科研需求之间,目前广获认同的平衡点是3R原则,即替代 (Replacement:使用低等动物代替高等动物,或不使用活体脊椎动物进行实验)、减少 (Reduction:把使用动物的数量降低到实现科研所需的最小量)、优化(Refinement,通过改善饲养、实验条件等,尽量减少对动物机体的损伤,减轻它们的痛苦和应激反应)。
1.2.4 食品安全评价
1991年,联合国粮农组织和世界卫生组织联合组织了专家讨论会,专门讨论转基因动物的食品安全评价方法[41]。之后,有关食品安全评价问题在国外受到了系统的研究和探讨,并建立了一套标准的评价体系[42],以下对这种评价体系进行概述。
1) 转基因动物食品的来源:评价转基因动物食品的首要任务是评价食品的来源和特性:① 受体动物的来源和特性;② 外源基因的来源和特性;③ 外源基因的结构和遗传修饰;④ 转基因动物的安全性;⑤ 遗传修饰特性;⑥ 关键成分分析;⑦ 转基因动物的健康状况。
2) 转基因动物食品的致敏性评价:食品的致敏性是对食品成分的异常免疫反应,其产生的负作用可从中度刺激到致死性过敏休克。食品的致敏性通常由免疫球蛋白E (Immunoglobulin E,IgE) 抗体家族介导[43-44]。转基因动物食品致敏性评价的要点是:① 蛋白来源;② 氨基酸序列同源性;③ 免疫试验;④ 生理生化特性;⑤ 其他。致敏性分析中除了以上要点外,还包括蛋白的安全使用史,未来新开发的方法和工具,动物模型的开发[45-48],T细胞抗原决定部位预测,IgE交叉反应预测,蛋白三维结构信息预测致敏性等[49]。
事实上,很多传统食品具有致敏性。目前人们已知的致敏性食物不少于160种,其中常见的有8种,即花生、大豆、牛奶、鸡蛋、鱼、甲壳类动物、小麦和坚果[50],因为尽管多数人吃了这些食物没事,一部分人吃了也还存在一定风险,甚至致死。
3) 转基因动物食品的毒性和生物活性评价:基因插入动物之前,首先要考虑插入基因中是否包含表达毒性或抗营养因子的基因。大多化学因子诱导的毒性作用具有一个毒性域值,即实验动物毒性研究中常见的无可测不利影响水平(No observed adverse effect level,NOAEL)。食品安全评价中会建立一个允许日摄入量(Acceptable daily intake,ADI) 水平,ADI是衍生于NOAEL的一种安全使用域值[49]。
传统的食品因为经过了几千年的食用历史,因此通常不会进行毒性评价。转基因动物食品的毒性和生物学活性研究中一般根据实质等同性(Substantial equivalent) 原则,将其与传统的同等产品进行比较,如果其功能和生物学活性与传统食品没有差异则认为是安全的。当转基因动物中外源基因表达的蛋白与传统食品中的蛋白出现差异时,可进一步通过实验动物对其进行口服毒性研究。对于非蛋白成分的潜在毒性可根据个案分析 (Case by case) 的原则进行毒物动力学(Toxicokinetics)、急性/亚慢性/慢性毒性 (Acute/ Sub-chronic/Chronic toxicity) 和 致 癌 性(Carcinogenicity) 分析、免疫学 (Immunological)分析、繁殖和发育毒性分析等[42,51]。
与致敏性食物类似,很多传统食品实际上对人类也有不同程度的毒性,如蘑菇、河豚、接骨木、蓖麻油、杏仁、樱桃、李子、苹果、大黄、土豆等等。这些食品的部分或组成均具有不同的毒性成分,比如人们常吃的苹果,其种子含有氰化物,一个苹果的种子不会毒死人,但是,只要吃得多完全有可能中毒死亡。
4) 转基因动物食品的组成分析:根据实质等同性原则,在相同的饲养环境下,比较其与传统食品的关键成分[49]。
5) 转基因动物食品安全评价中的其他要素:转基因动物食品安全评价中要考虑的其他要素包括异源物质或微生物的累积、抗性基因的使用、营养成分的改变、食品储存和加工等[49]。
2 转基因动物生物安全评价的主要原则
2.1 实 质 等 同 性 原 则 (Substantial equivalence)
自从 1993年经济合作与发展组织(Organization for economic co-operation and development,OECD) 在转基因食品安全中提出“实质等同性”概念以来[42],实质等同性已被很多国家在转基因生物安全评价上广泛采纳。实质等同性的意思是指转基因物种或其食物与传统物种或食物具有同等安全性。对于转基因动物来说,实质等同性是指转基因动物或转基因动物食品与传统的动物或食品在安全性上没有差异。
转基因动物生物安全评价中,实质等同性要比较的主要内容有:1) 生物学特性。包括各发育时期的生物学特性和生命周期食性、遗传、繁殖方式和繁殖能力;迁移方式和能力;建群能力;泌乳能力;形态和健康状况;对人畜的攻击性、毒性等;在自然界中的存活能力;对生态环境影响的可能性。2) 营养成分。包括主要营养因子(脂肪、蛋白质、碳水化合物、矿物质、维生素等)、抗营养因子 (影响人对食品中营养物质吸收和对食物消化的物质)、毒素 (对人有毒害作用的物质)、过敏原 (造成某些人群食用后产生过敏反应的一类物质) 等。
总之,转基因动物与传统动物相比,除了目的基因外,其他指标没有显著差别就是实质等同性。然而,Millstone等于1999年对“实质等同性”原则提出异议,他们认为“实质等同性”的概念不清楚,容易引起误导[52]。Millstone等的观点是:要用最终食品的化学成分来评价食品的安全性,而不管转基因作物或转基因食品的整个生产过程的安全性,包括人体健康安全和生态环境安全,只要某一转基因食品成分与市场上销售的传统食品成分相似,则认为该转基因食品同传统食品一样安全,就没有必要做毒理学、过敏性和免疫学试验。但就目前的科学水平而言,科学家还不能通过转基因食品的化学成分准确地预测它的生化或毒理学影响。因此,实质等同性依然被大家广泛采用。目前,转基因动物安全评价中将实质等同性原则与其他评价原则结合起来使用。
2.2 个案分析原则 (Case by case)
因为转基因生物及其产品中导入的基因来源、功能各不相同,受体生物及基因操作也可能不同,所以必须有针对性地逐个进行评价,即个案分析原则。目前世界各国大多数立法机构都采取了个案分析原则。
2.3 预防原则 (Precautionary)
虽然尚未发现转基因生物及其产品对环境和人类健康产生危害的实例,但从生物安全角度考虑,必须将预先防范原则作为生物安全评价的指导原则,结合其他原则来对转基因动物及其产品进行风险分析,提前防范。
2.4 逐步深入原则 (Step by step)
转基因动物及其产品的开发过程需要经过实验研究、中间试验、环境释放和商业化生产等环节。因此,每个环节上都要进行风险评价和安全评价,并以上步实验积累的相关数据和经验为基础,层层递进,确保安全性。
2.5 科学基础原则 (Science-based)
安全评价不是凭空想象的,必须以科学原理为基础,采用合理的方法和手段,以严谨、科学的态度对待。
2.6 公正、透明原则 (Impartial and transparent)
安全评价要本着公正、透明的原则,让公众信服,让消费者放心。
3 各国现行的转基因动物生物安全评价政策和程序
各国对于转基因动物的研究和生产具有严格的管理政策和审批程序。以下分别就国外主要国家 (或组织联盟) 和中国的政策与程序进行阐述。
3.1 国际食品法典委员会
国际食品法典委员会 (Codex alimentarius commission,CAC) 是由联合国粮农组织和世界卫生组织共同建立,以保障消费者的健康和确保食品贸易公平为宗旨的一个制定国际食品标准的政府间组织。随着生物技术的发展,CAC也相应地制定了有关生物制品的食用安全评价标准[53]。2008年,CAC在瑞士的日内瓦召开了第31届CAC食品大会,对以上食品安全评价标准重新进行了修正[54],文件的附录 II专门就转基因动物源食品的安全评价进行了规范[55]。
CAC对转基因食品具有非常严格的评价程序,从开始文件提交到最后审批通过要经过8个阶段[56](图1),转基因动物源食品也不例外。
3.2 欧盟
欧洲委员会 (European committee,EC) 委托欧洲食品安全署 (European food safety authority,EFSA) 就转基因动物对于食品、饲料、环境、动物健康与人类安全等带来的潜在风险进行评价。EFSA参照国际标准 (比如CAC标准),发布了一系列有关转基因动物及其产品风险评价的初步指导文件,这些文件包括食品与饲料安全、环境安全、动物健康和人类安全等,其中转基因动物 (鱼类、鸟类及哺乳动物) 的环境安全评价最详尽,预计将来会被正式采纳实施。
欧盟对转基因产品 (包括转基因动物产品)的评价程序基本遵循 CAC的程序,目前EFSA尚未接到任何有关转基因动物及其产品的申请文件。
3.3 美国
美国食品和药物管理局 (Food and drug administration,FDA) 出台并颁发了一系列有关转基因动物生物安全的管理措施和指导文件,其中最重要的是2009年1月15日发布的187号终稿文件[57],是有关转基因动物生物安全管理的指导性文件。
美国的转基因动物及其产品上市前要经历从产品定义到批准等一系列严格的审批程序[58](图2)。
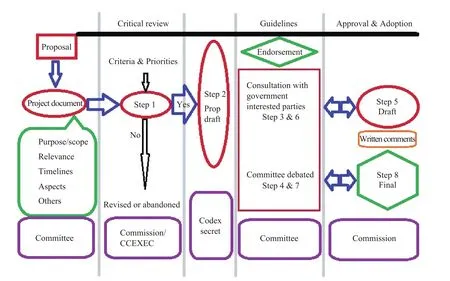
图1 CAC对转基因食品的评价程序Fig. 1 Evaluated process of CAC for food derived from biotechnology.
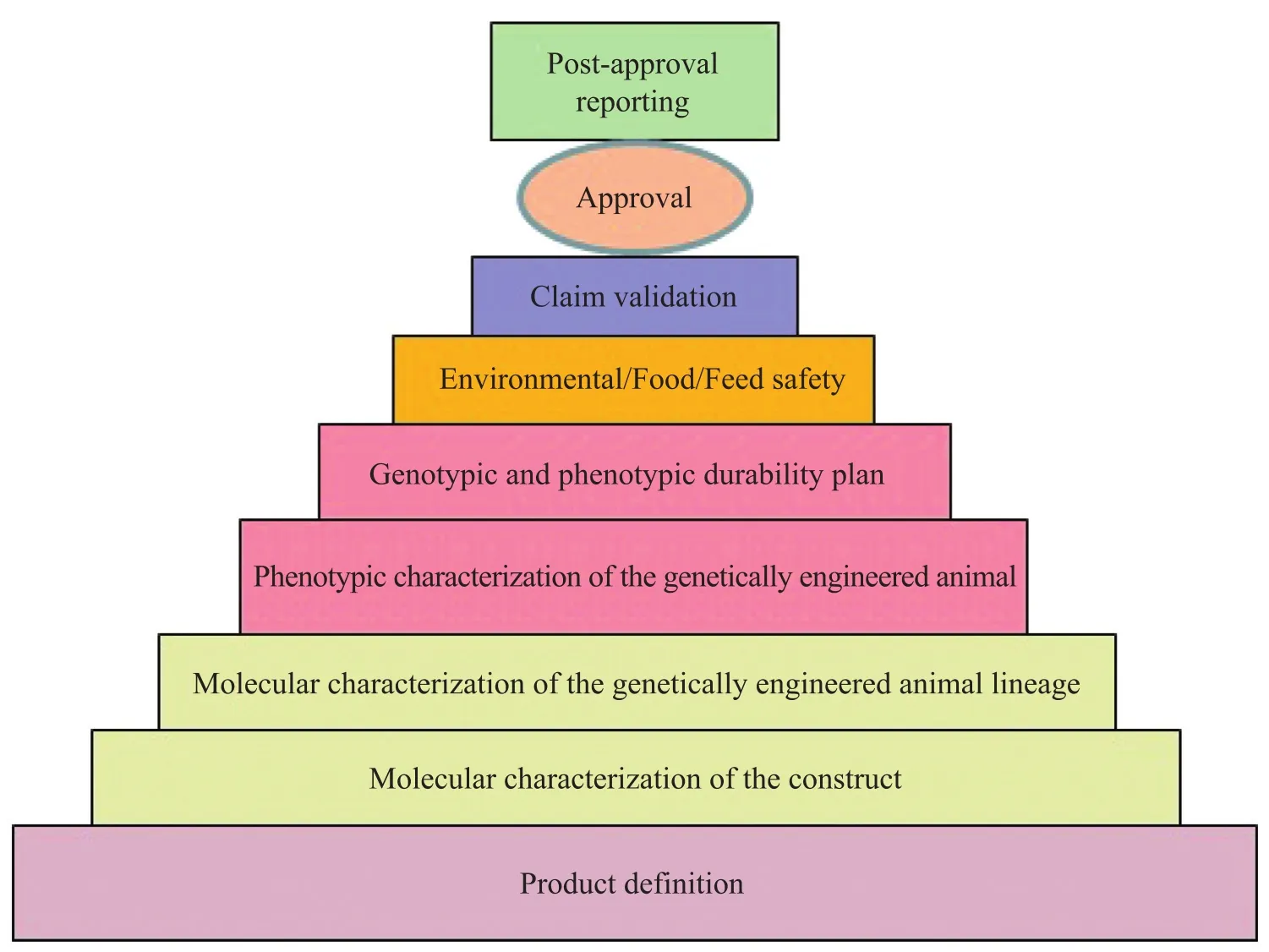
图2 美国FDA对转基因动物及其产品的审批程序Fig. 2 Approval process of FDA for genetically engineered animals and derived products.
3.4 日本
日本社会各界非常重视转基因动物的研究与开发,同时也制定了相应的法律文件来对其进行规范。参照《卡塔赫拉生物安全议定书》的要求,日本于 2004年出台了有关转基因的法律文件,文件将转基因分为1型和2型两类,1型转基因的环境释放不受管制,2型转基因的环境释放受严格管理。其中有关转基因动物尤其是转基因家畜的研究受日本科教文体部 (Ministry of education,culture,sports,science and technology,MEXT) 的联合管制,环境释放受日本农林渔业部 (Ministry of agriculture,forest and fisheries,MAFF) 管制,MEXT从实验研究方面对转基因家畜的研究与开发进行严格规范,MAFF从环境风险方面对转基因家畜的环境释放进行严格管理[59]。
日本对转基因食品所实行的是“垂直监管为主、地方监管为辅”的模式。在此种模式下,食品安全委员会、厚生劳动省、农林渔业部(MAFF) 分别就各自职责对转基因食品实行垂直管理,地方政府则负责本区域内转基因食品问题的综合协调管理。日本有关转基因动物及其产品的审批程序主要参照欧盟和美国FDA的标准,采取比较折中的措施来管理。
3.5 中国
中国自从 1979年起出台了一系列有关生物安全的管理办法,其中值得一提的是 2001年 5月 23日,国务院颁发了《农业转基因生物安全管理条例》,该条例涉及转基因动物、植物和微生物的安全管理。
2002年1月5日,农业部发布了第8号令,颁发了《农业转基因生物安全评价管理办法》,自2002年3月20日起施行。该令的附录2为《转基因动物安全评价办法》,专门对转基因动物的生物安全评价进行了规范和指导,该办法明确规定中国的转基因动物及其产品上市前要经过实验研究、中间试验、环境释放、生产性试验、安全证书等审批程序。
4 源于转基因动物的市场化产品
4.1 已上市的转基因动物制品
4.1.1 抗血栓素药物-ATryn
美国GTC公司生产的一种抗血栓素的药物(ATryn) 先后于2006年和2009年分别被欧盟和FDA批准上市[60],打开了新时代农业与医药堡垒的大门[61]。
ATryn是通过转基因山羊乳腺生物反应器生产的一种抗血栓素药物。截止药物批准之时,GTC公司已生产并扩繁了200多头转基因山羊,可谓药物的“活体工厂”。
4.1.2 遗传性血管水肿治疗药物-Ruconest
2010年10月,荷兰的Pharming公司生产的Ruconest成为第 2个获得欧洲药品管理局(European medicines agency,EMA) 批准的转基因动物生产药物。
Ruconest是由转基因兔生产的单克隆抗体药物,是一种人C1酯酶抑制蛋白 (C1 inhibitor,C1INH) 的重组体,被批准用于遗传性血管水肿(Hereditary Angioedema,HAE) 的治疗。HAE是一种人类遗传缺陷病,患者缺乏一种功能性血浆C1酯酶抑制蛋白 (C1INH),最终导致免疫系统的过度反应,具有在面部、四肢、生殖器、腹腔和上呼吸道急性发作的特点[62]。因此,Ruconest为HAE患者带来了福音。
Ruconest已于2010年12月首次在丹麦和挪威上市,瑞典的 Sobi公司 (Swedish Orphan Biovitrum) 负责欧洲市场的销售和宣传普及[63]。
4.2 有望上市的转基因动物产品
4.2.1 荧光斑马鱼 (Glofish)
荧光斑马鱼 (Glofish) 是新加坡国立大学研制、美国约克镇公司生产的一种会发荧光的观赏鱼,也可用于环境污染指示物[64]。Glofish已于2003年12月9日得到了FDA的初步认可[65],并在一些宠物店试卖[66]。
科学家将绿色荧光蛋白基因 (Green fluorescent protein,GFP)、红色荧光蛋白基因(Red fluorescent protein,RFP) 和黄色荧光蛋白(Yellow fluorescent protein,YFP) 基因分别导入斑马鱼体内,从而得到各种荧光闪闪,异彩纷呈的转基因斑马鱼[64]。
4.2.2 环保猪 (Enviropig)
环保猪 (Enviropig) 是加拿大圭尔夫大学研发的,能更有效地利用植物性饲料中的磷元素(而普通猪种却不能消化利用),从而减轻磷对环境的污染问题[1]。磷元素一般与有机物结合存在于植物性饲料中,如果通过粪便大量排泄,就可能污染地表水和地下水。环保猪可以分泌植酸酶(肌醇六磷酸酶),把磷元素释放出来,用于猪的生长发育。这样就不需要再额外添加昂贵的无机磷营养素或饲喂商品植酸酶,同时也降低了猪排泄物中的含磷水平。
4.2.3 转基因鲑鱼 (Aquadvantage salmon,AAS)
美国 Aquabounty公司生产的转基因鲑鱼(AAS) 生长迅速,体型巨大,饲养成本低,肉质更健康,该公司2009年向美国FDA提出申请,目前7个审核部门中,已有5个通过了检测,初步的分析报告中,FDA表示其维生素,矿物质及脂肪酸含量和普通鲑鱼并无区别。2010年 9月20日,FDA发布了有关AAS的概述,初步认可了AAS的安全性[67]。转基因鲑鱼能否顺利通过美国FDA的认证,目前尚未可知。
4.2.4 “人乳化”牛奶及其相关产品
我们实验室已将人α-乳清白蛋白、人乳铁蛋白、人溶菌酶等基因转入奶牛体内,生产出了能在乳腺中稳定表达人α-乳清白蛋白、人乳铁蛋白和人溶菌酶的转基因奶牛[13-15],从而使牛奶中的人乳铁蛋白、人溶菌酶和人α-乳清白蛋白等营养蛋白更接近母乳,使得牛奶“人乳化”,因此被称为“人乳化”牛奶。
经中国疾病预防控制中心食品研究所和中国农业大学食品学院等权威机构的安全性检测表明[68-71],这种“人乳化”牛奶与其他牛奶没有差别,不存在任何安全性的问题;同时功能试验表明,“人乳化”牛奶具有促进铁和钙吸收、改善胃肠道功能、促进机体生长发育、增强免疫力等重要功能。
目前,我们实验室通过奶牛乳腺生物反应器生产的这种“人乳化”牛奶已完成了初试、中试阶段和大部分生物安全评价工作[24,68-70,72],有关部门正在进行“人乳化”牛奶制品进入市场前的评审工作,目前我们实验室已完成乳铁胃康胶囊、生物补血口服液、抗非小细胞肺癌口服药等产品临床前研究及小规模试生产,但大规模的批量生产尚未开始。
5 展望
虽然转基因动物具有潜在的风险问题,但相比转基因动物的优势来说,这种潜在风险是阻挡不了转基因动物研究和产业化发展步伐的。此外,安全是个相对概念,即便是人们经常食用的传统食品以及不少药品,也存在风险,并不是绝对安全的,比如文中所述的花生、大豆、牛奶、鸡蛋等致敏性食物和蘑菇、河豚、杏仁、土豆等毒性食物。因此,“零风险”的食品是不存在的。事实上,生物安全是一种个案处理事件,这就是要评价的原则也是评价的基础。随着理论和技术的发展,转基因安全问题也能够得到解决和控制。
著名科学家Murray和Maga认为[73],转基因动物研究的目的正是为了解决很多安全问题,如果停止转基因动物的研究,安全隐患反而会更多。因为转基因动物的利要远远大于弊,英国皇家学会从 2001年就开始呼吁:要生产更多的转基因动物 (Bold call for more GE animals)[74]。相信随着各国政府对转基因动物研究的大力支持和正确引导,科普宣传加深民众对转基因动物技术的理解,转基因动物的研究及其产品的应用必将为人们带来更多福音。
未来,各国政府会形成一套明确的法规体系来约束和规范转基因动物及其产品的研究、加工、运输、上市、进出口等活动,保障转基因动物及其产品的安全性,为人类、社会乃至动物本身带来福利。
REFERENCES
[1] Golovan SP, Meidinger RG, Ajakaiye A, et al. Pigs expressing salivary phytase produce lowphosphorus manure. Nat Biotechnol, 2001, 19(8): 741−745.
[2] Fletcher GL, Shears MA, Yaskowiak ES, et al. Gene transfer: potential to enhance the genome of Atlantic salmon for aquaculture. Aust J Exp Agri, 2004, 44(11): 1095−1100.
[3] Kuroiwa Y, Kasinathan P, Matsushita H, et al. Sequential targeting of the genes encoding immunoglobulin-μ and prion protein in cattle. Nat Genet, 2004, 36(7): 775−780.
[4] Lyall J, Irvine RM, Sherman A, et al. Suppression of avian influenza transmission in genetically modified chickens. Science, 2011, 331(6014): 223−226.
[5] Enserink M. Transgenic chickens could thwart bird flu, curb pandemic risk. Science, 2011, 331(6014): 132−133.
[6] Lai LX, Kolber-Simonds D, Park KW, et al. Production of α-1, 3-galactosyltransferase knockout pigs by nuclear transfer cloning. Science, 2002, 295(5557): 1089−1092.
[7] Lindsay M, Gil GC, Cadiz A, et al. Purification of recombinant DNA-derived factor IX produced in transgenic pig milk and fractionation of active and inactive subpopulations. J Chromatogr A, 2004, 1026(1/2): 149−157.
[8] Paleyanda RK, Velander WH, Lee TK, et al. Transgenic pigs produce functional human factor VIII in milk. Nat Biotechnol, 1997, 15(10): 971−975.
[9] Schnieke AE, Kind AJ, Ritchie WA, et al. Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts. Science, 1997, 278(5346): 2130−2133.
[10] Zhou Q, Kyazike J, Echelard Y, et al. Effect of genetic background on glycosylation heterogeneity in human antithrombin produced in the mammary gland of transgenic goats. J Biotechnol, 2005, 117(1): 57−72.
[11] Pollock DP, Kutzko JP, Birck-Wilson E, et al. Transgenic milk as a method for the production of recombinant antibodies. J Immunol Methods, 1999, 231(1/2): 147−157.
[12] Noble MS, Rodriguez-Zas S, Cook JB, et al. Lactational performance of first-parity transgenic gilts expressing bovine alpha-lactalbumin in their milk. J Anim Sci, 2002, 80(4): 1090−1096.
[13] Yang PH, Wang JW, Gong GC, et al. Cattle mammary bioreactor generated by a novel procedure of transgenic cloning for large-scale production of functional human lactoferrin. PLoS One, 2008, 3(10): e3453.
[14] Yang B, Wang JW, Tang B, et al. Characterization of bioactive recombinant human lysozyme expressed in milk of cloned transgenic cattle. PLoS One, 2011, 6(3): e17593.
[15] Wang JW, Yang PH, Tang B, et al. Expression and characterization of bioactive recombinant human α-lactalbumin in the milk of transgenic cloned cows. J Dairy Sci, 2008, 91(12): 4466−4476.
[16] Maga EA, Shoemaker CF, Rowe JD, et al. Production and processing of milk from transgenic goats expressing human lysozyme in the mammary gland. J Dairy Sci, 2006, 89(2): 518−524.
[17] Vollrath F, Knight DP. Liquid crystalline spinning of spider silk. Nature, 2001, 410(6828): 541−548.
[18] Karatzas CN, zhou JF, Huang Y, et al. Produnction of recombinant spider silk in the milk of genetically engineered animals. Transgenic Res, 1999, 8: 476−477.
[19] Powell BC, Walker SK, Bawden CS, et al. Transgenic sheep and wool growth: possibilities and current status. Reprod Fertil Dev, 1994, 6(5): 615−623.
[20] Bawden CS, Powell BC, Walker SK, et al. Expression of a wool intermediate filament keratin transgene in sheep fibre alters structure. Transgenic Res, 1998, 7(4): 273−287.
[21] Bawden CS, Dunn SM, McLaughlan CJ, et al. Transgenesis with ovine keratin genes: expression in the sheep wool follicle for fibres with new properties. Transgenic Res, 1999, 8: 474.
[22] NRC. Animal Biotechnology: Science Based Concerns. Washington, DC: National Academies Press, 2002: 82−83.
[23] ABT. Environmental assessment for Aquadvantage® salmon[EB/OL]. [2011-11-13]. http://www.fda.gov/downloads/AdvisoryCommittee s/CommitteesMeetingMaterials/VeterinaryMedicine AdvisoryCommittee/UCM224760.pdf.
[24] Xu JX, Zhao J, Wang JW, et al. Molecular-based environmental risk assessment of three varieties of genetically engineered cows. Transgenic Res, 2011, 20(5): 1043−1054.
[25] Wheeler MB, Hurley WL, Mosley J, et al. Risk analysis of alpha-lactalbumin transgene transfer to non-transgenic control pigs during rearing, breeding, parturition and lactation. Transgenic Res, 2010, 19(1): 136−137.
[26] Muir WM, Howard RD. Possible ecological risks of transgenic organism release when transgenes affect mating success: sexual selection and the Trojan gene hypothesis. Proc Natl Acad Sci USA, 1999, 96(24): 13853−13856.
[27] Muir WM, Howard RD. Assessment of possible ecological risks and hazards of transgenic fish with implications for other sexually reproducing organisms. Transgenic Res, 2002, 11(2): 101−114.
[28] Van Reenen CG, Meuwissen THE, Hopster H, et al. Transgenesis may affect farm animal welfare: A case for systematic risk assessment. J Anim Sci, 2001, 79(7): 1763−1779.
[29] Reik W, Römer I, Barton SC, et al. Adult phenotype in the mouse can be affected by epigenetic events in the early embryo. Development, 1993, 119(3): 933−942.
[30] Roemer I, Reik W, Dean W, et al. Epigenetic inheritance in the mouse. Curr Biol, 1997, 7(4): 277−280.
[31] Campbell KH, McWhir J, Ritchie WA, et al. Implications of cloning. Nature, 1996, 380(6573): 383.
[32] Wilson JM, Williams JD, Bondioli KR, et al. Comparison of birth weight and growth characteristics of bovine calves produced by nuclear transfer (cloning), embryo transfer and natural mating. Anim Reprod Sci, 1995, 38(1/2): 73−83.
[33] Moore RC, Redhead NJ, Selfridge J, et al. Double replacement gene targeting for the production of a series of mouse strains with different prion protein gene alterations. Nat Biotechnol, 1995, 13(9): 999−1004.
[34] McCreath KJ, Howcroft J, Campbell KHS, et al. Production of gene-targeted sheep by nuclear transfer from cultured somatic cells. Nature, 2000, 405(6790): 1066−1069.
[35] Bibikova M, Golic M, Golic KG, et al. Targeted chromosomal cleavage and mutagenesis in Drosophila using zinc-finger nucleases. Genetics, 2002, 161(3): 1169−1175.
[36] Dai YF, Vaught TD, Boone J, et al. Targeted disruption of the α1,3-galactosyltransferase gene in cloned pigs. Nat Biotechnol, 2002, 20(3): 251−255.
[37] Farin CE, Farin PW, Piedrahita JA. Development of fetuses from in vitro–produced and cloned bovine embryos. J Anim Sci, 2004, 82(Suppl 13): E53−E62.
[38] Woychik RP, Stewart TA, Davis LG, et al. An inherited limb deformity created by insertional mutagenesis in a transgenic mouse. Nature, 1985, 318(6041): 36−40.
[39] Overbeek PA, Lai SP, Van Quill KR, et al. Tissue-specific expression in transgenic mice of a fused gene containing RSV terminal sequences. Science, 1986, 231(4745): 1574−1577.
[40] Tian XL, Chen LY. Problems in transgenic animals research. Chin Biotech Prog, 1995, 15(5): 41−45.田小利, 陈兰英. 转基因动物研究中存在的问题.生物工程进展, 1995, 15(5): 41−45.
[41] FAO/WHO. Strategies for assessing the safety of foods produced by biotechnology: report of the joint FAO/WHO consultation. 1991.
[42] OECD. Safety Evaluation of Foods Derived by Modern Biotechnology: Concepts and Principles. OECD Publishing, 1993: 1−80.
[43] Helm RM, Burks AW. Mechanisms of food allergy. Curr Opin Immunol, 2000, 12(6): 647−653.
[44] Miescher SM, Vogel M. Molecular aspects of allergy. Mol Aspects Med, 2002, 23(6): 413−462.
[45] Knippels LM, Penninks AH, Spanhaak S, et al. Oral sensitization to food proteins: a Brown Norway rat model. Clin Exp Allergy, 1998, 28(3): 368−375.
[46] Dearman RJ, Warbrick EV, Humphreys IR, et al. Characterization in mice of the immunological properties of five allergenic acid anhydrides. J Appl Toxicol, 2000, 20(3): 221−230.
[47] Prescott VE, Forbes E, Foster PS, et al. Mechanistic analysis of experimental food allergen-induced cutaneous reactions. J Leukoc Biol, 2006, 80(2): 258−266.
[48] Weber E, Hunter S, Stedman K, et al. Identification, characterization, and cloning of a complementary DNA encoding a 60-kd house dust mite allergen (Derf 18) for human beings and dogs. J Allergy Clin Immunol, 2003, 112(1): 79−86.
[49] Lema MA, Burachik M. Safety assessment of food products from r-DNA animals. Comp Immunol Microbiol Infect Dis, 2009, 32(2): 163−189.
[50] Hefle SL, Nordlee JA, Taylor SL. Allergenic foods. Crit Rev Food Sci Nutr, 1996, 36: S69−S89.
[51] Barlow SM, Greig JB, Bridges JW, et al. Hazard identification by methods of animal-based toxicology. Food Chem Toxicol, 2002, 40(2/3): 145−191.
[52] Millstone E, Brunner E, Mayer S. Beyond 'substantial equivalence'. Nature, 1999, 401(6753): 525−526.
[53] CAC. Principle for the risk analysis of food derived rom modern biotechnology (CAC/GL 44-2003) [EB/OL]. [2011-11-13]. http://www. codexalimentarius.net/download/standards/10007/C XG_044e.pdf.
[54] CAC. Joint FAO/WHO food standards programme/Codex alimentarius commission (31stsession, Alinorm 08/31/34)[EB/OL]. [2011-11-13]. http://www.codexalimentarius.net/download/report/ 693/al31_34e.pdf.
[55] CAC. Guideline for the conduct of food safety assessment of foods derived from reco-mbinant DNA animals (CAC/GL 68-2008)[EB/OL]. [2011-11-13]. http://www.codexalimentarius.net/ download/standards/11023/CXG_068e.pdf.
[56] CAC. Report of the 1stsession of the codex ad hoc intergovernmental task force on a-ntimicrobial resistance(Alinorm 08/31/42) [EB/OL]. [2011-11-14]. http://www.codexalimentarius.net/download/ report/692/al31_42e.pdf
[57] CVM. Guidance for industry 187: Regulation of genetically engineered animals containing heritable recombinant DNA constructs. US FDA, 2009, Final Guidance. Jan. 15, 2009.
[58] Melanie M. CVM uses seven-step process to evaluate safety, effectiveness of GE animals. FDA Veterinarian Newsletter, 2008, XXIII(VI).
[59] Yamanouchi K. Regulatory considerations on transgenic livestock in Japan in relation to the Cartagena protocol. Theriogenology, 2007, 67(1): 185−187.
[60] GTC. Freedom of information summary original new animal drug application[EB/OL]. [2011-11- 13]. http://www.fda.gov/downloads/AnimalVeterinary/ Products/ApprovedAnimalDrugProducts/FOIADru gSummaries/ucm116146.pdf.
[61] Pollack A. F.D.A. approves drug from gene-altered goats[EB/OL]. [2011-11-13]. http://www. nytimes. com/2009/02/07/business/07goatdrug.html.
[62] Sobi. Pharming's Ruconest™ for HAE granted European marketing authorization [EB/OL]. [2011-11-13]. http://www.sobi.com/Global/News%20 Item%c2%b4s/101028%20EC%20de-cision%20Ru conest.pdf.
[63] Sobi. Swedish Orphan Biovitrum and Pharming announce first sales of Ruconest in Eu-rope[EB/OL]. [2011-11-13]. http://www.sobi. com/Global/News%20Item%c2%b4s/101228%20Fi rst%20sales%20Ruconest%20SOBI%20vs.pdf.
[64] Gong ZY, Wan HY, Tay TL, et al. Development of transgenic fish for ornamental and bioreactor by strong expression of fluorescent proteins in the skeletal muscle. Biochem Biophys Res Commun, 2003, 308(1): 58−63.
[65] FDA. FDA statement regarding glofish[EB/OL]. [2011-11-13]. http://www.fda.gov/AnimalVeterinary/ DevelopmentApprovalProcess/GeneticEngineering/ GeneticallyEngineeredAnimals/ucm161437.htm
[66] Pollack A. Gene-altering revolution nears the pet store: glow-in-the-dark fish[EB/OL]. [2011-11-13]. http://www.nytimes.com/2003/11/22/science/22FIS H.htm.
[67] ABT. Briefing packet for Aquadvantage salmon[EB/OL]. [2011-11-13]. http://www.fda. gov/downloads/AdvisoryCommittees/Committees MeetingMaterials/VeterinaryMedicineAdvisoryCo mmittee/UCM224762.pdf.
[68] Zhou C, Wang JW, Huang KL, et al. A 90-day safety study in Sprague-Dawley rats fed milk powder containing recombinant human lactoferrin (rhLF) derived from transgenic cloned cattle. Drug Chem Toxicol, 2011, 34(4): 359−368.
[69] Qi XZ, Wang J, Zhou C, et al. Effect of transferred human lactoferrin milk powder on serum iron and ferritin in rats. Food Sci, 2010, 31(23): 340−343.祁潇哲, 王静, 周催, 等. 较长期喂养转人乳铁蛋白全乳粉对SD大鼠血清铁、铁蛋白含量的影响. 食品科学, 2010, 31(23): 340−343.
[70] Wang J, Zhou C, Che HL. Study on sub-chronic toxicity of powered milk containing transgenic lactoferrin on SD rats. Prog Mod Biomed, 2010, 10(15): 2809−2813.王静, 周催, 车会莲. 含转人乳铁蛋白奶粉对SD大鼠亚慢性毒性的研究. 现代生物医学进展, 2010, 10(15): 2809−2813.
[71] Wang XD, Liu S, Yan WX, et al. Effect of recombinant human lactoferrin on improving the growth of rats. Chin J Food Hyg, 2011, 23(2): 105−108.王小丹, 刘珊, 严卫星, 等. 重组人乳铁蛋白对大鼠生长发育作用的研究. 中国食品卫生杂志, 2011, 23(2): 105−108.
[72] Yu T, Guo CD, Wang JW, et al. Comprehensive characterization of the site-specific N-glycosylation of wild-type and recombinant human lactoferrin expressed in the milk of transgenic cloned cattle. Glycobiology, 2011, 21(2): 206−224.
[73] Murray JD, Maga EA. Is there a risk from not using GE animals? Transgenic Res, 2010, 19(3): 357−361.
[74] Williams N. Bold call for more GM animals. Curr Biol, 2001, 11(12): R451.

