甘露聚糖结合凝集素诱导DC成熟机制分析①
王凡平 王明永 杨建斌 赵东方 王红坡 邵 峰 孙瑞利 郭庆合 凌明智 赵永新宋士军 郭继强 (新乡医学院医学检验系,新乡453003)
甘露聚糖结合凝集素(Mannan-binding lectin,MBL)是由肝细胞分泌的血浆蛋白,为天然免疫系统中的关键分子[1]。近年来一些研究发现,MBL作为C型凝集素家族的重要成员和天然免疫中的关键分子,除了其固有的抗感染作用外,还发挥多种免疫调节作用[2-7]。陈月等[8]研究发现,MBL 能够诱导树突状细胞(Dendritic cell,DC)成熟,但机制并不明了。已报道,DC成熟过程中,模式识别受体Toll样受体(Toll-like receptors,TLRs)的表达发生改变;文献有报道,与MBL同为胶凝素家族成员的补体C1q能够通过核转录因子NF-κB信号途径诱导DC成熟[9]。MBL诱导DC成熟是否也与TLRs和NF-κB有关呢?需深入研究。
本研究以 TLRs和NF-κB为切入点,旨在初步探讨MBL诱导DC成熟机制。
1 材料与方法
1.1材料 人血浆天然MBL按文献[10]制备;rh-GM-CSF和rhIL-4购自Pepro-Tech公司。PE标记的鼠抗人CD1a、CD80及CD86单克隆抗体(mAb),FITC标记的鼠抗人 CD83、CD86及 MHC-DR的mAb,同型 FITC-IgG1、PE-IgG1阴性参照抗体均为eBioscience公司产品。RPMI1640及尼龙毛柱购自Gibco公司;淋巴细胞分离液(Ficoll,密度1.077)为上海试剂二厂生产;新生牛血清(Newborn calf serum,NCS)购自杭州四季青生物工程材料研究所;鼠抗人 NF-κB mAb p65、抗 β-actin兔多克隆抗体及HRP-羊抗鼠IgG购自Sigma公司;鼠抗人MBL pAb购自R&D公司;核蛋白提取试剂盒为Pierce公司产品,凝胶电泳迁移率变动分析(EMSA)测定试剂盒为Promega公司产品;[γ32-P]ATP为北京亚辉生物试剂公司产品;结合缓冲液:20 mmol/L Tris-HCl(pH8.0)、150 mmol/L NaCl、1 mmol/L CaCl2、2 mmol/L MgCl2、5 g/L BSA、1 g/L 叠氮钠;其它化学试剂均为进口或国产分析纯产品;FACSCalibur流式细胞仪为美国BD公司产品。
1.2方法
1.2.1人外周血Mo的获取 取健康成人志愿者的外周血,肝素抗凝后,用Ficoll密度梯度离心法分离单个核细胞。以PBS洗去血小板,于37℃贴壁3小时后弃上清,以37℃预温的RPMI1640轻洗去除非贴壁的细胞,刮取贴壁的黏附细胞即为Mo,用含10%NCS的 RPMI1640调整细胞密度为1×109个/L。
1.2.2DC的体外诱导 向Mo悬液中加入rhGMCSF和rhIL-4,分3组进行DC培养。常规组:只加rhIL-4和rhGM-CSF培养7天;MBL刺激组:培养5天后加入MBL(10 mg/L)继续培养2天;MBL+Anti-MBL刺激组:培养5天后加入MBL(10 mg/L)和Anti-MBL pAb继续培养2天;人血清白蛋白(HSA)刺激组(阴性对照):培养5天后加入HSA继续培养2天。在诱导DC的过程中,每3天半量换液并补充相应的细胞因子,于倒置显微镜下观察细胞形态。7天后收集悬浮的细胞,分析DC的表型及功能。
1.2.3DC的表型分析 用预冷PBA(0.01 mol/L PBS+20 g/L BSA+0.1 g/L NaN3)洗涤不同实验组诱导7天后的悬浮细胞并调整细胞密度为5×109个/L。于100 μl细胞悬液中,分别加入两两组合的标记抗体,即 PE-抗 CD1a和 FITC-抗 CD83、PE-抗CD80 和 FITC-抗CD40、PE-抗 CD86 mAb 和 FITC-抗MHC-DR mAb各20 μl,同时设 PE和 FITC标记的小鼠IgG1抗体作为对照,于4℃避光标记30分钟后,用预冷PBA洗涤2次。最后用500 μl PBS悬浮细胞,于流式细胞仪上分析DC的表型。
1.2.4制备FITC-MBL 按照文献[11],采用透析法,以FITC标记MBL,标记产物FITC-MBL的F/P比值为2.4。
1.2.5细胞结合试验 imDC用A缓冲液(调整Ca2+浓度分别为 1 mmol/L、5 mmol/L,或者用 5 mmol/L EDTA代替CaCl2)重悬并调整细胞密度为5 ×109个/L,于200 μl细胞悬液中加入 FITC-MBL,37℃避光反应30分钟。选择用人血浆MBL生理浓度的上限15 mg/L作为实验中MBL用量的标准浓度。

表1 引物序列及RT-PCR产物的大小Tab.1 Primer sequence and sizes of RT-PCR products
1.2.6RT-PCR分析DC TLR2、TLR4 mRNA的表达 细胞总RNA的制备:分别取上述体外诱导的各实验组1×107个细胞,用无菌PBS洗1次,按Trizol法操作指南提取总RNA。以1%琼脂糖凝胶电泳鉴定其完整性,用紫外分光光度仪测定其 OD260nm/OD280nm比值。统一调整总RNA浓度为0.15 mg/ml,立即反转录合成cDNA。PCR引物的设计与合成:参考文献[12]并经Primer premier 5.0软件分析,由上海博亚公司合成TLR2、TLR4和GAPDH等3对特异性引物(序列见表1)。GAPDH作为内参照。cDNA合成:分别取不同实验组DC总RNA各1 μg、5 × RT Buffer 4 μl、dNTP Mixture(各 10 mol/L)2 μl、RNase inhibitor(10 U/ μl)1 μl、Oligo(dT)20(10 pmol/ μl)1 μl和 ReverTra Ace 1 μl,加 RNase Free H2O至总反应体积20 μl。42℃反应20分钟合成cDNA第一链,99℃ 5分钟灭活反转录酶终止反应,4℃ 5分钟复性。PCR:反应体系为:10×buffer 2 μl、dNTPs 2 μl(各 0.25 mol/L),上、下游引物各 1 μl(10 μmol/L),模板 cDNA 1.5 μl,Taq DNA 多聚酶(5 U/μl)0.2 μl,加 DEPC 处理水至总反应体积20 μl。TLR2的PCR反应条件为:94℃变性30秒,60℃退火15秒,72℃延伸90秒,循环35次。TLR4的PCR反应条件为:94℃变性30秒,60℃退火25秒,72℃延伸1分钟,循环35次。GAPDH的 PCR反应条件为:94℃变性30秒,63℃退火30秒,72℃延伸1分钟,循环35次。取各PCR扩增产物5 μl于1%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察、拍照,并用凝胶成像仪分析DNA片段的灰度值。
1.2.7EMSA和 Western blot分析 NF-κB细胞核移位 ①EMSA分析:按照Pierce公司提供的试剂盒说明书进行细胞核蛋白的提取,采用Bradford法检测提取液蛋白浓度,核蛋白-70℃冻存备用。根据Promega公司提供的EMSA检测试剂盒说明书进行各组细胞NF-κB活性的检测。探针的制备:分别按顺序取1.75 mol/ml NF-κB特异性核苷酸2 μl、10×T4多聚核苷酸激酶缓冲液1 μl、3 000 Ci/mmol[γ32-P]ATP 1 μl、无核酸酶蒸馏水 5 μl和 5 ×103~1 ×104U/μl的 T4 多聚核苷酸激酶 1 μl,混匀后于37℃水浴中反应10分钟,加入0.5 mol/L EDTA 1 μl终止反应,并加入 89 μl TE 缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH7.9),混匀置4℃保存。特异及非特异性竞争实验:在加入标记探针前,先加未标记的特异性探针(NF-κB寡核苷酸探针),并逐渐增加未标记的探针浓度(特异性竞争实验);在加入标记探针前,先加入未标记的非特异性探针,并逐渐增加未标记的非特异性探针浓度(非特异性竞争实验)。于室温反应10分钟使探针与NF-κB结合,再进行PAGE。电泳后,取下凝胶制得干胶,于-70℃放射自显影12小时。②Western blot分析:5 μg细胞核蛋白提取物进行12%SDSPAGE,样品经SDS-PAGE分离后;恒压60 V转移3小时;转移后的PVD膜浸入含3%脱脂奶粉的PBST中封闭2小时;再将膜浸入1∶500稀释的鼠抗人NF-κB mAb p65中,室温反应60分钟;洗膜5次;加1∶1 500稀释的HRP-羊抗鼠IgG,室温反应60分钟。洗涤后以DAB显色试剂盒显色,终止反应,阴干后拍照。
在诸城市龙都街道大源社区,集林木种苗栽植、绿化工程施工、现代林业、旅游观光于一体的生态园林公司——大源园林生态园,现已建成7200多亩。该项目是由山东大源建设集团投资5亿元,与大黑龙沟等6个自然村联合,采用“企业+社区+合作社+农户”的模式规划建设,整体占地10000亩。目前,该园区可提供60多个品种的瓜果采摘,带动当地400多名老百姓就业,全年约接待游客20万人次。让林区变景区、田园变公园,农产品变旅游商品,大源园林生态园实现了园区旅游收益和农户采摘收益的“双丰收”,构建起“企业+农户”“林业+旅游”和谐发展的新局面。
1.3统计学分析 应用SPSS13.0软件包进行统计处理,计量资料用
2 结果
2.1MBL对DC表面标志表达的影响 流式细胞仪分析(图1)发现,与常规组相比较,MBL刺激组中CD83+、CD86+和MHC-DR+DC的数量均显著增多,加入抗MBL pAb,MBL的刺激效应消失。
2.2MBL以Ca2+依赖方式结合imDC FCM分析表明,MBL在无Ca2+、或含EDTA的结合缓冲液中几乎不与imDC细胞结合,而在分别含1 mmol/L、5 mmol/L的结合缓冲液中,MBL与imDC的结合逐渐增强,呈Ca2+浓度依赖关系(图2)。
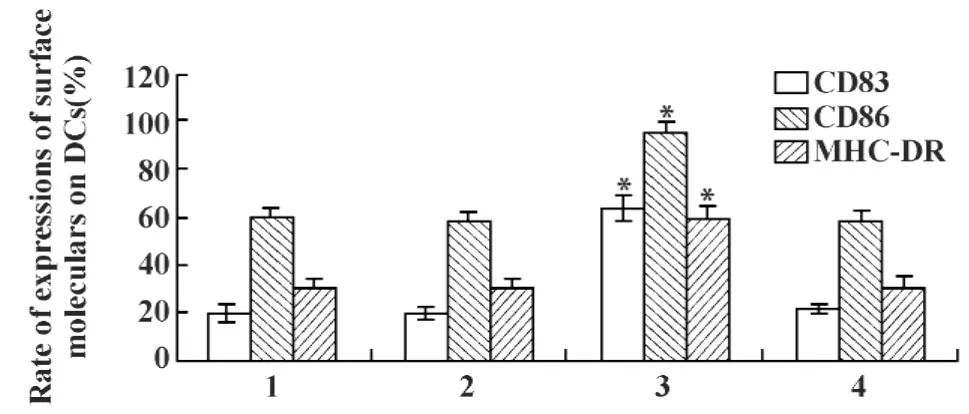
图1 不同刺激剂对DC表型的影响Fig.1 Effects of different stimulators on the phenotypes of DCs
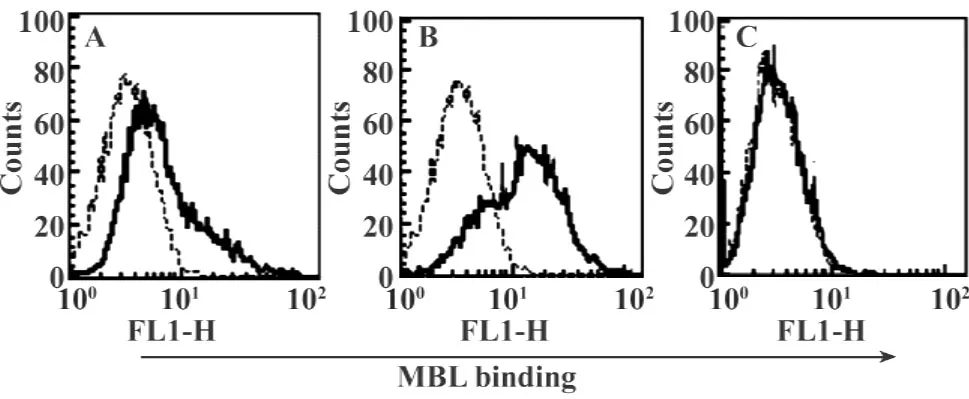
图2 MBL以Ca2+依赖方式结合imDCFig.2 Ca2+-dependent binding of MBL with imDCs
2.3MBL对imDC TLR2、TLR4 mRNA表达的影响用1%琼脂糖凝胶电泳鉴定总RNA显示28 S和18 S rRNA两条清晰带,紫外分光光度法测定总RNA样品OD260/OD280nm比值均大于1.8,表明提取的总RNA均具有较高的纯度和完整性。RT-PCR结果(图3)显示:PCR扩增产物为预期大小;随着DC的成熟,TLR2、TLR4 mRNA表达减少(Lane 2),与常规组相比,MBL组减少的更加明显(Lane 4),加入抗MBL pAb,MBL的作用效应消失(Lane 5)。
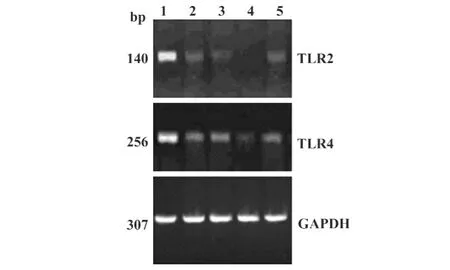
图3 MBL减弱imDC TLR2、TLR4 mRNA表达Fig.3 The decreased mRNA expressions of TLR2 and TLR4 in DCs by MBL
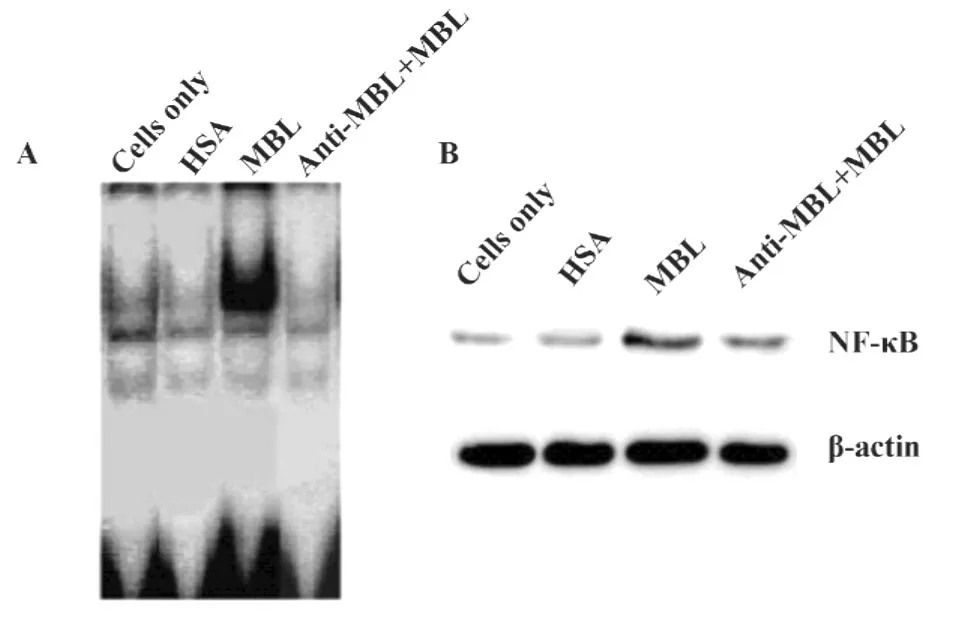
图4 MBL增强DCs NF-κB活性Fig.4 MBL enhancement of NF-κB activity in DCs
2.4MBL促进NF-κB活性 为进一步探讨MBL影响DC成熟的有关信号通路,我们又检测了MBL对核转录因子NF-κB的活性影响。EMSA结果显示:与常规组相比,MBL刺激能够显著增加imDC核转录因子NF-κB的DNA结合能力(图4A),加入抗MBL pAb,MBL的作用效应消失;Western blot结果进一步证明,MBL刺激能够显著增加imDC核转录因子NF-κB由胞浆向胞核转位,加入抗MBL pAb,MBL的作用效应消失(图4B)。
3 讨论
作为专职APC,DC在启动获得性免疫应答中扮演着极其重要的角色。DC可以通过其模式识别受体(Patten recognition receptor,PRR)识别多种病原体相关分子模式(Pathogen-associated molecule pattern,PAMP),诱导DC成熟。PRR诱导的DC成熟不仅增强其激活T淋巴细胞的能力,而且增强DC本身产生免疫调节相关的细胞因子。作为一类重要的PRR,TLR分子不仅能够介导对病原微生物及其产物的识别,而且能够参与获得性免疫应答,被视为联系天然免疫和获得性免疫的桥梁。已有研究资料表明,imDC高表达多种TLR分子,如TLR2、TLR4,但是随着DC的成熟,TLR分子的表达逐渐降低,对于完全成熟的 DC,一些 TLR分子(如 TLR2和TLR4)的表达几乎检测不到。本研究结果显示,与常规组相比,MBL组DC TLR2和TLR4表达减弱更加明显,提示MBL确实有诱导DC成熟的功能。
许多研究结果证实NF-κB与DC的功能密切相关,它不仅决定了DC激活初始T淋巴细胞的能力,而且与多种炎性细胞因子的分泌有关(如TNF-α、IL-1、IL-6 等)[14-16]。作为一类重要的 PRR,TLR 介导的信号通路可以激活多种转录因子的表达,其中核转录因子NF-κB对DC成熟和细胞因子产生至关重要,随着DC的成熟,NF-κB活性明显增强,TLRNF-κB信号途径是影响DC成熟的极为重要的信号通路。我们研究发现,与常规组相比,MBL明显增强NF-κB的DNA结合能力和由胞浆向胞核转位的能力,提示MBL通过NF-κB信号途径来调节DC成熟的。
综上所述,MBL能够与DC表面分子直接相互作用,减弱DC表面TLR2与TLR4的表达,增强DC NF-κB活性,提示MBL能够通过调控 TLR/TNF-κB信号通路来发挥其调节DC成熟功能。
1 Thompson C.Protein to proves to be a key link in innate immunity[J].Science,1995;269(5222):301-302.
2 张雅妮,王明永,雷 鸣 et al.MBL与THP1/CD14细胞结合特性的研究[J].现代免疫学,2008;28(2):121-125.
3 王明永,张雅妮,雷 鸣et al.MBL抑制Jurkat细胞增殖和分泌IL-2[J]. 现代免疫学,2010;30(6):448-452.
4 王明永,张雅妮,张丽芸et al.MBL与Raji细胞结合特性的研究[J].生物化学与生物物理进展,2008;35(3):335-340.
5 王明永,王凡平,郭晓芳 et al.MBL抑制白假丝酵母菌刺激THP1/CD14细胞产生TNF-α和IL-8[J].中华微生物学和免疫学杂志,2011;31(1):14-19.
6 Wang M,Chen Y,Zhang Y et al.Mannan-binding lectin directly interacts with Toll-like receptor 4 and suppresses lipopolysaccharide-induced inflammatory cytokine secretion from THP-1 cells[J].Cell Mol Immunol,2011;8(3):265-275.
7 Wang M,Zhang Y,Chen Y et al.Mannan-binding lectin regulates dendritic cell maturation and cytokine production induced by lipopolysaccharide[J].BMC Immunol,2011;12:1-10.
8 陈 月,陈政良,左大明et al.MBL对树突状细胞体外分化成熟的影响[J].细胞与分子免疫学杂志,2005;27(2):33-36.
9 Csomor E,Bajtay Z,Sándor N et al.Complement protein C1q induces maturation of human dendritic cells[J].Mol Immunol,2007;44(13):3389-3397.
10 王明永,张丽芸,张雅妮 et al.联合应用配体和单克隆抗体亲和层析纯化人血浆天然MBL蛋白[J].免疫学杂志,2008;24(2):119-122.
11 Bohlson S S,Fraser D A,Tenner A J.Complement proteins C1q and MBL are pattern recognition molecules that signal immediate and long-term protective immune functions[J].Mol Immunol,2007;44(1):33-43.
12 Visintin A,Mazzoni A,Spitzer J H et al.Regulation of Toll-like receptors in human monocytes and dendritic cells[J].J Immunol,2001;166(1):249-255.
13 Downing I,Macdonald S L,Turner M L et al.Detection of an autologous ligand for mannan-binding lectin on human B lymphocytes[J].Scand J Immunol,2005;62(6):507-514.
14 Baldwin A S.Series introduction:the transcription factor NF-kappaB and human disease[J].J Clin Invest,2001;107(1):3-6.
15 Thompson A G,O'Sullivan B J,Beamish H et al.T cells signaled by NF-kappa B-dendritic cells are sensitized not anergic to subsequent activation[J].J Immunol,2004;173(3):1671-1680.
16 Yoshimura S,Bondeson J,Foxwell B M et al.Effective antigen presentation by dendritic cells is NF-kappaB dependent:coordinate regulation of MHC,co-stimulatory molecules and cytokines[J].Int Immunol,2001;13(5):675-683.

