槲皮素对小鼠动情周期及免疫功能的调节作用①
李 莉 司松波 (河南师范大学生命科学学院,新乡453007)
槲皮素(Quercetin,Que)化学名为 3,3',4',5,7-五羟基黄酮,广泛存在于蔬菜、水果中,是中药水红花子中重要的黄酮类化合物,具有抗炎、降血脂等作用,近年来对其的研究多集中在抗氧化和抗兴奋毒性的作用方面[1-3]。我们的前期研究结果证实水红花子可以显著降低流产率,有一定的保胎作用(结果待发表),这些结果提示我们,其在母胎界面局部免疫微环境中可能起到有利于妊娠的建立和维持的作用。因此本研究选择槲皮素这一单一活性成分代替水红花子整药作用于小鼠,确定其对小鼠动情周期及免疫效应的影响,并探讨其对生殖内分泌系统及免疫功能的作用机制,为其作为中药免疫调节剂的开发和利用提供实验依据。
1 材料与方法
1.1材料
1.1.1试验药物与主要试剂 槲皮素(Sigma公司),取10 mg槲皮素,先用少量无水乙醇溶解,再加4 ml PBS稀释,室温放置备用。RPMI1640培养液(美国 Gibco 公司),MTT[3-(4,5)-双甲基-2-噻唑-(2,5)-二甲基溴化四氢唑盐](Sigma公司),刀豆蛋白A(ConA,Sigma公司),脂多糖(LPS,宝信生物科技有限公司),豚鼠血清(鼎国生物技术有限公司),绵羊红细胞(SRBC)由新乡医学院提供。
1.1.2实验动物处理及分组 昆明种小鼠,6周龄,平均体重(25±2)g,由郑州大学实验动物中心提供,饲养环境温度(23±2)℃,湿度50% ~75%,标准小鼠饲料喂养。选择一定数量的雌性未经产小鼠,先于每天上午8∶00检查其所处的动情周期,连续2天,选择在第2天开始进入动情间期即恰好处于动情间期第1天的小鼠12只进行动情周期检测试验,将其随机分为实验组和对照组,每组6只,并于每天上午8∶00~9∶00鉴别其所处的动情周期。进行免疫功能检测试验的小鼠随机分为实验组和对照组,每组18只,雌雄各半。小鼠于每天上午9∶00以灌胃(i.g)方式给药,连续7天,其中所有实验组小鼠槲皮素给药量为1.25 mg/(天·只),即灌服浓度为2.5 mg/ml的槲皮素药液0.5 ml/(天·只),所有对照组小鼠灌服PBS溶液0.5 ml/(天·只)。
1.2方法
1.2.1小鼠动情周期的鉴定 用蘸有少许生理盐水的无菌小棉签在阴道侧壁上1/3处轻轻刮取分泌物少许,薄而均匀地涂于玻片上,用95%的乙醇固定,经瑞氏染液染色后,于显微镜下观察小鼠阴道涂片中三种细胞,即:无核角化细胞、上皮细胞、白细胞的存在情况,依阴道脱落细胞学检查法判断其所处的动情周期[4]。从小鼠处于动情间期第1天开始至下一个动情间期出现结束,记录一个完整动情周期各阶段天数。
1.2.2淋巴细胞增殖转化能力的测定 对照组和实验组小鼠均于灌胃第7天颈椎脱臼处死,无菌取脾脏,制成脾细胞悬液,分成3组,第1组加入含ConA的RPMI1640培养液,第2组加入含LPS的RPMI1640培养液,第3组加入不含ConA和LPS的RPMI1640培养液作为阴性对照,调细胞浓度为(1×106)个/ml,并使ConA和LPS的终浓度为5 g/ml。将样品添加在96孔培养板上,每孔0.1 ml,一式三复孔,将培养板放入含有5%CO2的37℃培养箱中培养48小时。培养结束前4小时,每孔加入5 mg/ml的 MTT 10 μl,培养结束后,3 000 r/min 离心20分钟,弃上清液,每孔加入10%的DMSO 100 μl,震荡15分钟。用酶标仪在420 nm处测OD值,通过以下公式计算转化率:转化率=(实验组平均吸光值-阴性对照组平均吸光值)/阴性对照组平均吸光值×100%。
1.2.3淋巴细胞α-醋酸萘酯酶的检验 对照组和实验组小鼠均于灌胃第7天剪尾,取小鼠新鲜血液1滴,制作血涂片后进行淋巴细胞α-醋酸萘酯酶的检验[5]。在油镜下观察,每只小鼠计数200个淋巴细胞,求出α-醋酸萘酯酶阳性细胞百分数。
1.2.4巨噬细胞吞噬活性测定 对照组和实验组小鼠于末次灌胃1小时后称量体重,按碳廓清试验方法[5]由小鼠尾静脉注射墨汁,分别于注射墨汁2分钟和10分钟后从眼眶后静脉丛取血20 μl,加入事先盛有2 ml 0.1%Na2CO3溶液的试管中,摇匀。用752型分光光度计以2 ml 0.1%的Na2CO3溶液作为对照在600 nm处测其光密度值。颈椎脱臼法处死小鼠,取肝脏和脾脏,用滤纸吸干其表面血液后称重。按以下公式计算未矫正的吞噬指数k和矫正吞噬指数α,α反映了每单位组织重量的吞噬活性。k=log(OD1/OD2)/(t2-t1),α=体重/(肝重+脾重)×k1/3。
1.2.5定量溶血分光光度测定 在灌胃开始后的第2天分别给对照组和实验组小鼠腹腔注射0.2 ml 20%的SRBC悬液;在灌胃开始后的第7天,将小鼠摘除眼球放血,颈椎脱臼法处死,消毒腹壁,摘取脾脏,在盛有少许4℃的PBS培养皿内刮脾脏,制成细胞悬液,并用200目滤网过滤到离心管中,2 000 r/min离心5分钟,沉淀用1 ml 4℃的PBS悬浮,调整细胞浓度为(1×106)个/ml。取脾细胞悬液进行定量溶血分光光度测定[6],对比结果。
1.3统计学方法 所得实验数据均以±s表示,两组间数据采用两样本均数t检验,应用SPSS17.0数据处理软件进行分析,以P<0.01为差异有极显著性。
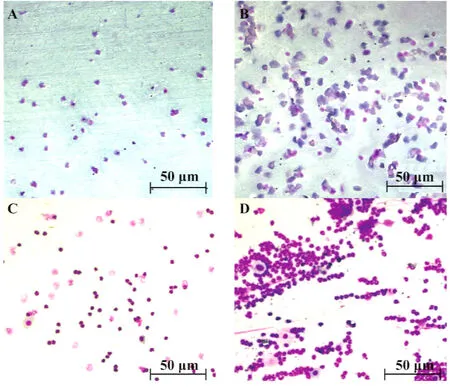
图1 小鼠动情周期各时期阴道涂片Fig.1 Mouse vaginal smears in each of the estrous stagesNote:A.Proestrus;B.Estrus;C.Metestrus;D.Diestrus.
2 结果
2.1 对小鼠动情周期的调节作用 阴道脱落细胞主要有三种:白细胞、上皮细胞和角化细胞。白细胞为有核的球形细胞,涂片中多见为白细胞中数量最多的中性粒细胞,常聚集成堆,核呈深染的弯曲杆状或分叶状。上皮细胞的细胞核大小与白细胞相似,但核呈圆形,细胞多均匀散在分布,很少聚集。角化细胞一般呈多边形或多角形,其胞核固缩,有时甚至消化,剩下“细胞空壳”。如图1所示,在动情前期,涂片上全部为上皮细胞,偶有少量角化细胞;动情期涂片全为角化细胞,偶有少量上皮细胞;动情后期涂片上三种细胞同时存在;动情间期涂片中角化细胞不断减少,白细胞增多,以白细胞为主。通过观察小鼠的阴道涂片,统计出各组小鼠动情期和动情间期天数,由表1可见,实验组小鼠动情期和动情后期天数明显增加,和对照组相比其差异达到极显著水平,说明槲皮素延长了小鼠的动情期。x ± s,n=6)Tab.1 Effect of Que on the estrous cycle in mice(x ± s,n=6)

表1 槲皮素对小鼠动情周期的影响(
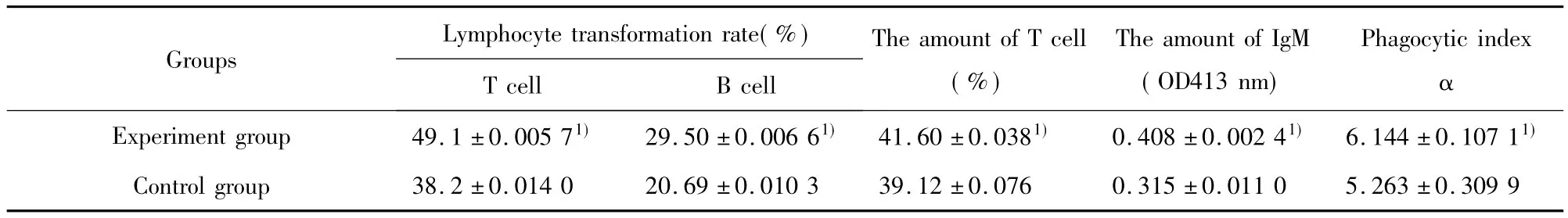
表2 槲皮素对小鼠免疫功能的影响(x ± s,n=6)Tab.2 Effect of Que on the immune function in mice(x ± s,n=6)
2.2对小鼠免疫功能的调节作用
2.2.1T、B淋巴细胞增殖转化能力的调节 由表2可见实验组小鼠T、B淋巴细胞转化率与对照组相比均明显升高(P<0.01),说明槲皮素可以显著升高小鼠由ConA刺激引起的T淋巴细胞转化率和LPS刺激引起的B淋巴细胞转化率。
2.2.2对外周血T淋巴细胞数量的调节 由表2可见实验组小鼠外周血中T淋巴细胞数目与对照组相比明显增多(P<0.01),说明槲皮素可以显著增加小鼠外周血中T淋巴细胞数目。
2.2.3对IgM抗体量的调节 从表2可以看出实验组小鼠IgM抗体生成量含量与对照组相比明显升高(P<0.01),说明槲皮素可以显著增加小鼠的IgM抗体生成量。
2.2.4对巨噬细胞吞噬功能的调节 由表2可见实验组小鼠和对照组小鼠相比,其吞噬指数明显增加(P<0.01),说明槲皮素可以显著增强小鼠巨噬细胞的吞噬活性。
3 讨论
正常的动情周期是雌性哺乳动物生殖功能成熟的标志,维持正常的动情周期是小鼠子宫建立接受态的必要条件,但至今对于子宫周期性变化的分子机制仍不明了,但可以肯定的是,这种变化是伴随卵巢激素水平的改变而发生的,并同时伴有阴道上皮细胞学的周期性改变。动情间期、动情前期和动情期是卵泡形成及排卵期,动情后期则黄体形成,并且,随着子宫由动情间期向动情期转变,血清中的雌激素,例如雌二醇的水平是逐渐上升的[7],动情周期的变化可以作为反映性激素分泌与代谢活动的敏感指标。我们的研究发现,槲皮素极显著地延长了小鼠的动情期和动情后期,这说明槲皮素在一定程度上调节了子宫相关激素水平,使子宫在组织结构上做出了适应胚泡植入需要的调整。
机体的免疫应答是一个相当复杂的过程,分为T淋巴细胞介导的细胞免疫和B淋巴细胞介导的体液免疫。T淋巴细胞数量的变化可以在一定程度上反映机体细胞免疫状态,而在体液免疫中IgM是发生初次免疫应答产生的主要抗体种类。巨噬细胞不仅是非特异免疫中的重要吞噬细胞,而且是特异性免疫中起关键作用的抗原呈递细胞,还可通过分泌多种细胞因子参与免疫应答和免疫调节过程[8]。从本文的实验结果可见,槲皮素在以上多个方面对小鼠的免疫功能造成了影响,它显著地增加了外周血中T淋巴细胞数量和IgM生成量,增强了巨噬细胞的吞噬活性以及由有丝分裂原ConA和LPS刺激所导致的淋巴细胞母细胞化,使其转化为效应细胞,分泌细胞因子,发挥其正常的免疫效应。这些结果表明槲皮素对小鼠的细胞免疫和体液免疫均具有增强作用。结合槲皮素对动情周期的影响,如前所述,卵子形成和性激素分泌的周期性波动影响着动情周期的形成,同样,与神经内分泌同属机体调节系统的免疫系统也直接或间接的受激素的调节,已有研究证实,雌激素是一种多克隆的B细胞激活剂,同时可以维持胸腺中T细胞的发育[9],因此我们推测,槲皮素或许可以影响相关激素水平,激素或通过与靶细胞上特异性受体结合而发挥作用,或通过上调下调细胞因子来诱导相应细胞的活化,从而产生了包括动情周期和免疫功能在内的生理活动的改变。然而,母胎耐受这一天然免疫抑制的发生及维持更应与子宫这个特殊微环境中各类细胞的功能活动变化密切相关,因此,在确定槲皮素对小鼠动情周期和免疫功能的影响后,我们将研究其对子宫组织中重要免疫细胞的调节作用,从而在机体和子宫局部两个水平探讨其生殖免疫学效应及可能的作用机制。
值得一提的是,目前,众多研究者在中药免疫调节剂的筛选中总有从具有某种免疫效应的整药中获得的药用成分必然会发挥同样免疫效应的思路。然而,中药整药的药效是其各种发挥不同药理效应的单体成分协同作用的复杂结果,本文的研究结果的确也证明了槲皮素对小鼠的免疫增强作用与含槲皮素成分的水红花子整药的免疫抑制作用(结果已发表)恰好相反,这为中药免疫调节剂的开发提供了新的科学参考,而这种在单体成分和整药水平两个层次上作用不同的独特的免疫学现象及机制也有待进一步研究。
1 Murota K,Terao J.Antioxidative flavonoid quercetin:implication of its intestinal absorption and metabolism[J].Arch Biochem Biophys,2003;417:12-17.
2 Boots A W,Haenen GRMM,Bast A.Health effects of quercetin:from antioxidant to nutraceutica1[J].Europ J Pharm,2008;585:325-337.3 Rivera F,Costa G,Abin A et al.Reduction of ischemic brain damage and increase of glutathione by a liposomal preparation of quercetin in permanent focal ischemia in rats[J].Neurotox Res,2008;13(2):105-114.
4 李 靖,李炫诚,吴云霞 et al.确定小鼠动情周期的三种方法[J].实验动物科学,2007;24(3):62-63.
5 朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2002:175,193-194.
6 林清华.免疫学实验[M].武汉:武汉大学出版社,1999:61-64.
7 Retana-Márquez S,Aguirre F G,Alcántara M et al.Mesquite pod extract modifies the reproductive physiology and behavior of the female rat[J].Horm Behav,2012;61(4) :549-558.
8 于善谦,王洪海,朱乃硕 et al.免疫学导论[M].第2版.北京:高等教育出版社,2008:177-182.
9 Richard S Shames.Gender difference in the development and function of the immune system[J].J Adolesc Health,2002;30(4 Suppl):59-70.

