人乳头瘤病毒58型治疗性复合DNA疫苗载体的构建①
王 鹤 于继云 李 力 (广西医科大学附属肿瘤医院,南宁530021)
宫颈癌是常见的妇科恶性肿瘤之一,全球每年约有50万新增病例,发病率在女性恶性肿瘤中居第二位,仅次于乳腺癌。过去15年的流行病学和病毒学资料已经证明:人乳头瘤病毒(HPV)感染是宫颈癌发生的首要因素,且为始动因素。几乎所有宫颈癌细胞中都有HPV DNA和病毒转化蛋白的表达。虽然根据流行病学调查发现,全世界80%的宫颈癌与4个高危型16,18,31和45相关,但据我国最近完成的两项中国与亚洲妇女子宫颈中HPV型别分布的Meta研究结果显示[1]:HPV58型在我国宫颈癌妇女中是继HPV16和18之后的第三重要型别。由于HPV58型分布具有较强的区域性,仅在亚洲妇女中检出率较高,因此,目前国内外对于HPV58的研究还较少。鉴于HPV58型在我国宫颈癌发病中的特殊地位,HPV58型疫苗研制是非常必要的。HPV的E6、E7基因在鳞状上皮病变和宫颈癌中是持续表达的,这种持续表达既是肿瘤细胞转化和维持恶性特征所必需,也可作为抗原持续刺激受感染者的免疫系统,因此成为研制HPV感染相关宫颈癌及癌前病变治疗性疫苗的理想靶抗原[2]。但因E6和E7是癌蛋白,具有转化活性,为保证疫苗在人体内的使用安全,必须首先去除E6和E7的转化活性并保留其抗原性。我们在前期研究中已消除HPV58型E6、E7基因转化活性,本研究随后构建出上游表达融合抗原HPV58mE6E7和人IgG Fc段、下游表达分子佐剂hIL12的新型复合DNA疫苗载体PVAX1-HPV58mE6E7Fc-hIL12,并采用流式细胞术、免疫荧光及ELISA分别检测该疫苗载体的真核表达情况,为该疫苗载体的疗效研究奠定基础。
1 材料与方法
1.1材料
1.1.1质粒、菌株和细胞株 点突变后的pGEM-T easy/HPV58mE6E7质粒由北京擎科生物技术有限公司合成;真核表达载体 pCI-Fc-GPI、疫苗载体PVAX1-IRES-hIL12由本室自行构建保存;大肠杆菌DH5α和人胚肾细胞293T由本实验室保存。
1.1.2工具酶和试剂 Ex Taq DNA聚合酶、SolutionⅠ快速连接酶为TaKaRa公司产品;DNA限制性内切酶购自NEB公司;质粒小量提取试剂盒、DNA片段凝胶回收试剂盒和DNA片段纯化试剂盒均购自北京三博远志科技公司;DNA电泳用琼脂糖购自BIOWEST AGAROSE公司;G418购自Merker公司;氨苄青霉素、卡那霉素、青霉素和链霉素为华北制药有限公司产品;转染用质粒小量提取试剂盒(WizardⓇPlusminipreps DNA Purification system)购自Promega公司;细胞转染试剂 LipofectamineTM2000 Reagent购自Invitrogen公司。
1.1.3抗体和试剂盒 鼠抗HPV16 E7单克隆抗体和HRP标记山羊抗鼠IgG抗体均购自Santa Cruz公司;FITC标记的山羊抗人IgG购自北京中杉金桥技术有限公司;人白介素12 ELISA检测试剂盒为深圳达科为有限责任公司产品。
1.2方法
1.2.1HPV58mE6E7融合基因的获得 点突变后的HPV58mE6E7融合基因序列交由北京擎科生物技术有限公司全基因合成(片段上下游分别带有XhoⅠ和EcoRⅠ酶切位点)并连接到pGEM-T easy载体,构建成功pGEM-T easy/HPV58mE6E7质粒,经测序鉴定。
1.2.2重组质粒pCI-sig-HPV58mE6E7-Fc-GPI的构建及鉴定 pGEM-T easy/HPV58mE6E7质粒与pCI-Fc-GPI真核表达载体同时用XhoⅠ和EcoRⅠ双酶切,酶切体系为 50 μl:底物 10 μl、Buffer EcoRⅠ 5 μl、XhoⅠ 1 μl、EcoR Ⅰ 1 μl、100 × BSA 0.5 μl、水 32.5 μl。双酶切后的 HPV58E6E7 融合基因片段和pCI-Fc-GPI载体分别纯化回收后经SolutionⅠ快速连接酶连接后转化入E.coli.DH5α感受态大肠杆菌,经氨苄青霉素培养皿筛选,挑取阳性克隆摇菌提质粒,进行XhoⅠ和EcoRⅠ双酶切鉴定,阳性者送公司测序,最终鉴定正确者命名为pCI-sig-HPV58mE6E7-Fc-GPI。
1.2.3重组疫苗质粒PVAX1-sig-HPV58mE6E7-Fc-GPI-IRES-hIL12(简称 PVAX1-HPV58mE6E7Fc-hIL12)的构建及鉴定 将鉴定正确的重组质粒pCI-sig-HPV58mE6E7-Fc-GPI和本室前期构建的新型疫苗载体PVAX1-IRES-hIL12分别先用NotⅠ和ClaⅠ单酶切,纯化后用Klenow酶补平,再用NheⅠ单酶切后切胶回收分别得到sig-HPV58mE6E7-Fc-GPI片段和载体。将片段和载体用SolutionⅠ快速连接酶连接后转化大肠杆菌E.coli DH5α,经卡那霉素培养皿筛选后,挑选阳性克隆提质粒,进行NheⅠ和PvuⅠ双酶切鉴定,酶切鉴定正确者送公司测序,最终鉴定正确者即为复合基因DNA疫苗PVAX1-sig-HPV58mE6E7-Fc-GPI-IRES-hIL12,简 称 PVAX1-HPV58mE6E7 Fc-hIL12。
1.2.4重组质粒PVAX1-HPV58mE6E7 Fc-hIL12的瞬时转染 真核表达采用脂质体法转染293T细胞。取对数生长期的293T细胞,胰酶/EDTA常规消化后接种于6孔培养板中,于37℃ CO2培养箱中培养,24小时后待其汇合度达到70% ~80%时,提取鉴定正确的重组质粒PVAX1-HPV58mE6E7 FchIL12,在脂质体Lipofectamine 2000的介导下转染293T细胞,空白对照组只加入等量的空白脂质体,转染完毕后将细胞置于37℃、5%CO2培养箱中培养,转染后6小时更换含有10%新生牛血清的RPMI1640培养基继续培养,48小时收集转染细胞进行检测。
1.2.5流式细胞术检测PVAX1-HPV58mE6E7FchIL12中sig-HPV58mE6E7-Fc-GPI的表达 ①收集转染细胞48小时的293T细胞,用4℃预冷含2%小牛血清的PBS 1ml重悬细胞(转入EP管进行后续操作),洗涤细胞2次(不用间隔),5 000 r/min×20秒,离心去上清;②同时加入由PBS按1∶100稀释的FITC标记的山羊抗人IgG抗体100 μl和1∶200稀释PE标记兔抗人B7.1抗体100 μl,混匀,冰浴,避光轻度震荡30分钟;5000 r/min×30秒,离心去上清;③4℃预冷含2%小牛血清的PBS 500 μl洗涤2次,冰浴震荡,间隔3~5分钟,5 000 r/min×30秒,离心去上清;④加入1%多聚甲醛500 μl固定后,进行流式细胞术检测。
1.2.6瞬时转染细胞的免疫荧光检测 收集转染细胞48小时的293T细胞,按照1.2.5中所述步骤染色,激光共聚焦显微镜下观察表达情况并拍照。
1.2.7hIL12分泌表达的验证 检测PVAX1-HPV58mE6E7Fc-hIL12重组质粒中 IRES下游的hIL12的表达:瞬时转染48小时后取细胞培养液上清,3 000 r/min离心20分钟吸取上清,以空白细胞培养上清作为对照,将转染后细胞的上清分别稀释5倍后,按达科为有限责任公司人白介素12 ELISA检测试剂盒说明步骤进行操作,每个样品做3个复孔,显色后用Bio-RAD酶标仪450 nm读取OD值,并做标准曲线,计算上清中hIL12浓度。
2 结果
2.1重组质粒pCI-sig-HPV58mE6E7-Fc-GPI的构建及鉴定 重组质粒pCI-sig-HPV58mE6E7-Fc-GPI经XhoⅠ 和 EcoRⅠ双酶切后,可切下大小为753 bp的HPV58mE6E7目的基因片段(图1)。
2.2复合DNA疫苗载体PVAX1-HPV58mE6E7FchIL12的构建及鉴定 基因片段sig-HPV58mE6E7-Fc-GPI与载体PVAX1-IRES-hIL12连接、转化,挑选阳性克隆提质粒后经NheⅠ和PvuⅠ双酶切鉴定证实,目的基因sig-HPV58mE6E7-Fc-GPI(2.2 kB)已连入PVAX1-IRES-hIL12中(见图2),重组质粒送测序证实PVAX1-sig-HPV58mE6E7-Fc-GPI-IRES-hIL12 DNA疫苗构建成功,简称为PVAX1-HPV58m E6E7Fc-hIL12。
2.3瞬时转染细胞的流式细胞术分析 瞬时转染48小时后的293T细胞经过同方法1.2.5的抗体染色后进行流式细胞术检测,结果如图3所示:A为空白293T细胞对照,B为转染PVAX1-HPV58mE6E7F c-hIL12质粒的293T细胞。从B图可见,FITC标记的细胞(表达sig-HPV58mE6E7-Fc-GPI)的表达率为16.71%。
2.4瞬时转染细胞的免疫荧光检测 在我们构建的 PVAX1-HPV58mE6E7Fc-hIL12重组质粒中,HPV58mE6E7基因的羧基端融合了人IgG Fc段基因,可作为检测融合蛋白表达的标签。用FITC标记(绿色荧光)的山羊抗人IgG抗体与转染PVAX1-HPV58mE6E7Fc-hIL12质粒48小时后的293T细胞进行孵育,可检测IRES上游插入的融合基因sig-HPV58mE6E7-Fc-GPI在细胞中的表达情况。经荧光显微镜观测发现:转染细胞有绿色荧光显示,主要分布于细胞膜上(图 4),证明插入片段 sig-HPV58mE6E7-Fc-GPI能够有效表达。
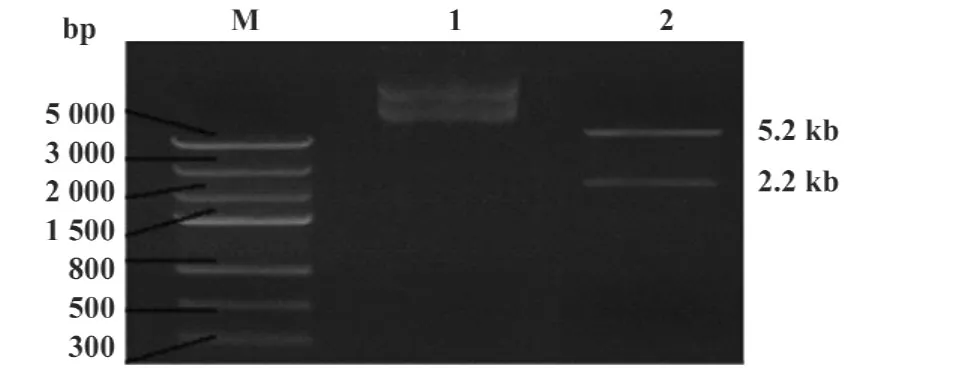
图2 PVAX1-HPV58mE6E7c-hIL12质粒双酶切鉴定Fig.2 Resnicnon enzyme digestion of PVAX1-HPV58m E6E7c-hIL12
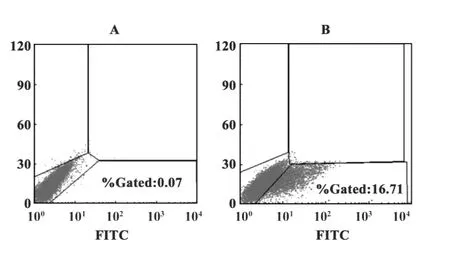
图3 瞬时转染PVAX1-HPV58mE6E7c-hIL12的293T细胞流式细胞术检测Fig.3 FACS analysis in transfected PVAX-HPV58mE6E7 Fc-hIL12 293T cell line
2.5hIL12的分泌表达 IRES下游的插入片段hIL12主要为分泌表达,因此,需用ELISA检测转染后的细胞上清了解其表达情况。按达科为有限责任公司人白介素12 ELISA检测试剂盒说明步骤进行操作,显色后用Bio-RAD酶标仪450 nm读取OD值,根据标准品检测结果绘制标准曲线,得到浓度与OD值的线性关系为y=240.2x(r2=0.978 3),阴性对照的OD值为0.04,转染后的细胞培养上清的OD值平均值分别为2.489,计算得到hIL12的浓度分别为597.86 pg/ml,阴性对照的浓度为9.60 pg/ml,见图5。
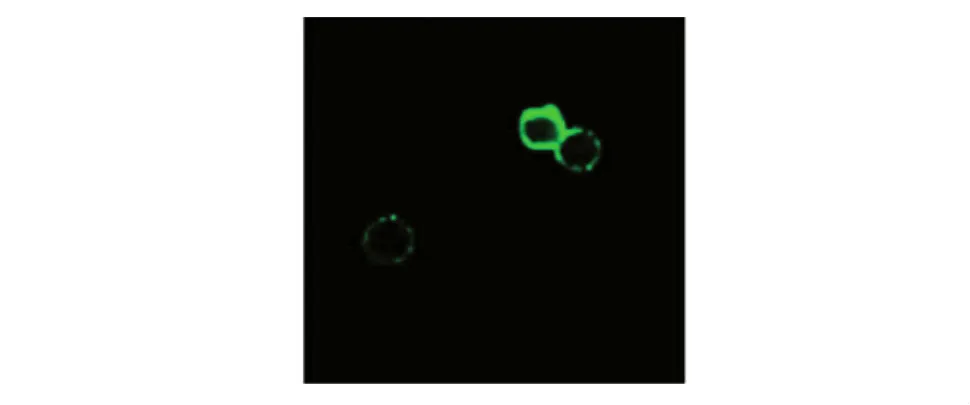
图4 瞬时转染PVAX1-HPV58mE6E7c-hIL12的293T细胞免疫荧光检测(物镜,×40)Fig.4 Immunofluorescence assay in transfected PVAX1-HPV58mE6E7c-hIL12 293T cell line FITC(Objective,×40)
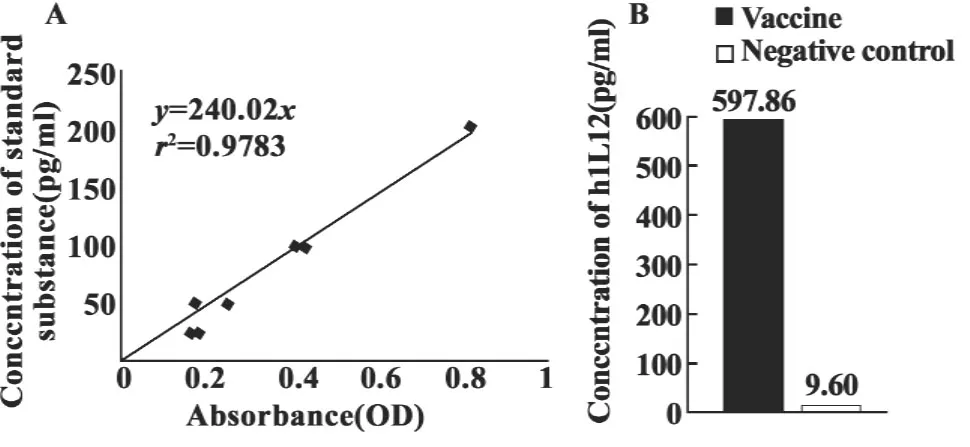
图5 hIL12分泌表达ELISA检测结果Fig.5 ELISA showing expression of hIL12
3 讨论
DNA疫苗是近年来出现的一种针对恶性肿瘤的新型治疗方法,它将编码特异性抗原的基因片段插入到真核表达载体中,通过一定的途径进入人体后,即被宿主细胞摄取,并转录和翻译出目的抗原多肽或蛋白,从而诱导特异性的体液免疫和细胞免疫应答[3]。由于DNA疫苗既具有重组亚单位疫苗的安全性又可以像减毒活疫苗那样诱导全谱性免疫应答,包括产生特异性抗体、CD4+Th和CD8+CTL免疫应答,因此目前已经成为肿瘤免疫治疗中极具吸引力的疫苗类型。近年来,大量研究表明HPV感染是宫颈癌及癌前病变发生的重要因素,90%以上的宫颈癌患者中可检测到HPV DNA的存在。由于HPV病毒本身可引起机体较强的免疫反应,因此,在宫颈癌及癌前病变的防治中,除传统的手术、放疗、化疗等手段外,免疫治疗也越来越受到重视。目前,预防性HPV疫苗的研究方面已取得较好进展,由德国Merk公司研制的HPV6/11/16/18四联疫苗已经上市,并在预防HPV感染上取得较好效果。而治疗性HPV疫苗的疗效欠佳,尚需做进一步研究。选择恰当的治疗靶点是构建DNA疫苗的一个关键之处。由于HPV E6、E7基因的强抗原性,因此目前仍是研制HPV感染相关宫颈癌及癌前病变治疗性DNA疫苗的理想靶抗原。
本实验构建的PVAX1-HPV58mE6E7Fc-hIL12复合DNA疫苗载体,利用双顺反子表达元件IRES的连接,在表达上游的融合抗原sig-HPV58mE6E7-Fc-GPI的同时,还能表达下游的分子佐剂hIL-12,二者具有协同免疫作用。其中,IRES上游的sig-HPV58mE6E7-Fc-GPI融合抗原片段分子量较单独的E6或E7抗原变大,因此所得抗原蛋白的结构相对稳定。并且,与HPV58mE6E7抗原融合表达的人IgG Fc段能与免疫效应细胞表面的Fcγ受体结合进而激活它们,增强抗原呈递功能,发挥其调节免疫效应、抗体依赖性细胞介导的细胞毒作用以及激活吞噬细胞的作用等,同时还可以延长重组蛋白的半衰期,提高疫苗的疗效[4];同时带有 Fc段的嵌合蛋白,还可以将Fc段作为检测标签,对该蛋白质的鉴定和纯化带来了很大的方便,特别是在没有HPV58E6、E7蛋白商业化抗体的情况下优势更为明显。GPI锚定蛋白是一类通过其羧基末端的糖基化磷脂酰肌(Glycosylphosphatidylinositol,GPI)结构锚定于真核细胞膜表面的蛋白。完整的GPI分子转入内质网腔内后能与新生蛋白连接形成GPI锚定蛋白,当它与细胞共同孵育时,可自动整合至细胞膜表面,并可保持其生物学活性[5]。本研究利用GPI的目的,就是要将表达的肿瘤抗原锚定在细胞膜上,从而达到增强免疫识别的作用。因为目前的研究表明,以膜形式表达的抗原要比分泌形式表达的抗原,在激发细胞免疫反应的能力上有更大优势。hIL12是构建肿瘤DNA疫苗中常用的分子佐剂,hIL12既可促进NK细胞和细胞毒T细胞增殖和活化,直接杀伤肿瘤细胞,还能分泌GM-CSF、IL2、TNF-α等多种细胞因子,间接增强免疫[6,7]。
总之,本研究成功构建并表达了 PVAX1-HPV58mE6E7Fc-HIL12复合DNA疫苗载体,该疫苗载体通过锚定蛋白GPI将抗原HPV58mE6E7锚定在细胞表面,有利于增强抗原递呈;同时发挥了人IgG Fc段免疫黏附素、hIL12加强免疫调节的作用。可作为HPV58阳性相关肿瘤及其癌前病变免疫治疗的候选疫苗载体。
1 乔友林.中国妇女人乳头瘤病毒感染和子宫颈癌的流行病学研究现状及其疫苗预防前景[J].中华流行病学杂志,2007;28(10):937-940.
2 Ullman C G,Emery V C.Transforming proteins of human papillomaviruses[J].Rev Med Virol,1996;6:39-55.
3 张 霞.DNA疫苗的发展现状及前景[J].现代医药卫生,2008;24(19):2921-2922.
4 Ferrone C R,Perales M A,Goldberg S M et al.Adjuvanticity of plasmid DNA encoding cytokines fused to immunoglobulin Fc domains[J].Clin Cancer Res,2006;12(18):5511-5519.
5 Ikezawa H.Glycosyl-phosphatidyl-inositol(GPI)-anchored proteins[J].Biol Pharm Bull,2002;25(4):409-411.
6 Marcenaro E,Della Chiesa M,Bellora F et al.IL-12 or IL-4 prime human NK cells to mediate functionally divergent interactionswith dendritic cells or tumors[J].J Immunol,2005;174(4):3992-3998.
7 王 伟,高江平,阎瑾琦 et al.人白细胞介素12双亚基共表达pVAX1-IRES-hIL12载体的构建与表达[J].军医进修学院学报,2010;31(6):600-603.

