应用P38抑制剂降低结肠癌细胞AKT的表达
张 军,张玲利,李金鹏,于红刚
武汉大学人民医院消化内科,湖北武汉 430060
应用P38抑制剂降低结肠癌细胞AKT的表达
张 军,张玲利,李金鹏,于红刚
武汉大学人民医院消化内科,湖北武汉 430060
目的探讨P38抑制剂SB203580对顺铂杀伤作用及耐药性产生的影响。方法以结肠癌细胞HCT-116为实验对象。设定P38MAPK特异性抑制剂SB203580的浓度20 mg/L、顺铂的浓度100 μmol/L,两者合用处理结肠癌HCT-116细胞株。MTT法和流式细胞术检测顺铂(Ⅰ组)和SB203580+顺铂(Ⅱ组)对结肠癌细胞株HCT-116生长及凋亡的影响,RT-PCR检测顺铂和SB203580+顺铂在转录水平上AKT的表达。结果顺铂与SB203580联合后对HCT-116细胞增殖的抑制及致凋亡作用显著增强;顺铂与SB203580联合后可以显著降低AKT的表达水平。结论SB203580提高顺铂对结肠癌细胞株HCT-116的杀伤效果及降低顺铂耐药性的产生。
结肠癌;顺铂;耐药性
结肠癌(colon cancer)是目前较常见的恶性肿瘤,其发病率与病死率都非常高[1]。临床治疗肿瘤的新药虽不断发展与更新,但是化疗药物的耐药性仍不能得到很好的解决,提示该病的治疗方法亟待进一步改进和完善[2]。基因毒素类化疗药物顺铂(cisplatin,CDDP)对结肠癌治疗效果较好,但因长期使用会产生耐药性,从而导致其使用剂量加大而加重其毒性作用,使其临床应用受到了一定的限制[3-4]。本课题组前期研究发现[5]顺铂等化疗药物可以导致AKT的表达水平的增加,从而提示其耐药性的产生可能与此有关。本实验以结肠癌细胞HCT-116为研究对象,初步探讨SB203580对顺铂杀伤作用及耐药性产生的影响。
1 材料与方法
1.1 主要材料 结肠癌HCT-116细胞株购自中国科学院上海细胞库,属低分化腺癌细胞系。Annexin VFITC/PI凋亡检测试剂盒购自美国 Blender公司。Akt抗体、磷酸化Akt抗体均购自CST公司。SB203580、顺铂均购自美国Sigma公司。
1.2 细胞培养和实验分组 HCT-116细胞在含10%胎牛血清的RPMI 1640培养基中于37℃、5%CO2孵箱中孵育。实验时取对数生长期细胞。实验分4组:顺铂(Ⅰ组)、SB203580(Ⅱ组)、顺铂 +SB203580(Ⅲ组)及空白对照组,Ⅰ组与Ⅲ组顺铂均设定同样的浓度100μmol/L,Ⅱ组与Ⅲ组SB203580均设定同样的浓度20 mg/L。
1.3 MTT法检测药物对细胞生长的抑制率 收集对数期HCT-116细胞,以2×104个/mL的密度接种细胞于96孔培养板,每孔加入200 μL。孵育24 h后,加入预设浓度顺铂(Ⅰ组)、SB203580(Ⅱ组)、顺铂 +SB203580(Ⅲ组)共同孵育,每个浓度设3个复孔,同时设立不加药物的空白对照,继续培养24 h,弃孔内液体,每孔加入 200 μL MTT(浓度为 0.5 mg/mL),培养4 h,弃孔内液体,加入200 μL DMSO。振荡10 min后酶标仪测光密度(D570),按公式计算细胞增殖抑制率。细胞增殖抑制率(%)=(对照组D570值-实验组D570值)/对照组D570值×100%。
1.4 流式细胞术检测细胞凋亡率 取对数生长期的HCT-116细胞以1×106个/mL的密度接种于6孔培养板孵育24 h,弃培养液,加入预设浓度顺铂(Ⅰ组)、SB203580(Ⅱ组)、顺铂 +SB203580(Ⅲ组)共同孵育24 h,收集各组培养液中悬浮细胞和用胰酶消化的细胞,5×g离心10 min,弃上清。预冷PBS洗涤细胞2次,并将细胞重悬于195 μL的结合缓冲液中。加入5 μL Annexin V-FITC 室温、避光反应 10 min,加入5 μL PI混匀,室温、避光反应5 min。筛网过滤后,上机检测细胞凋亡率。
1.5 RT-PCR检测AKT在转录水平上的表达 细胞总RNA采用Life technologies公司Trizol Reagent抽取,逆转录cDNA试剂盒购自Life technologies公司,PCR扩增引物由Invitrogen公司合成,Akt上游引物为:5'GAGCGGGAGGAGTGGACAA 3',下游引物为:5'GGGACAGGTGGAAGAACAGC 3'。
1.6 Western blot检测AKT在蛋白水平上的表达按照预设实验组,CDDP及SB203580分别处理作用24h后提取各组总蛋白,上样孔加入步骤包括提取并测定总蛋白浓度,计算20 mg体积下的上样量,蛋白电泳,纤维膜电转后将膜用5%干燥脱脂奶粉的Tris缓冲液含0.1%吐温,加入预设的抗体孵育过夜,加入抗兔及抗鼠的二抗增强化学发光以便检测,X线胶片显影等。
2 结果
2.1 SB203580联合顺铂促进对HCT-116细胞增殖的抑制 实验结果显示,联合用药组对HCT-116细胞增殖的抑制率为(64.2±0.01)%,其抑制率高于单用顺铂组抑制率(27.6±0.06)%及单用SB203580组抑制率(30.7 ±0.03)%。
2.2 SB203580联合顺铂诱导HCT-116细胞的凋亡
实验结果显示,联合用药组对HCT-116细胞凋亡率为(63.8±0.01)%,显著高于单用顺铂组(25.4 ±0.06)% 及单用 SB203580 组(27.8 ±0.03)%(见图1)。
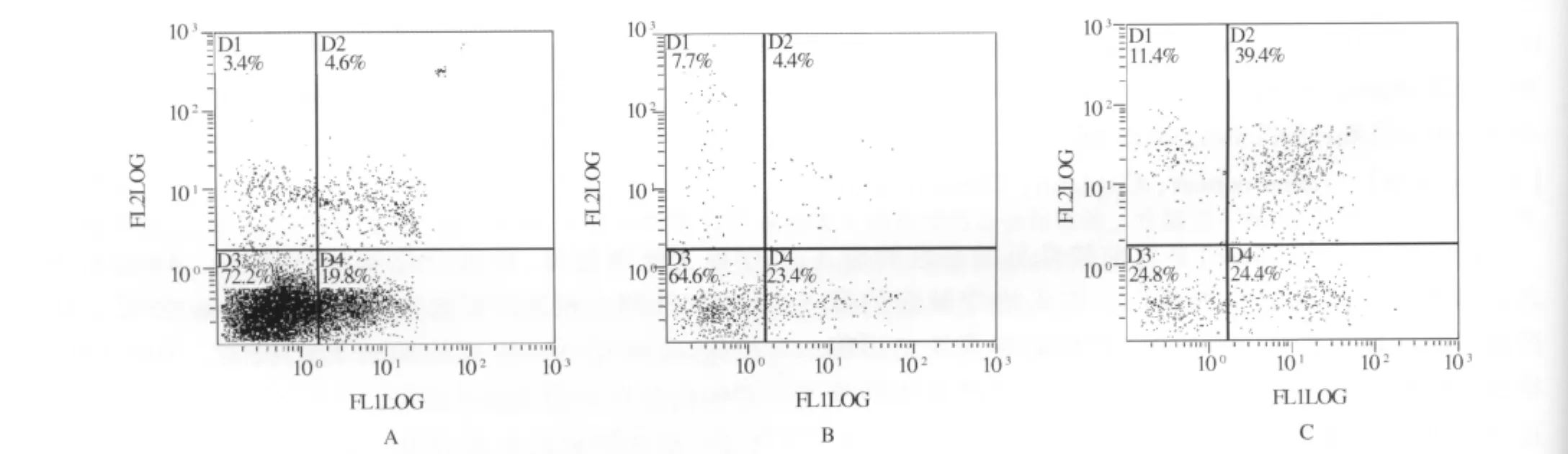
图1 SB203580联合顺铂诱导HCT-116细胞凋亡 A:CDDP 100 μmol/L;B:SB203580 20 mg/L;C:CDDP 100 μmol/L+SB203580 20 mg/LFig 1 CDDP combined with SB203580 induced apoptosis of HCT-116 cells A:CDDP 100 μmol/L;B:SB203580 20 mg/L;C:CDDP 100 μmol/L+SB203580 20 mg/L
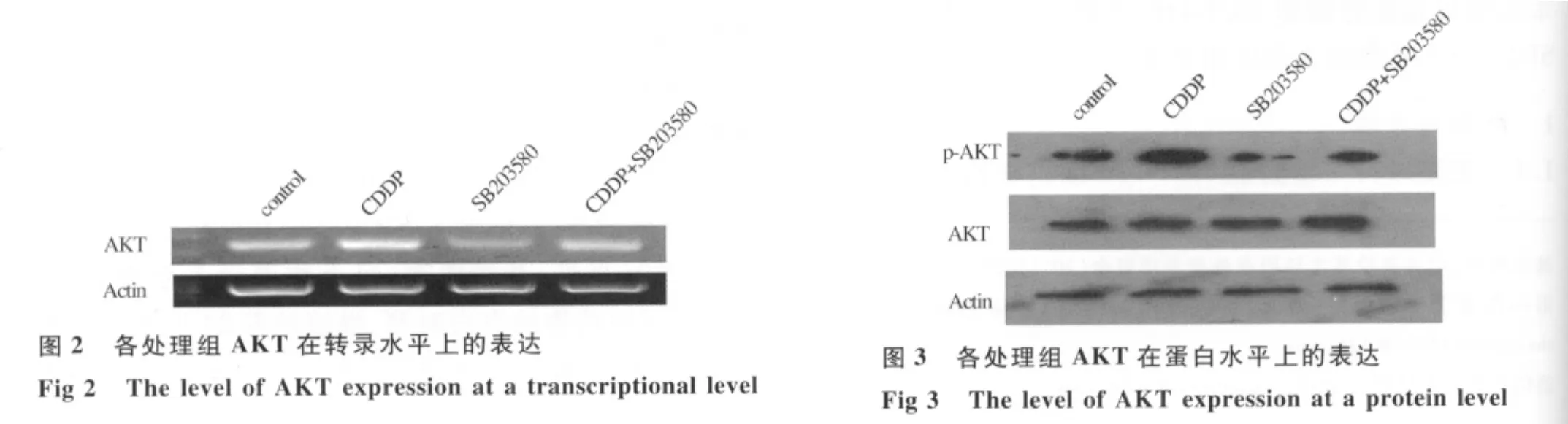
2.3 S203580联合顺铂促进AKT在转录水平的表达
2.4 SB203580联合顺铂促进AKT在蛋白水平的表达
3 讨论
顺铂是目前临床较常用的化疗药物,尽管其治疗肿瘤效果显著,但因其较易产生耐药性,从而限制了其临床广泛应用[6]。如何增强顺铂等化疗药物对肿瘤细胞的杀伤作用并减少其耐药性的产生是近年来研究热点。
PI3K/AKT信号通路可以参与调节细胞增殖、转录、生长等,并且与肿瘤的发生发展关系密切[7],蛋白激酶B(AKT)可以阻滞肿瘤细胞发生凋亡,其在肿瘤细胞中呈表达,而AKT可以由其上游的PI3K信号通路激活,AKT的持续活化进而抑制抑癌基因PTEN的表达,并导致肿瘤细胞对化疗药物耐药性的产生[8-10]。MAPK家族包括 4个亚类:ERK1/2、JNK1/2/3、P38 protein和ERK5等,其主要作用是通过传导细胞外应激来调控基因表达[11]。近来有研究表明,许多肿瘤细胞对化疗药物耐药性的产生与MAPK信号传导通路的激活有关[12-13]。我们前期实验[5]发现 PI3K/AKT信号转导通路参与肿瘤细胞对化疗药物耐药性的形成与AKT的活化有一定的关系,在应用顺铂等化疗药物处理肿瘤细胞后AKT的表达往往增强,提示AKT的表达水平与化疗药物的耐药性形成之间有一定的关系,因此应用P38抑制剂SB203580阻断AKT相关信号转导通路,降低其表达水平,这一点与文献报道相符[14-15],从而一方面可以促进肿瘤细胞发生凋亡并抑制其增殖,另一方面可以提高肿瘤细胞对化疗药物敏感性。
在本实验中,联合用药组对HCT-116细胞凋亡率为:(63.8±0.01)%,显著高于单用顺铂组凋亡率(25.4±0.06)%及单用 SB203580 组凋亡率(27.8 ±0.03)%(P<0.01)。显而易见,顺铂联合应用P38抑制剂SB203580抗肿瘤作用显著优于单用顺铂及单用SB203580,提示SB203580可以显著增加顺铂的杀伤作用。值得注意的是,在顺铂与SB203580联合应用后处理结肠癌细胞AKT在转录水平及蛋白水平上比单用顺铂组都显著降低,显示该抑制剂可以降低AKT的表达,本实验提示SB203580可能是一种较理想的基因毒素类化疗药物的增敏剂。
针对目前临床上较常见的化疗药物耐药性问题,较常见传统的解决方案是多种化疗药物联合应用,但增加疗效的同时往往伴随着化疗药物剂量的增加及耐药性的产生。本研究表明,P38特异性的抑制剂SB203580可以在提供对肿瘤细胞杀伤作用的同时,通过阻断AKT的表达可能是提供顺铂化疗药物敏感性降低其耐药性产生的可能机制。本实验结果提示,SB203580具有潜在的临床应用价值,但其具体的分子生物学机制还有待与进一步的研究。
[1] Pikó B,Rahóty P,Krémer I,et al.Detection of multiple colon and rectal tumors during diagnostic treatment and follow-up[J].Magy Onkol,2011,55(4):244-249.
[2] Spychalski M,Dziki L,Dziki A.Chemoprevention of colorectal cancera new target needed?[J].Colorectal Dis,2007,9(5):397-401.
[3] Cetintas VB,Kucukaslan AS,Kosova B,et al.Cisplatin resistance induced by decreased apoptotic activity in non-small-cell lung cancer cell lines[J].Cell Biol Int,2012,36(3):261-265.
[4] Liu F,Liu Q,Yang D,et al.Verticillin A overcomes apoptosis resistance in human colon carcinoma through DNA methylation-dependent upregulation of BNIP3 [J].Cancer Res,2011,71(21):6807-6816.
[5] Li JP,Zhou W,Zhang J,et al.Use of p38 MAPK inhibitor reduces resistance of colon cancer cells to doxorubicin[J].World Chinese Journal of Digestology,2012,20(2):145-148.李金鹏,周巍,张军,等.联合应用p38MAPK抑制剂对降低结肠癌阿霉素耐药性的影响[J].世界消化华人杂志,2012,20(2):145-148.
[6] Kim Y,Jang M,Lim S,et al.Role of cyclophilin B in tumorigenesis and cisplatin resistance in hepatocellular carcinoma in humans[J].Hepatology,2011,54(5):1661-1678.
[7] Akao Y,Noguchi S,Iio A,et al.Dysregulation of microRNA-34a expression causes drug-resistance to 5-FU in human colon cancer DLD-1 cells[J].Cancer Lett,2011,300(2):197-204.
[8] Jiang Y,Liu XQ,Rajput A,et al.Phosphatase PRL-3 is a direct regulatory target of TGFbeta in colon cancer metastasis[J].Cancer Res,2011,71(1):234-244.
[9] Humtsoe JO,Kramer RH.Differential epidermal growth factor receptor signaling regulates anchorage-independent growth by modulation of the PI3K/AKT pathway[J].Oncogene,2010,29(8):1214-1226.
[10] Garcia R,Franklin RA,McCubrey JA.EGF induces cell motility and multi-drug resistance gene expression in breast cancer cells[J].Cell Cycle,2006,5(23):2820-2826.
[11] Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
[12] Hilger RA,Scheulen ME,Strumberg D.The Ras-Raf-MEK-ERK pathway in the treatment of cancer[J].Onkologie,2002,25(6):511-518.
[13] Raman M,Chen W,Cobb MH.Differential regulation and properties of MAPKs[J].Oncogene,2007,26(22):3100-3112.
[14] Yang XS,Liu S,Liu YJ,et al.Overexpression of fucosyltransferase IV promotes A431 cell proliferation through activating MAPK and PI3K/Akt signaling pathways[J].J Cell Physiol,2010 ,225(2):612-619.
[15] Rengifo-Cam W,Umar S,Sarkar S,et al.Antiapoptotic effects of progastrin on pancreatic cancer cells are mediated by sustained activation of nuclear factor-{kappa}B [J].Cancer Res,2007,67(15):7266-7274.
The application P38 inhibitor reduces the AKT expression in colon cancer cell line
ZHANG Jun,ZHANG Linli,LI Jinpeng,YU Honggang
Department of Gastroenterology,People’s Hospital of Wuhan University,Wuhan 430060,China
ObjectiveTo evaluate the sensitive effect and the possible mechanisms of chemoresisitance of SB203580,a p38MAPK inhibitor,on colon cancer cell line HCT-116 when combined with cisplatin.MethodsColon cancer cells HCT-116 were used as experimental subjects.The concentration of SB203580 was setted to 20 mg/L,the concentration of cisplatin was 100 μmol/L.After treatment,MTT was used to measure inhibitory effects,flow cytometry was used to investigate the apoptosis of HCT-116 and AKT was detected by RT-PCR.ResultsAfter combined group of SB203580 and cisplatin,the growth inhibition rate of HCT-116 cells was significantly increased compared with cisplatin group and SB203580 group.The apoptotic rate was also significantly increased when cisplatin combined with SB203580.The AKT expression was significantly higher in the cisplatin group than in combination group.ConclusionSB203580 could reduced the AKT expression and sensitized cisplatin on its lethal effect of HCT-116 cells.
Colon cancer;Cisplatin;Chemoresistance
R574.62
A
1006-5709(2012)11-1011-03
2012-04-19
10.3969/j.issn.1006-5709.2012.11.008
中央高校基本科研业务费专项资金(201130202020017)
张军,博士,研究方向:消化道肿瘤防治。E-mail:zhangjun0532027@126.com
于红刚,E-mail:honggangyu@sohu.com

