伏立康唑预防侵袭性真菌感染有效性及安全性的荟萃分析
李方方, 徐燕丽, 张秀群, 张学忠
伏立康唑预防侵袭性真菌感染有效性及安全性的荟萃分析
李方方, 徐燕丽, 张秀群, 张学忠
目的系统评价伏立康唑在预防侵袭性真菌感染(invasive fungal infections,IFI)中的有效性及安全性。方法计算机检索Pub Med、Cochrane Library、EMbase、CNKI、CBM、VIP数据库,收集伏立康唑预防深部真菌感染的随机对照试验,检索时间从建库至2011年12月。由2位研究者按照纳入标准独立筛选文献、提取资料和评价质量后,采取Rev Man 5.0软件进行荟萃分析。结果共纳入4个研究,1 288例患者。荟萃分析结果提示:伏立康唑、两性霉素B两组预防失败率的差异无统计学意义[OR=0.75,95%CI(0.32~1.77),P=0.52],伏立康唑组严重不良反应率低于两性霉素B组,差异有统计学意义[OR=0.15,95%(0.04~0.55),P=0.005];伏立康唑、氟康唑两组IFI发生率[OR=0.62,95%CI(0.35~1.09),P=0.09]、视觉异常发生率[OR=1.14,95%CI(0.59~2.18),P=0.07]的差异均无统计学意义;伏立康唑预防成功率高于伊曲康唑组[OR=1.96,95%CI(1.35~2.84),P=0.0004]、不良反应发生率低于伊曲康唑组[OR=0.54,95%CI(0.37~0.78),P=0.001],差异均有统计学意义,而两组不良反应致用药终止发生率的差异无统计学意义[OR=2.05,95%CI(0.74~5.72),P=0.017]。结论伏立康唑在预防IFI中表现出高效低毒性临床特点,近年来临床应用越来越受青睐,其价值有待时间的进一步考验。
伏立康唑; 两性霉素B; 氟康唑; 伊曲康唑; 侵袭性真菌感染; 荟萃分析; 系统评价
侵袭性真菌感染(invasive fungal infections,IFI)是免疫缺陷患者、抵抗力较差患者的主要致病、致死原因,包括血液系统恶性肿瘤、实质器官或骨髓移植、粒细胞缺乏患者以及接受系统性糖皮质激素治疗患者等。念珠菌属和曲霉属是2种常见的病原真菌,在过去的数十年,氟康唑广泛应用于白念珠菌感染患者[1-4],然而随着白念珠菌感染率下降,非白念珠菌及曲霉感染率成上升趋势,其临床应用受到限制,两性霉素B虽然是高效的广谱抗真菌药物,但其不良反应较大[5],而近年来广谱唑类药物(伊曲康唑、伏立康唑)等新兴药物开始广泛用于IFI患者。IFI一旦发生,病死率高,近年来,虽然对IFI的认识和诊断水平有所提高,但IFI仍存在诊断困难、治疗疗程长、病死率高等问题,故IFI的有效预防有着较高的临床价值。众所周知,伏立康唑主要用于免疫缺陷患者中的进行性的、可能威胁生命的真菌感染,而无预防用药指征,但近年来临床上为提高IFI的有效预防率,伏立康唑作为预防用药越来越多。现为进一步客观评价伏立康唑在预防侵袭性真菌感染中的有效性,本研究采用系统评价方法评价伏立康唑预防侵袭性真菌感染的随机对照研究,并结合临床,对其利弊进行全面评价,以期为临床应用提供可靠依据。
材料与方法
一、纳入标准
(一)研究类型 随机对照试验,无论是否采用盲法。
(二)研究对象 恶性肿瘤、实质器官或骨髓移植、化疗等免疫系统功能严重低下患者,无肝肾功能不全等。
(三)干预措施 伏立康唑与两性霉素B比较;伏立康唑与氟康唑比较;伏立康唑与伊曲康唑比较。
(四)结局指标 预防失败率、成功率;不良反应发生率。
二、检索策略
以“伏立康唑、真菌感染、真菌血症、念珠菌病、念珠菌感染、曲霉菌病、曲菌病、曲霉病、曲霉感染”检索中国期刊全文数据库(CNKI,1994—2011.12)、中国生物医学文献数据库(CBM,1978—2011.12)、中文科技期刊数据库(VIP,1989—2011.12)。以“voriconazole、fungemia、aspergillosis、candidiasis”等检索Pub Med(1966—2011.12)、Cochrane Library(2011年第12期)、Embase(1974-2011.12)。随机对照试验检索采用Cochrane系统评价手册检索策略,其他检索采用主题词与自由词相结合的方式,所有检索策略通过多次预检索后确定,并用Google Scholar、读秀学术搜索等搜索引擎在互联网上查找相关文献,追查已纳入数据库的参考文献。
三、资料提取和质量评价
由2位研究者分别阅读所获文献题目和摘要,在排除明显不符合纳入标准的试验后,对可能符合纳入标准的试验阅读全文,以确定是否符合纳入标准。2位研究者交叉核对纳入试验的结果,对有分歧而难以确定其是否纳入的试验通过讨论或由第3位研究者决定其是否纳入。缺少的资料通过电话或信件与作者联系予以补充。按照预先制定的资料提取表提取以下内容:① 一般资料,包括题目、作者姓名、发表日期和文献来源;② 研究特征,包括研究对象的一般情况、干预措施等;③ 测量指标等。
根据Cochrane系统评价手册推荐的质量评价方法用统一的质量评价表对纳入研究进行方法学质量评价[6]:①采用何种随机分配方法,方法是否正确;②是否进行分配隐藏,方法是否正确;③ 是否采用盲法,对哪些人实施了盲法;④ 有无数据缺失,若有失访或退出时,是否采用意向性(ITT)分析法;⑤ 是否存在选择性报告研究结果;⑥ 是否存在其他方面的偏倚。如果所有6项质量评价标准均完全满足,则该研究存在偏倚的可能性最小;如果其中任何1项或多项质量评价标准仅为部分满足或不清楚,则该研究存在中等度偏倚的可能性;如果其中任何1项或多项质量评价标准完全不满足,则该研究存在高度偏倚的可能性。质量评价由2位研究者独立进行并交叉核对,如遇分歧通过讨论或请第3位研究者协助解决。
四、统计分析
采用Cochrane协作网提供的Rev Man 5.0软件进行荟萃分析。计数资料采用相对危险度(RR)为疗效分析统计量,计量资料采用均数差(s)为疗效分析统计量,各效应量均以95%CI表示。各纳入研究结果间的异质性采用χ2检验。若纳入研究具有足够的一致性(P>0.05和I2<50%)时,采用固定效应模型进行分析;若纳入研究存在异质性时,分析其异质性来源,对可能导致异质性的因素进行亚组分析。若各研究间存在统计学异质性而无临床异质性或差异无临床意义时,采用随机效应模型。如各组间异质性过大,则采用描述性分析。必要时采用敏感性分析检验结果的稳定性。
结 果
一、文献检索结果
初检到相关文献4 498篇文献,根据纳入标准,阅读文题和摘要排除非随机对照试验、重复发表、非临床研究文献,初筛得到28篇文献,进一步阅读全文排除不符合纳入标准的文献后最终纳入4项研究[7-10],共1 288例患者(图1)。
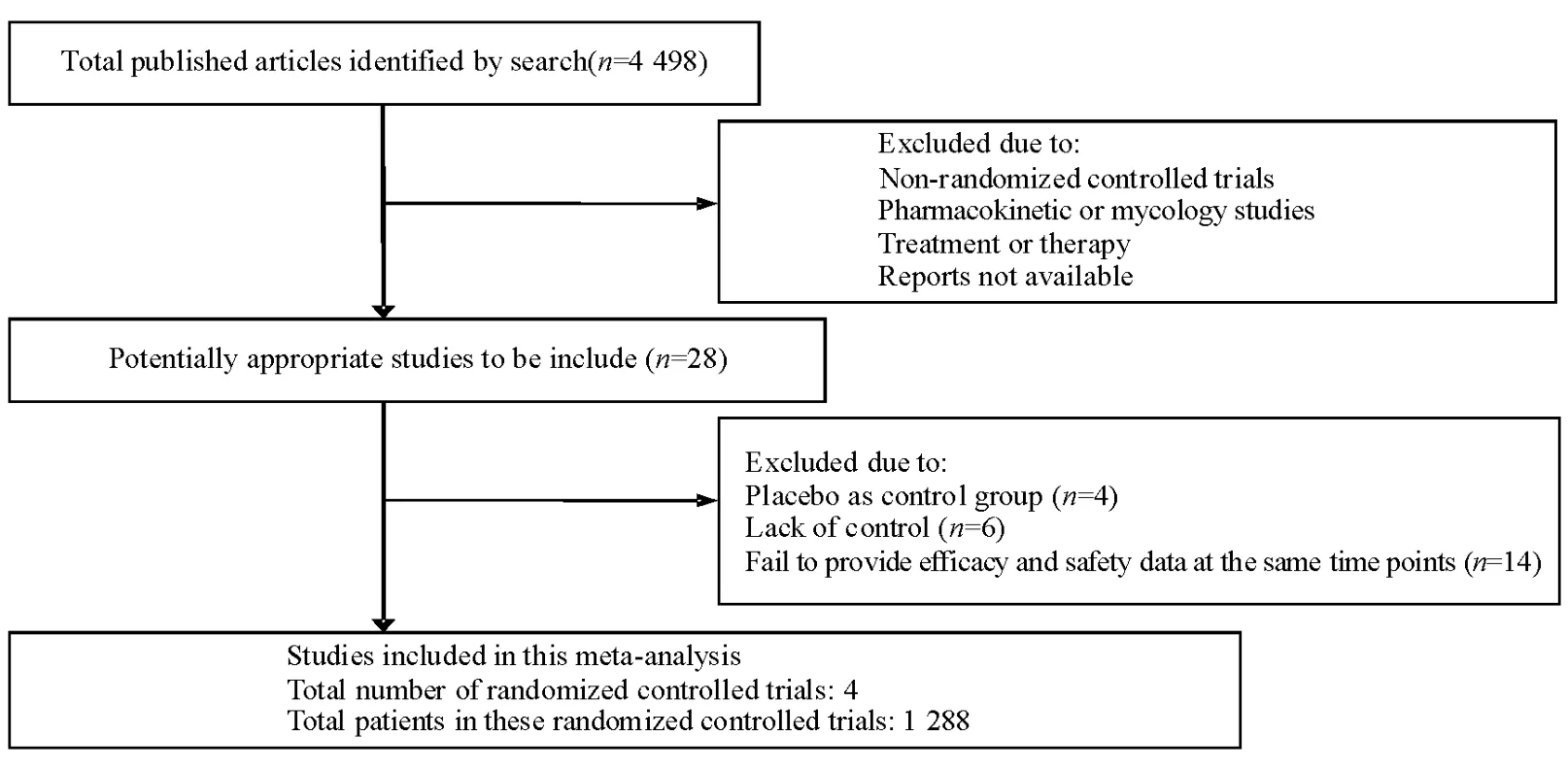
图1 文献筛选过程FIG.1.Literature search and selection of published reports
二、纳入研究的一般情况和质量评价
见表1、2。
三、荟萃分析结果
4项研究均比较了伏立康唑与对照药物用于预防真菌感染的有效性及安全性,然主要指标及次要指标不尽相同。荟萃分析结果显示伏立康唑预防IFI有效性与两性霉素B、氟康唑间差异无统计学意义,而其疗效高于伊曲康唑,差异有统计学意义;伏立康唑预防IFI安全性与两性霉素B(严重不良反应率)、氟康唑(视觉异常发生率)、伊曲康唑(总不良反应率、不良反应致用药终止发生率)间差异均无统计学意义。
伏立康唑与两性霉素B相较纳入1项研究[7],该研究表明伏立康唑组预防治疗失败率与两性霉素B组的差异无统计学意义[OR=0.75,95%CI(0.32~1.77),P=0.52](图2),而伏立康唑组严重不良反应率低于两性霉素B组,差异有统计学意义[OR=0.15,95%(0.04~0.55),P=0.005](图3)。该研究也表明两组在确诊、疑似IFI发生率方面差异无统计学意义,而在预防失败患者中CT显示肺浸润者伏立康唑组低于两性霉素B组,差异有统计学意义。
伏立康唑与氟康唑疗效比较纳入1项研究[9],该研究表明伏立康唑、氟康唑组间的预防治疗IFI发生率 [OR=0.62,95%CI(0.35~1.09),P=0.09](图2)、视觉异常发生率的差异均无统计学意义[OR=1.14,95%CI(0.59~2.18),P=0.07](图3)。该文提供IFI发生率是在180 d时的结局指标,而该研究也表明365 d时2组间IFI发生率的差异亦无统计学意义,2组间在180 d时无菌生存(fungal-free survival,FFS)率的差异也无统计学意义,曲霉为两组发生IFI的主要病原体,该研究显示两组研究的不良反应发生率差异无统计学意义(未提供数据)。伏立康唑与伊曲康唑疗效比较纳入2项研究[8,10],2项研究间在预防成功率(P=0.40,I2=0%)方面无统计学异质性,采用固定效应模式行荟萃分析,该研究表明伏立康唑组预防治疗成功率高于伊曲康唑组,差异有统计学意义[OR=1.96,95%CI(1.35~2.84),P=0.0004](图2)。Marks等[8]的研究表明伏立康唑组不良反应发生率低于伊曲康唑组,差异有统计学意义[OR=0.54,95%CI(0.37~0.78),P=0.001](图3),将各不良反应分组分析后发现伏立康唑在恶心、呕吐、腹泻的发生率均低于伊曲康唑组,而肝毒性、视觉异常则高于伊曲康唑组,差异均有统计学意义(P<0.01),而在头痛方面,2组间的差异无统计学意义(P=0.79)。Mattiuzzi等[10]的研究表明2组间不良反应致用药终止发生率的差异无统计学意义[OR=2.05,95%CI(0.74~5.72),P=0.017](图3)。
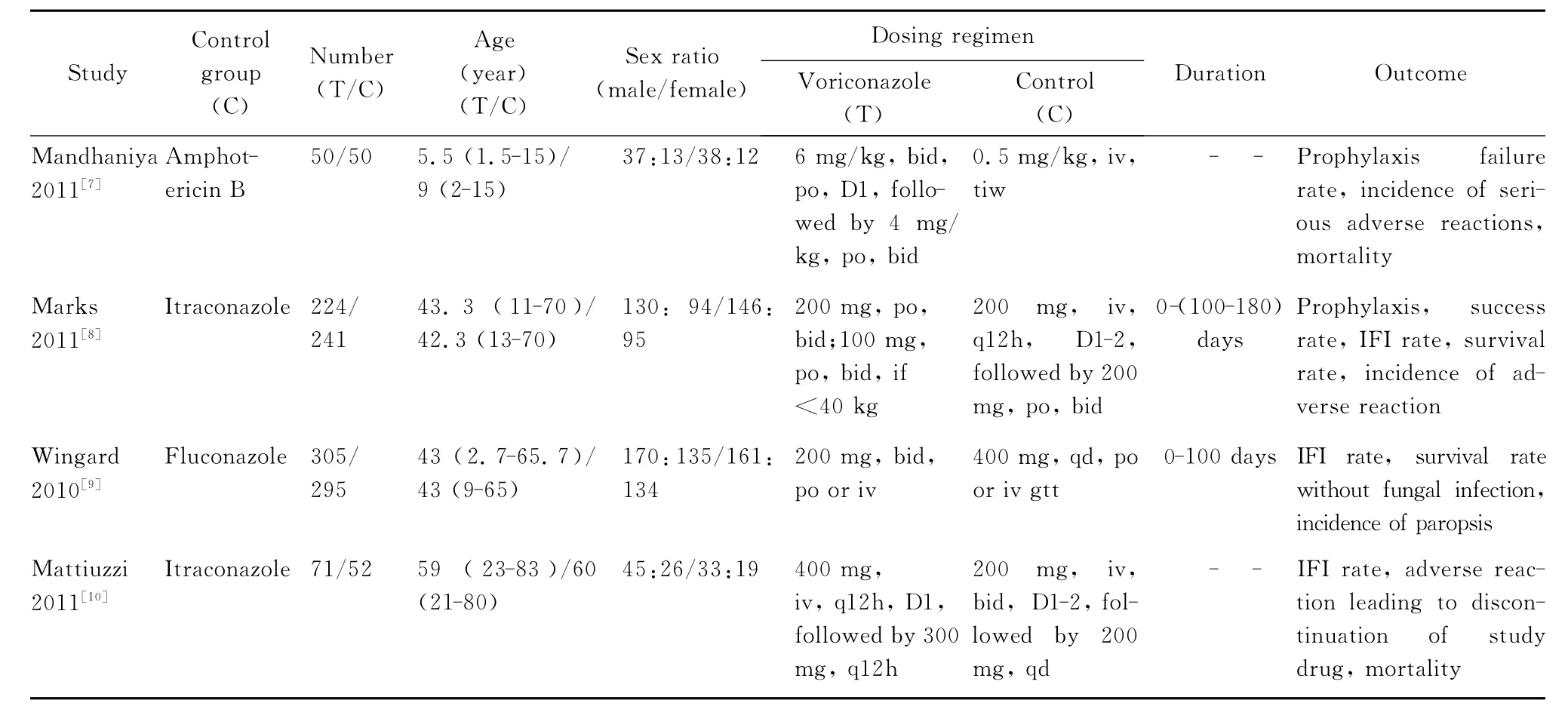
表1 纳入研究的一般情况Table 1.Main characteristics of the randomized controlled trials included in the meta-analysis
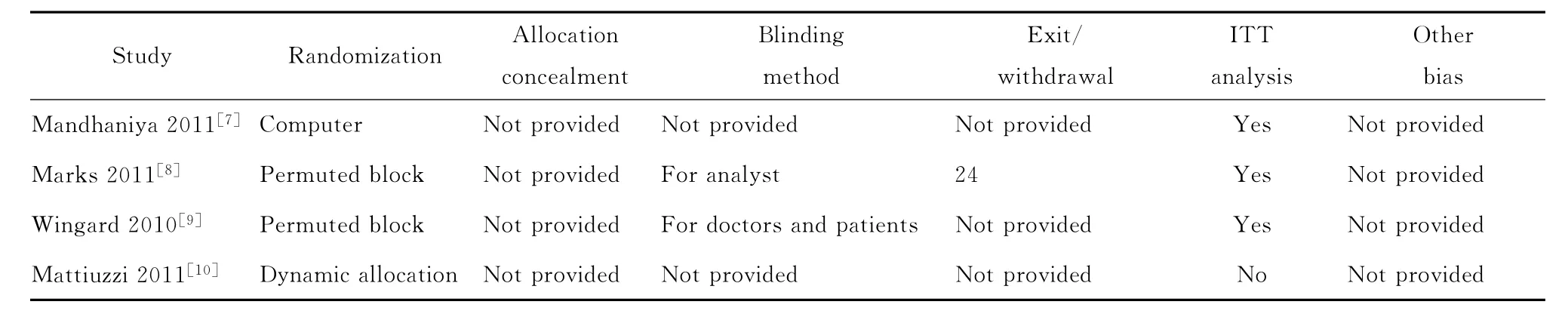
表2 纳入研究的方法学质量评价Table 2.Methodological quality assessment of the randomized controlled trials included in the meta-analysis
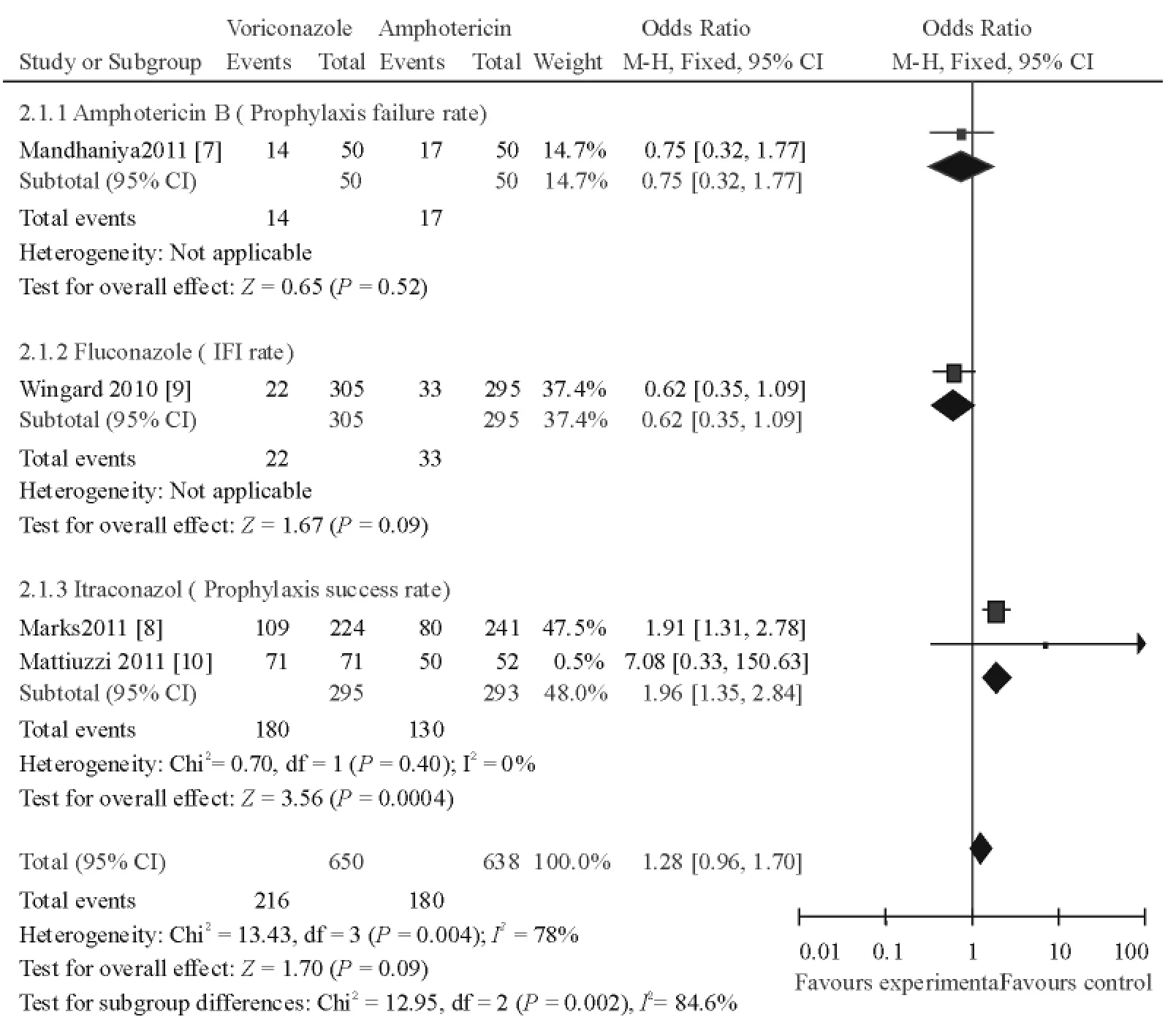
图2 伏立康唑与各对照组预防用药有效性比较FIG.2.Comparison between voriconazole and comparators in terms of efficacy in prophylactic use

图3 伏立康唑与各对照组预防用药安全性比较FIG.3.Comparison between voriconazole and comparators in terms of safety in prophylactic use
讨 论
本系统评价共纳入4项研究[7-10],均为英文文献。4项研究中伏立康唑与两性霉素B比较1项[7](主要指标为预防治疗真菌感染失败率)、与氟康唑比较1项[9](主要指标为预防IFI发生率)、与伊曲康唑比较2项[8,10](主要指标为预防真菌感染成功率),其中2项[8-9]为多中心 RCT,2项[7,10]为单中心RCT,4项研究均提供了不良反应发生率方面的数据。本系统评价纳入的4项研究均对结局指标进行了明确的定义,然各研究间相同指标的定义也有不尽相同之处,故研究结果不排除有偏倚可能。
伏立康唑于2002年被美国食品和药物管理局(FDA)批准上市[11]。目前剂型有口服和注射剂,口服生物利用度高,主要对念珠菌属(包括光滑念珠菌及克柔念珠菌)、新型隐球菌、曲霉属、镰刀霉属和荚膜组织胞浆菌等病原真菌均有较好抗菌活性,对曲霉疗效可达到两性霉素B水平,但对接合菌类(如毛霉等)无抗菌活性,不良反应为肝功能损害和视觉改变(约1/3患者),该类药物的作用机制为通过抑制真菌细胞膜麦角甾醇的生物合成,使真菌细胞膜合成受阻,影响细胞膜的通透性而抑制其生长,并可抑制真菌孢子转变为菌丝体。两性霉素B为传统的广谱抗真菌药物,具有很强的抗菌效果,然而其严重肝肾毒性等不良反应率高,故其盐类、脂质体等复合制剂受到重视[12],减轻其不良临床事件,但依然限制了其临床应用。氟康唑抗菌谱相对较窄,主要对白念珠菌有抗菌活性,对侵袭性曲霉及非白念珠菌中的克柔念珠菌等无效[13-16]。伊曲康唑的抗菌谱也较广,与伏立康唑同属于唑类抗真菌药,但其口服吸收少、生物利用度低,静脉用药则对溶媒有独特的要求,易与其他药物间产生药物相互作用[17]。
伏立康唑作为新一代的唑类抗真菌药,以其较强的广谱抗菌疗效及相对较好的临床安全性,近年来越来越为临床医师所接受,其临床应用价值尚有待时间的考验。
[1] Slavin MA,Osborne B,Adams R,et al.Efficacy and safety of fluconazole prophylaxis for fungal infections after bone marrow transplantation:a prospective,randomized,doubleblind study[J].J Infect Dis,1995,171(6):1545-1552.
[2] Goodman JL,Winston DJ,Greenfield RA,et al.A controlled trial of fluconazole to prevent fungal infections in patients undergoing bone marrow transplantation[J].N Engl J Med,1992,326(13):845-851.
[3] Bodey GP,Anaissie EJ,Elting LS,et al.Antifungal prophylaxis during remission induction therapy for acute leukemia fluconazole versus intravenous amphotericin B[J].Cancer,1994,73(8):2099-2106.
[4] Winston DJ,Chandrasekar PH,Lazarus HM,et al.Fluconazole prophylaxis of fungal infections in patients with acute leukemia:Result of a randomized placebo-controlled,doubleblind,multicenter trial[J].Ann Intern Med,1993,118(7):495-503.
[5] Wolff SN,Fay J,Stevens D,et al.Fluconazole vs low-dose amphotericin B for the prevention of fungal infections in patients undergoing bone marrow transplantation:a study of the North American Marrow Transplant Group[J].Bone Marrow Transplant,2000,25(8):853-859.
[6] The Cochrane Collaboration.Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.1.www.cochranehandbook.org/.updated September 2008.
[7] Mandhaniya S,Swaroop C,Thulkar S,et al.Oral voriconazole versus intravenous low dose amphotericin B for primary antifungal prophylaxis in pediatric acute leukemia induction:a prospective,randomized,clinical study[J].J Pediatr Hematol Oncol,2011,33(8):333-341.
[8] Marks DI,Pagliuca A,Kibbler CC,et al.Voriconazole versus itraconazole for antifungal prophylaxis following allogeneic haematopoietic stem-cell transplantation[J].Br J Haematol,2011,155(3):318-327.
[9] Winqard JR,Carter SL,Walsh TJ,et al.Randomized,doubleblind trial of fluconazole versus voriconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation[J].Blood,2010,116(24):5111-5118.
[10] Mattiuzzi GN,Cortes J,Alvarado G,et al.Efficacy and safety of intravenous voriconazole and intravenous itraconazole for antifungal prophylaxis in patients with acute myelogenous leukemia or high-risk myelodysplastic syndrome[J].Support Care Cancer,2011,19(1):19-26.
[11] Vfend[package insert].New York,NY:Pfizer Inc.2006.
[12] Oakley KL,Moore CB,Denning DW.Comparison ofinvitroactivity of liposomal nystatin against Aspergillus species with those of nystatin,amphotericin B (AB)deoxycholate,AB colloidal dispersion,liposomal AB,AB lipid complex,and itraconazole[J].Antimicrob Agents Chemother,1999,43(5):1264-1266.
[13] Dilflucan[package insert].New York,NY:Pfizer Inc.2004.
[14] Goodman JL,Winston DJ,Greenfield RA,et al.A controlled trial of fluconazole to prevent fungal infections in patients undergoing bone marrow transplantation[J].N Eng J Med,1992,326(13):845-851.
[15] Kappe R,Osterziel KJ,Ruchel R,et al.Fluconazole in patients at risk from invasive aspergillosis[J].J Med Vet Mycol,1993,31(3):259-261.
[16] Wingard JR,Merz WG,Rinaldi MG,et al.Increase inCandidaKruseiinfection among patients with bone marrow transplantation and neutropenia treated prophylactically with fluconazole[J].N Engl J Med,1991,325(18):1274-1277.
[17] Sporanox[package insert].Titusville,NJ:Janssen Pharmaceutica Products,2006.
Efficacy and safety of voriconazole in prophylaxis of invasive fungal infections:a meta-analysis
LIFangfang,XUYanli,ZHANGXiuqun,ZH ANGXuezhong. (DepartmentofHematology,NanjingHospitalAf filiatedtoNanjingMedicalUniversity,Nanjing210006,China)
ObjectiveTo systematically review the efficacy and safety of voriconazole in the prophylaxis of invasive fungal infections.MethodsThe Pub Med,Cochrane Library,EMbase,CNKI,CBM,VIP databases were searched for an interval from outset of each database through December 2011 to find out the randomized controlled trial of voriconazole in prophylaxis of deep fungal infections.Two reviewers independently assessed the quality of the included studies and extracted relevant data.The Review Manager(version 5.0)software was used to analyze the data.ResultsA total of 4 studies involving 1 288 patients were included.Meta-analysis showed that there was not significant difference between voriconazole and amphotericin B in terms of prophylaxis failure rate[OR=0.75,95%CI(0.32-1.77),P=0.52],incidence of IFI[OR =0.62,95%CI(0.35-1.09),P=0.09]and incidence of paropsis[OR=1.14,95%CI(0.59-2.18),P=0.07].The incidence of adverse effects was significantly lower in voriconazole-treated patients than in amphotericin B-treated patients[OR=0.15,95%CI(0.04-0.55),P=0.005]and itraconazole-treated patients[OR=0.54,95%CI(0.37-0.78),P=0.001].The rate of successful prophylaxis in voriconazole-treated patients was significantly higher than in the itraconazole group [OR=1.96,95%CI(1.35-2.84),P=0.0004].The incidence of the adverse events leading to discontinuation of treatment was similar between voriconazole and itraconazole[OR=2.05,95%CI(0.74-5.72),P=0.017].ConclusionsAs a highly effective and low toxic antifungal agent,voriconazole is usually used for prophylaxis of invasive fungal infections.Its real value in this situation remains to be confirmed.
voriconazole; amphotericin B; fluconazole; itraconazole; invasive fungal infection; meta-analysis; systematic review
R978.5
A
1009-7708(2012)06-0453-06
南京医科大学附属南京医院(南京市第一医院)血液科,210006。
李方方(1987—),女,硕士研究生,主要从事白血病临床诊疗与研究。
徐燕丽,E-mail:xuyanli62@sohu.com。
2012-04-18
·论著·

