播散性放线菌病1例报道及文献复习
刘丽燕, 楼俪泓, 姜海琼, 周 新
播散性放线菌病1例报道及文献复习
刘丽燕, 楼俪泓, 姜海琼, 周 新*
目的通过病例报道及文献复习探讨放线菌病的临床特点,提高临床医师对该病的认识。方法报告上海交通大学附属第一人民医院收治的播散性放线菌病1例并复习相关文献。结果患者临床表现为发热、头痛、恶心、呕吐伴行走不稳,影像学检查示脑、肺、前列腺多发病灶,多种多次病原学检查阴性。抗感染治疗效果不佳,开颅活检病理示肉芽组织形成伴革兰阳性放射状丝状杆菌,遂诊断为放线菌病。结论放线菌感染罹患率低,而播散性放线菌病临床上更为少见,易误诊为肿瘤或结核,需引起临床医师的重视,以早期诊断、及时治疗,改善预后。
放线菌病; 播散性放线菌病; 革兰阳性放射状丝状杆菌
放线菌病是一类由放线菌引起的慢性化脓性肉芽肿性感染。该病较少见,可发生于身体任何部位,主要侵犯颌颈部和胸腹部,播散性放线菌病临床上更为少见,其临床和影像学表现复杂多变,易被误诊为肿瘤或结核。本文报道我院收治的1例播散性放线菌病病例,同时复习相关文献以提高对该病的认识和临床诊治能力。
病例资料
患者男,47岁,荷兰国籍。因“头痛5周,加重2周伴行走不稳1周”于2011年12月12日入院。患者于2011年11月8日开始出现间歇性头痛不适,11月28日头痛加重伴恶心呕吐,同时咳嗽、咯黄痰伴低热(37.5℃左右),并有腹泻每天约7次伴乏力、纳差。12月5日出现行走不稳并向右偏斜症状,12月9日我院查血常规示 WBC 12.5×109/L,N 0.527,Hb 135 g/L,PLT 303×109/L。头颅CT示双侧额叶左侧顶叶皮层下,左侧小脑半球多发占位伴脑白质水肿;胸部CT检查示左肺上叶支气管壁增厚、管腔狭窄伴左肺门淋巴结肿大,疑诊左肺上叶阻塞性炎症。12月11日PET-CT检查示颅内多发结节样病灶,左肺上叶团块状影伴阻塞性肺炎,前列腺多发病灶,考虑肺癌,前列腺及脑转移可能,遂收入院治疗。患者自发病以来精神差,纳差,1个月内体重下降2 kg。平时否认喜食生食,否认高血压、糖尿病等慢性病史,否认传染病病史,否认吸烟史,患者曾从事接触动物工作12年,发病前1个月曾至欧洲多国旅游,其父死于肺癌。
患者入院时查体:T 36.9℃,P 86次/min,R 18次/min,BP 120/80 mm Hg,神清,精神萎,体型消瘦反应略迟钝。颈略现抵抗,双肺呼吸音粗,左肺可闻及少许啰音,心腹(-)。前列腺指检及1 cm大小结节,无压痛,双下肢无浮肿。四肢肌张力正常,四肢肌力Ⅴ级。双肱二头肌反射(+),双下肢膝反射(+),余神经系统检查(-)。
治疗经过
入院后患者体温波动于37.2~38.0℃,仍头痛伴恶心呕吐,干咳伴腹泻。给予头孢他啶2.0 g,2次/d抗感染,甘露醇降颅压,酪酸菌、蒙脱石止泻,白蛋白、胸腺肽等加强支持治疗。同时完善检查,先后血培养5次均为阴性,尿常规+尿培养2次,粪常规+粪培养2次均阴性,12月12日血常规示WBC 11.2×109/L,N 0.676,CRP 7 mg/L,血生化示γ-GT 87 u/L,余正常。抗-HIV、RPR+TPPA、PPD试验(1∶10 000)72 h、TB-Ab、TB-DNA、血清寄生虫抗体全套均阴性,G试验2次、GM试验2次、血隐球菌乳胶凝集试验2次均阴性。ANA+ENA、RF、CD全套、抗“O”、T-spot试验均阴性,免疫球蛋白示lgE 244 IUm L,余正常,肿瘤指标前列腺特异性抗原(PSA)5.78μg/L,F/T 10%,余正常。12月13日胸部CT增强检查示左肺上叶片状实变影并有空洞性结节影,左肺门纵隔内多发淋巴结肿大(见图1,2)。12月13日头颅MRI检查示脑实质内(额、颞、顶叶、小脑和脑干)散在多发结节状病灶周围见水肿带,增强后见明显环形强化(见图3,4)。12月15日腰穿示脑脊液压力260 mm H2O,常规示RBC 2.0×106/L,WBC 520×106/L,多核白细胞0.85,单核白细胞0.15,潘氏蛋白试验阳性,生化示氯123.7 mmol/L,总蛋白1.03 g/L,乳酸脱氢酶35.00 u/L,葡萄糖3.3 mmol/L,脑脊液真菌涂片+培养、墨汁涂片找新型隐球菌、TB-Ab、细菌培养、脑脊液寄生虫抗体全套均阴性。12月16日支气管镜见左上肺支气管内黏膜充血表面高低不平。肺泡灌洗液找抗酸杆菌、真菌涂片及培养、细菌培养均阴性,肺泡灌洗液 TB-Ab(+),TB 培养(-)(2个月后),支气管镜刷片病理:未见肿瘤细胞。12月16日前列腺MRI示前列腺周围带脓肿可能(见图5,6)。12月16日复查血常规示 WBC 20×109/L,N 0.835,CRP 42.3 mg/L,红细胞沉降率(ESR)20 mm/h。结合化验及影像学变化排除肿瘤,考虑患者为感染性疾病可能大,遂于12月16日调整抗生素为美罗培南1.5 g每8小时1次联合利奈唑胺600 mg每12小时1次。12月19日拟行肺活检时胸部CT检查示左肺多发实变影及空洞基本吸收,12月20日复查血常规示正常。经治疗患者体温正常,咳嗽腹泻症状消失,头痛好转,但恶心呕吐仍较剧烈,因考虑美罗培南胃肠道不良反应较大,于12月20日起调整抗生素为哌拉西林-他唑巴坦4.5 g每8小时1次联合利奈唑胺600 mg每12小时1次治疗,后于12月20日及12月29日又复查腰穿2次,结果示脑脊液常规RBC分别为1.0×106/L和6.0×106/L,WBC为310×106/L和112×106/L,多核白细胞为0.40和0.35,单核白细胞为0.60和0.65,潘氏蛋白试验均阳性,生化氯分别为117.9 mmol/L及120.3 mmol/L,总蛋白为1.92 g/L及1.58 g/L,乳酸脱氢酶为31.00 u/L及22.00 u/L,葡萄糖为2.5 mmol/L(同时血糖为6.7 mmol/L)及2.4 mmol/L(同时血糖为6.2 mmol/L)。2次脑脊液真菌涂片及培养、墨汁涂片找新型隐球菌、TB-Ab、细菌培养、找抗酸杆菌均阴性,脑脊液TB培养(-)(2个月后),脑脊液涂片病理未见肿瘤细胞。治疗至12月23日再复查头颅MRI示头颅内多发结节灶周围水肿带有所吸收。12月26日复查前列腺MRI示前列腺周围带病变较前有所缩小。此期间患者头痛消失体温正常,但仍有呕吐并顽固性呃逆。为进一步排除结核,于12月29日调整抗生素为头孢曲松2.0 g,2次/d联合万古霉素1.0 g每12小时1次,至2012年1月9日复查头颅MRI示脑内多发结节与2011年12月23日比部分结节病灶有扩大。此期间患者出现顽固性呕吐伴头晕,且于2012年1月初起出现进行性智能下降,不同程度混合型失语,反应迟钝,查体四肢肌张力对称,肌力4级,腱反射对称(+),左下肢病理征(±),脑膜刺激征(±),双侧胫前肌萎缩。考虑患者结核性脑脓肿可能,遂于2012年1月10日至上海市公共卫生中心行诊断性抗结核治疗,方案为异烟肼口服0.5 1次/d,利福平口服0.6 1次/d,乙胺丁醇口服0.75 1次/d,吡嗪酰胺口服0.5 3次/d,同时联合哌拉西林-三唑巴坦及利奈唑胺抗感染。
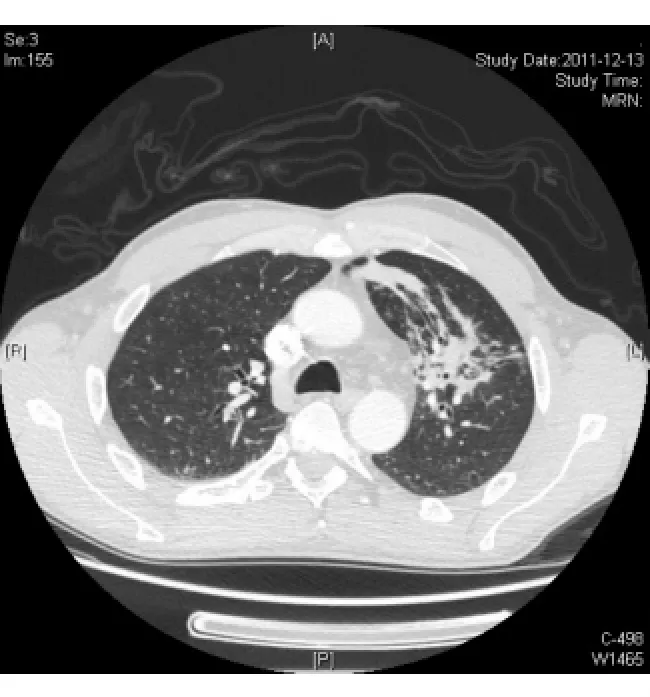
图1 胸部CT+C肺窗FIG.1.Chest CT scan with contrast(lung window)
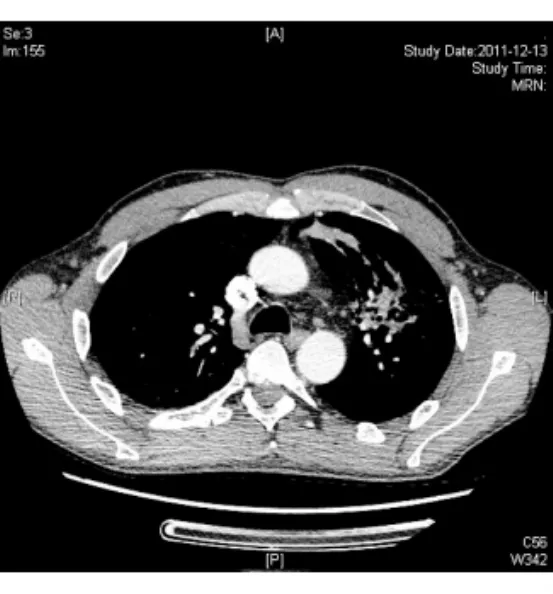
图2 胸部CT+C纵隔窗FIG.2.Chest CT scan with contrast(mediastinal window)
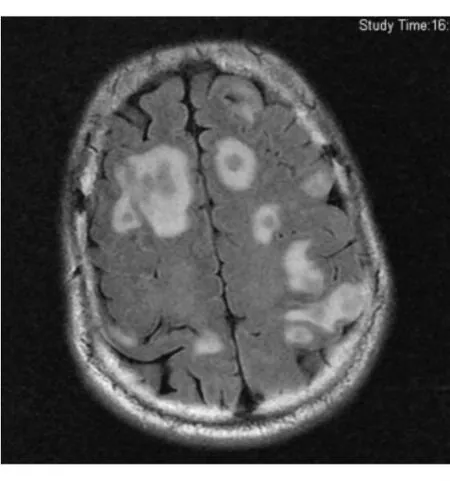
图3 头颅MRI T1+C图像FIG.3.Brain MRI scan with contrast
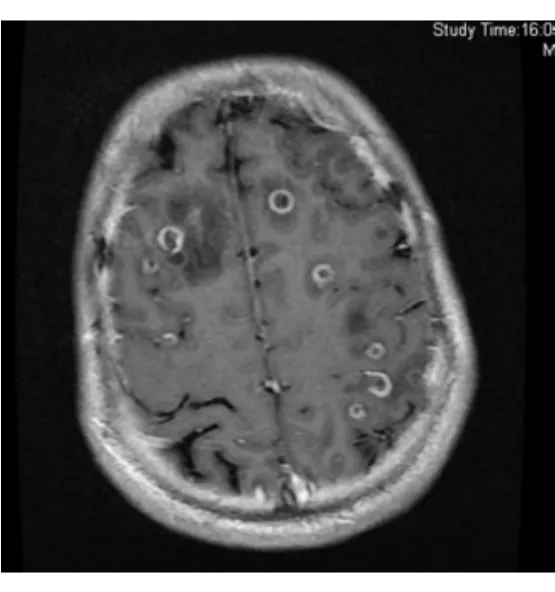
图4 头颅MRI T2 flair图像FIG.4.Brain MRI T2 fluid-attenuated inversion recovery(FLAIR)image
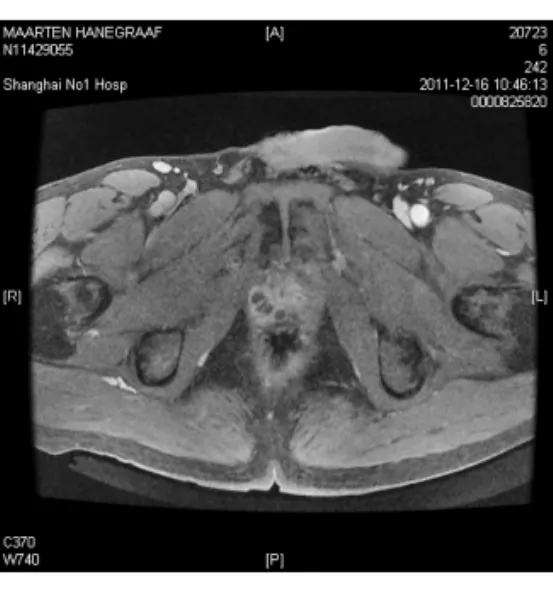
图5 前列腺MRI LAVA图像FIG.5.Prostate MRI LAVA image
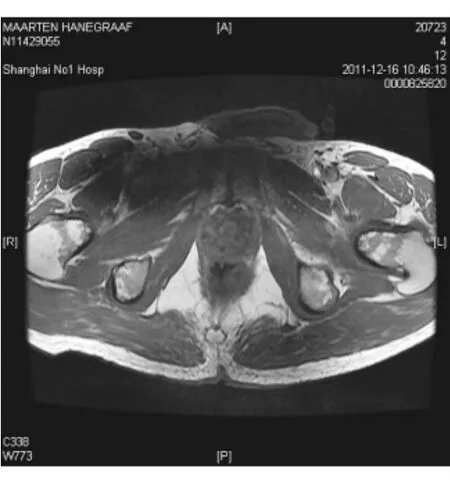
图6 前列腺T1 WI图像FIG.6.Prostate T1 WI image
2012年1月19日患者转入香港St.Teresa医院,1月21日行开颅活检术,从右侧额叶取检脓肿组织3块,标本表现为组织纤维化伴有黄色脓液,病理示肉芽组织形成伴革兰阳性放射状丝状杆菌,ZN染色(-),抗酸杆菌染色(-)。诊断为放线菌病,予大剂量青霉素G 2 400万u/d联合多西环素100 mg/d口服治疗,至2月16日调整抗菌药物为磺胺甲口恶唑2.5 g每8小时1次和利奈唑胺600 mg每12小时1次口服,至3月12日患者出现药物性肝损及骨髓抑制,再次调整抗生素为美罗培南1 g每8小时1次及阿米卡星1 g 1次/d静脉治疗,同时加强对症支持治疗,经治疗患者一般情况明显好转,至4月底已能正常行走进食并能生活自理,复查头颅MRI示脓肿明显缩小且数量亦减少。目前患者仍在接受治疗中。
讨 论
放线菌病是由放线菌引起的一种慢性化脓、肉芽增生性病变。放线菌属原核生物,具有细菌的特征,其增殖不是孢子形成或丝状芽生,而是通过细菌分裂复制,绝大多数为厌氧菌或兼性厌氧菌。放线菌种类繁多,迄今已从人体分离出14种菌属,一般为革兰染色阳性、非抗酸、无孢子的丝状杆菌,对人体致病的有以下6种,衣氏放线菌(Actinomycesisraelii)和戈氏放线菌(A.gerencseriae)、其次为内氏放线菌(A.naeslundi)、溶牙质放线菌(A.odontolyticus)、黏放线菌(A.viscosus)、迈氏放线菌(A.meyeri),其中以衣氏放线菌为最常见致病株[1]。
放线菌病为内源性疾病,人与人或人与动物之间无传染性,可发生在任何年龄,但以中年发病较多,男女比例为2∶1~4∶1[1-2],农民及野外作业者较多见。此病临床少见,发病率在城市为5/10万,农村为城市的10倍[3]。随着口腔卫生的改善和抗生素的广泛应用更大大降低了其发病率。
在正常人口腔中、龋齿、牙周脓肿、扁桃体隐窝、上呼吸道、胃肠道和泌尿生殖道(女性外生殖器)内都可能有放线菌存在,一般情况下不致病,但当机体全身或局部(如皮肤黏膜机械屏障受损)抵抗力降低、尤其是同时伴有其他需氧菌感染而利于厌氧性的放线菌生长时,则可引起放线菌病。
放线菌病临床表现并不特异,诊断较困难。细菌培养及菌群鉴定是诊断该病的确凿依据,但放线菌生长缓慢,培养时间长,需厌氧或微需氧培养,5%CO2可促进其生长,假阴性率较高。脓液中有硫磺颗粒是诊断此病的重要依据,临床使用的简便方法是仔细查看脓液中的硫磺颗粒,并在玻片上压平镜检,镜检时可见菌体排列呈菊花状。若无硫磺颗粒,则取脓液作涂片,革兰染色后镜检,并用厌氧培养,37℃孵育>1周,再取培养物染色镜检。取活检组织切片染色检查也是诊断该病的主要方法,活检组织病理切片示有肉芽肿形成或见“硫磺颗粒”,镜下见革兰阳性放射状丝状杆菌,抗酸染色阴性即可确诊。苏木精-伊红染色时,菌体呈紫色,菌体的棒状末端为菌体蛋白和多糖,即抗原抗体复合体,可染成红色[4]。本例患者脓肿组织虽无“硫磺颗粒”,但病理切片表现与上描述相符,故诊为放线菌病。另国外已有使用分子生物技术进行菌属鉴定的相关报道[5]。
放线菌病按受累部位分为以下临床类型:面颈型,约占60%;胸部型,约占15%;腹盆型,约占20%;皮肤型、脑型、其他组织放线菌病,约占5%[6]。面颈型放线菌病最常见,发病初期局部呈无痛硬结或肿块,临床症状随发病部位、病程进展而有不同,可有发热、盗汗等症状。病程后期在颈部可形成窦道并排出硫磺颗粒。病变多位于下颌骨或下颌下部位,并可以侵及骨组织引起骨髓炎。胸部型放线菌病,可以累及肺部、胸膜、纵隔或胸壁,临床表现以咳嗽、脓痰、咯血、胸痛及发热多见,这些表现类似于常见的呼吸道疾病如肺炎、肺结核、肺癌、支气管扩张等,容易误诊[2,7-8]。腹盆型放线菌病多隐匿,以回盲部多发,结肠、网膜、肝脏、胆囊、肾脏及女性生殖器均可累及,最常见的临床表现为腹部肿块、腹痛、腹泻、便血、月经量增多、消瘦、发热等症状,极易误诊为恶性肿瘤,术前很难确诊,相当部分的病例是在剖腹探查时才被确诊[9-11]。女性生殖器放线菌病常与使用宫内节育器有关[12]。放线菌病蔓延到脊柱时可破坏椎体、压迫脊髓,可产生腰大肌脓肿,还可上行波及胸腔,也可经血液转移至中枢神经系统等部位引起相应病变。皮肤原发性放线菌感染可发生在四肢、躯干、臀部、面部等,形成皮下结节,多发性窦道并排出硫磺颗粒。脑型放线菌病少见,分局限性脑脓肿型及弥漫型2种,主要表现为脑脓肿、脑膜炎或脑膜脑炎、硬膜下积脓、硬膜外脓肿等,临床极易漏诊误诊[13-14]。其他组织如眼结膜、泪小管、膀胱、骨骼、关节、心瓣膜、乳房等部位均有原发性放线菌感染的报道。
放线菌病可以呈现侵袭性特点,呈局部蔓延生长,不受解剖间隙限制[1],这可能是由于放线菌感染后机体产生炎症反应,导致周围肉芽组织形成及纤维组织增生,创造了局部的无氧环境,使得放线菌得以存活和进一步繁殖并逐渐向周边组织扩展,直接侵入临近组织和器官,或者穿破皮肤及黏膜形成瘘道。这使其临床表现类似恶性肿瘤,容易误诊。此患者在就诊初期时,结合其PET-CT,胸部CT检查表现,曾怀疑肺癌脑及前列腺转移,后结合各项实验室指标、动态随访影像学检查、支气管镜及病理、再结合治疗过程中患者的临床表现排除此诊断,明确为感染性病变。放线菌病与结核的鉴别也有一定难度,容易误诊[2,8]。以此患者而言,入院时胸部CT检查示左肺上叶斑片状实变影及条索影,并有空洞性结节影,这与结核的影像学表现相似,虽然其T-spot试验(-),PPD(-),多次找结核分枝杆菌(-),但结合病程,在予以利奈唑胺联合美罗培南、哌拉西林-他唑巴坦治疗后肺部病灶及前列腺病灶均有吸收,脑内病灶也有轻度好转,而利奈唑胺为二线抗结核药物,后停用利奈唑胺,改用头孢曲松及万古霉素后颅内病灶无好转迹象并有增大改变,患者临床症状亦无好转,结合其头颅MRI检查示脑实质内多发结节状环形病灶,并可见环形强化,这符合结核影像学表现,且其反复多次脑脊液检查示低糖,高蛋白,白细胞增多,以单核为主,也符合结核脑脊液检查表现,故我们曾怀疑为结核感染伴血源性播散,直到活检病理结果才确诊为放线菌病。
放线菌病感染时,由于机体不断在感染组织周围形成纤维组织,因此其很少通过淋巴结或血液播散,而这一点正是本例患者特殊之处。本例患者至我院就诊时已有肺部、前列腺、脑多个部位的病变,而原发性脑型放线菌病及前列腺放线菌病极为罕见,常由原发性肺部、腹部、盆腔、面颈部放线菌病血源播散而来[14-15],此患者有明确的肺部病变,故我们认为这是1例血源播散性放线菌病。非常遗憾的是由于患者在我院时拒绝开颅活检,我们未能取得病理,也由于认识不够,我院多次细菌培养未能培养出放线菌。播散性放线菌病临床上罕见,使用Pubmed检索播散性放线菌病仅找到44例病例报告。本例患者为既往体健的中年男性,临床上也未发现任何导致严重免疫缺陷的疾病或其他病因,因此导致其播散性放线菌病的原因不明,可能与发病1个月前多国旅游导致机体抵抗力低下有一定关系。
放线菌病传统治疗建议静脉滴注大剂量青霉素(1 800万~2 400万u/d)2~6周,然后改口服(2~4 g/d)6~12个月[16],但近年来治疗上强调应个体化,具体治疗方案取决于病变情况、感染部位,有否接受手术以及治疗的临床和影像学反应[16-17]。一项研究示16例肺部放线菌病中位治愈时间为静脉滴注青霉素2周,后序贯口服3个月[16]。另近年来有多篇文献报道其疗程也可以<3个月,但对疗程小于3个月的患者需加强随访,以防疾病复发及发生其他并发症[17-18]。在放线菌病治疗中仍需强调高剂量、长疗程以防复发。研究显示放线菌对多种抗生素敏感,当青霉素过敏或耐药时可选用磺胺类药物、红霉素、多西环素、四环素和克林霉素等药物[1,16-17],另有报道左氧氟沙星对放线菌病也有疗效[19]。对播散性放线菌病及病情严重进展快速的放线菌感染而言,通常为混合性感染,常伴有其他细菌的存在,所以应该与广谱抗生素联合应用;对妇科病变者需移除宫内节育器。经内科治疗无效、有脓肿或窦道形成的复杂性放线菌感染需要手术治疗。
该病若能早期诊断,及时治疗,预后较好,治愈率在90%以上[19]。对播散性放线菌病而言预后相对较差,常需要联合内科、外科等多种治疗方式才可见效[20]。此患者虽然来院时就已经有多器官病变,但在诊断上我们还是未能做到及时准确,一定程度上延误了患者的病情,分析本例误诊原因:由于放线菌病是一种少见病,发病率低,而播散性放线菌病临床上更为少见,临床医师对其认识不足,另一方面此患者的影像学表现复杂,与肿瘤及结核鉴别有一定困难。望通过对本病例的总结分析能引起临床各学科医师对该病的重视,开阔诊断思路,避免误诊。
[1] Mabeza GF,Macfarlane J.Pulmonary actinomycosis[J].Eur Respir J,2003,21(3):545-551.
[2] Rupani A,Amonkar G,Deshpande J.Pulmonary actinomycosis masquerading as tuberculosis[J].Indian J Pathol Microbiol,2009,52(3):438-439.
[3] Hamid D,Baldauf JJ,Cuenin C,et al.Treatment strategy for pelvic actinomycosis:case report and review of the literature[J].Eur J Obstet Gynecol Reprod Biol,2000,89(2):197-200.
[4] Stewart AE,Palma JR,Amsberry JK.Cervicofacial actinomycosis[J].Otolaryngol Head Neck Surg,2005,132(6):957-959.
[5] Renvoise A,Raoult D,Roux V.Actinomyces massiliensis sp.nov.,isolated from a patient blood culture[J].Int J Syst Evol Microbiol,2009,59(Pt 3):540-544.
[6] Uehara Y,Takahashi T,Yagoshi M,et al.Liver abscess of Actinomyces israelii in a hemodialysis patient:case report and review of the literature[J].Intern Med,2010,49(18):2017-2020.
[7] El Ghannam H,Bai C,Qiao R.Pulmonary actinomycosis presenting as a mass-like consolidation [J].South Med J,2010,103(1):81-83.
[8] Elkambergy H,Irani F,Okoli K,et al.Pulmonary actinomycosis:the great masquerader[J].BMJ Case Rep,2009,pii:bcr07.2008.0374.
[9] Lim KH,Kim JH,Jeong JY.Laparoscopic resection of omental actinomycosis forming fistula with transverse colon and jejunum:a case report and review of literature[J].Surg Laparosc Endosc Percutan Tech,2011,21(5):e288-290.
[10] Kaszuba M,Tomaszewska R,Pityński K,et al.Actinomycosis mimicing advanced cancer[J].Pol Arch Med Wewn,2008,118(10):581-584.
[11] Sung HY,Lee IS,Kim SI,et al.Clinical features of abdominal actinomycosis:a 15-year experience of a single institute[J].J Korean Med Sci,2011,26(7):932-937.
[12] El Amine El Hadj O,Laabidi B,Msakni I,et al.Abdominopelvic actinomycosis associated with an intrauterine device[J].Tunis Med,2011,89(8-9):722-723.
[13] Bellesi M,Di Bella P,Provinciali L.Diagnostic difficulties with central nervous system actinomycosis[J].Neurol Sci,2011,32(5):945-947.
[14] Ham HY,Jung S,Jung TY,et al.Cerebral actinomycosis:unusual clinical and radiological findings of an abscess[J].J Korean Neurosurg Soc,2011,50(2):147-150.
[15] De Souza E,Katz DA,Dworzack DL,et al.Actinomycosis of the prostate[J].J Urol,1985,133(2):290-291.
[16] Wong VK,Turmezei TD,Weston VC.Actinomycosis[J].BMJ,2011,343:d6099.
[17] Choi J,Koh WJ,Kim TS,et al.Optimal duration ofⅣand oral antibiotics in the treatment of thoracic actinomycosis[J].Chest,2005,128(4):2211-2217.
[18] Kolditz M,Bickhardt J,Matthiessen W,et al.Medical management of pulmonary actinomycosis:data from 49 consecutive cases[J].J Antimicrob Chemother,2009,63(4):839-841.
[19] Ferreira Dde F,Amado J,Neves S,et al.Treatment of pulmonary actinomycosis with levofloxacin[J].J Bras Pneumol,2008,34(4):245-248.
[20] Joshi V,Koulaouzidis A,McGoldrick S,et al.Actinomycotic liver abscess:a rare complication of colonic diverticular disease[J].Ann Hepatol,2010,9(1):96-98.
A case report of disseminated actinomycosis and literature review
LIULiyan,LOULihong,JIANGHaiqiong,ZHOUXin. (InternationalMedicalCareCenter,AffiliatedFirstPeople′sHospitalofShanghaiJiaotongUniversity,Shanghai200080,China)
ObjectiveTo describe the clinical features of actinomycosis to improve clinicians′awareness of the disease.MethodsWe reported a case of 47-year-old male with disseminated actinomycosis in our hospital and reviewed relevant literature.The patient′s clinical manifestations included fever,headache,nausea and vomiting associated with ataxic gait.Radiographic examination revealed multiple lesions in his brain,lungs and prostate.The results of various pathogenic tests were negative.ResultsThe patient did not respond to anti-infective therapy.Craniotomy biopsy showed granulation tissue with gram-positive radial filamentous rod bacteria.Actinomycosis was diagnosed on the basis of this finding.ConclusionsThe incidence of actinomycosis is very low,especially disseminated actinomycosis in clinical setting.It is easily misdiagnosed as a tumor or tuberculosis.Clinicians should pay more attention to early diagnosis and treatment so as to improve the prognosis.
actinomycosis; disseminated actinomycosis; gram-positive radial filamentous rod bacteria
R519.1
A
1009-7708(2012)06-0419-05
上海交通大学附属第一人民医院 国际医疗保健中心,上海 200080;*呼吸科。
刘丽燕(1976—),女,主治医师,硕士,主要从事胰腺疾病的诊治。
周新,E-mail:xzhou53@163.com。
2012-04-16
·论著·

