福辛普利抑制LPS诱导的人肾小管上皮HK-2细胞TAK1表达
黄文辉,卢守燕*,汤 羽
(甘肃省人民医院1.肾内科;2.检验科,甘肃兰州730000)
福辛普利抑制LPS诱导的人肾小管上皮HK-2细胞TAK1表达
黄文辉1,卢守燕1*,汤 羽2
(甘肃省人民医院1.肾内科;2.检验科,甘肃兰州730000)
目的 探讨福辛普利(FOS)对脂多糖(LPS)诱导的人肾小管上皮细胞(HK-2)增殖及对转化生长因子β激活激酶(TAK1)表达的影响。方法 体外培养正常HK-2细胞,分为3组:对照组(Ctrl)、LPS诱导组(10 μg/L)、FOS干预组(LPS 10 μg/L+FOS 1×106mol/L)。细胞培养12、24和48 h,以甲基噻唑基四唑(MTT)法检测细胞增殖情况,酶联免疫吸附(ELISA)法观察细胞上清纤维黏连蛋白(FN)变化,Western blot法检测TAK1、FN蛋白表达,实时荧光定量PCR检测TAK1mRNA的含量。结果 LPS诱导组较对照组细胞的增殖水平(在48 h分别为0.462±0.013及0.363±0.014)、胞质中FN的含量均显著增高,且自12 h开始TAK1蛋白(在48 h分别为1.627±0.101及0.547±0.010)及mRNA表达水平上调(P<0.01,P<0.05),FOS干预组细胞增殖(在48 h为0.396±0.011)、FN的含量及TAK1的表达(在48 h蛋白表达为1.308±0.097)较同时间点LPS组(在48 h蛋白表达为1.627±0.101)显著下调(P<0.01)。结论FOS可能通过抑制HK-2的增生与活化,减轻细胞外基质FN的沉积,起到延缓肾间质纤维化的作用。
福辛普利;人肾小管上皮细胞;转化生长因子β激活激酶;肾间质纤维化
许多研究表明,在各种慢性肾脏疾病进展过程中,肾小管上皮细胞、肾间质成纤维细胞等肾间质细胞在各种细胞因子的作用下,相互促进肾小管间质纤维化的发生与发展[1]。其中转化生长因子-β1(transforming growth factor-β1,TGF-β1)是重要的致纤维化因子,可以促进小管上皮细胞分泌细胞外基质包括纤维连接蛋白(fibronectin,FN)的产生[2]。而转化生长因子β激活激酶(TGFβ-activated kinase 1,TAK1)是TGF-β1下游信号分子,是丝裂原活化蛋白激酶 (mitogen-activated protein kinases,MAPKs)家族成员之一,与许多疾病的发生发展有关[3]。血管紧张素转换酶抑制剂(angiotension converting enzyme inhibitors,ACEI)福辛普利(fosinopril,FOS)已被大量肾脏疾病动物模型及临床研究证实,其具有延缓肾功能恶化、保护肾脏的作用[4],然而关于FOS对人肾小管上皮细胞(human renal tubular epithelial cells,HK-2)作用的研究较少。因此,本研究观察FOS对脂多糖(Lipopolysaccharide,LPS)诱导下HK-2增殖、分泌细胞外基质FN及对TAK1表达的影响,探讨FOS肾保护作用的可能机制。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:福辛普利(上海施贵宝公司);优级胎牛血清(杭州四季青公司),F12/DMEM(1∶1)培养液、Hepes、胰蛋白酶(Gibco 公司),纤维连接蛋白(FN)ELISA试剂盒(ADL公司),脂多糖(LPS)(Sigma公司),Trizol(Invitrogen公司),兔抗大鼠TAK1多克隆抗体、鼠抗FN、β-actin单克隆抗体(Cell Signaling公司),HRP标记羊抗兔、抗鼠IgG二抗(Santa Cruz公司),PVDF Western转印膜、ECL Plus化学发光试剂盒(Millipore公司),RIPA裂解液(北京普利莱公司),PCR引物(上海英骏公司)。
1.1.2 动物与细胞:清洁级雄性Wistar大鼠10只,体质量160~180 g,由兰州大学实验动物中心提供,合格证号SCXK(甘)2004-2006。正常人近端肾小管上皮细胞系HK-2由兰州陆军总医院细胞实验室惠赠。
1.2 含药血清的制备及HK-2培养
每日灌胃给大鼠福辛普利10 mg/kg,共7 d,获得含药血清,对照组给予等体积0.9%氯化钠注射液,于末次给药后1h心脏穿刺取血,3 000 r/min离心10 min分离血清,56 ℃水浴30 min灭活,0.22 μm滤膜过滤除菌,-20℃冰箱保存备用。HK-2接种于含10%胎牛血清(FBS)的F12/DMEM(F/D 1∶1)培养液中,37℃ 5%CO2培养箱孵育。细胞生长至80% ~90%汇合时传代培养,取对数生长期常规消化后以1×105/mL接种于6孔培养板,至亚融合状态以无血清F/D培养24 h,使细胞进入静止期,弃旧培养液,加入含相应试剂的10%胎牛血清F/D完全培养液培养。
1.3 细胞分组及样品收集
将细胞分为3组:对照组(正常培养液)、LPS诱导组(LPS 10 μg/L)以及 FOS 干预组(LPS 10 μg/L+FOS 1×106mol/L)。分别培养12、24 和48 h,以MTT法检测细胞增殖情况,收集细胞上清液,离心后-80℃保存备用ELISA检测,收集细胞用于提取蛋白及mRNA。
1.4 指标检测及方法
1.4.1 细胞增殖实验:HK-2接种于96孔板,亚融合状态时同步后按上述分组孵育,实验重复3次。在各时间点分别加入含1 g/L MTT培养液100 μL孵育4 h,弃上清,加入二甲基亚砜(DMSO)溶解,对照组直接加DMSO定零点值,充分震荡后,在酶标仪上用检测波长570 nm、参考波长630 nm作比色分析,测各孔吸光度值(A)。
1.4.2 ELISA法测定FN含量:按ELISA检测试剂盒说明书进行操作,各时间点各组细胞分别取培养上清液100 μL,加入酶标板孔内,依次加入各种试剂,酶标仪492 nm处检测标准品及样品A值。
1.4.3 Western印迹检测细胞TAK1及FN蛋白的表达:各时间点收集各组细胞,加入300 μL含有蛋白酶抑制剂的RIPA裂解液冰浴提取总蛋白,BCA法测定总蛋白浓度。各组取等量蛋白样品上样,加入5×上样缓冲液12%SDS-PAGE电泳90 min,转膜(PVDF膜)90 min,5%脱脂奶粉室温封闭2 h,TBST洗膜3次 ×10 min,分别加入一抗(TAK1 1∶500,FN 1∶1 000)摇床4℃过夜,TBST洗 3次 ×10 min,用HRP标记的二抗(1∶5 000)孵育2 h,TBST洗3次×10 min,加入ECL化学发光试剂,X胶片曝光、显影和定影,对照Marker确定特异性目的条带,扫描图像。同一张膜曝光后以0.5%SDS洗脱抗体,再以β-actin抗体(1∶1 000)孵育杂交,作为内参照。以累积吸光度(IA)比值表示表达量(目的蛋白条带/内参蛋白条带)。
1.4.4 RT-PCR法检测细胞TAK1mRNA的表达:收集各时间点各组细胞,Trizol提取总RNA,紫外分光光度仪测定RNA浓度。Rotor-Gene 3000荧光实时定量PCR仪上进行两步法Real Time PCR反应。2 μg总RNA利用反转录酶PrimeScriptTM缓冲液进行反转录反应,将 mRNA反转录成 cDNA,然后以25 μL体系进行 PCR扩增,扩增条件为:预变性95℃ 10 s,变性95℃ 5 s,退火、延伸60℃ 30 s,共40个循环。PCR引物序列如下:TAK1正义链:5'-C CATCCCAATGGCGTATCTTACA-3',反义链:5'-TCAT CCTGGTCCAATTCTGCAA-3',产物190 bp;β-actin 正义链:5'-GCAAGCAGGAGTATGACGAGT-3',反义链:5'-CTGCGCAAGTTAGGTTTTGTC-3',产 物 112 bp。每个样本重复3次,以β-actin为内参照,采用相对定量的2-△△CT法分析PCR结果。
1.5 统计学分析
应用SPSS16.0软件,计量数据用均数±标准差(±s)表示。多组间数据比较采用单因素方差分析,其中两组间比较用t检验。
2 结果
2.1 HK-2细胞增殖情况
与同时间点对照组相比,LPS诱导组细胞明显增殖,且细胞形态学发生改变,从原有典型的铺路石样上皮细胞形态转变为长梭形,类似于成纤维细胞(P<0.01,P<0.05);FOS干预组细胞增殖速度较同时间点LPS组比较明显减缓(P<0.01)(表1)。
表1 不同时间MTT检测各组HK-2细胞增殖情况Table 1 HK-2 proliferation detected by MTT of different groups in different time(±s,A value,n=6)
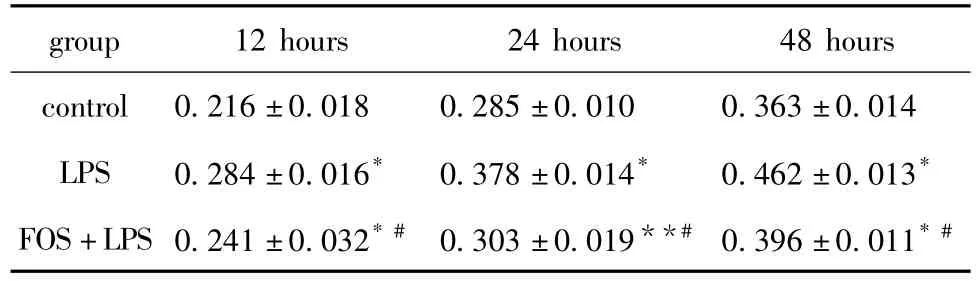
表1 不同时间MTT检测各组HK-2细胞增殖情况Table 1 HK-2 proliferation detected by MTT of different groups in different time(±s,A value,n=6)
*P<0.01,**P<0.05 compared with control group;#P<0.01 compared with LPS group.
group 12 hours 24 hours 48 hours control 0.216±0.018 0.285±0.010 0.363±0.014 LPS 0.284±0.016* 0.378±0.014* 0.462±0.013*FOS+LPS 0.241±0.032*# 0.303±0.019**# 0.396±0.011*#
2.2 HK-2细胞培养上清中FN含量检测
在常规培养条件下,对照组细胞可分泌少量FN;随着培养时间的延长,LPS组细胞FN含量均有一定程度的增加,且显著高于同时间点对照组(P<0.01);FOS干预组细胞FN含量显著低于同时间点LPS组(P<0.01)(表2)。
表2 各组HK-2细胞不同时间FN含量的比较Table 2 Comparison of FN levels in HK-2 of different groups in different time(±s,A value,n=8)
*P<0.01 compared with control group;#P<0.01 compared with LPS group.
group 12 hours 24 hours 48 hours control 0.212±0.014 0.239±0.017 0.249±0.010 LPS 0.311±0.015* 0.377±0.025* 0.518±0.031*FOS+LPS 0.252±0.013# 0.305±0.016# 0.352±0.017#
2.3 HK-2细胞TAK1及FN蛋白的表达
在常规培养条件下,TAK1及FN蛋白在对照组有少量表达,LPS诱导后,各时间点TAK1及FN蛋白表达明显高于对照组(P<0.01);FOS干预组在各时间点对LPS诱导的HK-2分泌TAK1及FN表达明显下降(P<0.01)(表3,图1)。
表3 各组HK-2细胞不同时间TAK1和FN蛋白的表达Table 3 TAK1 and FN protein expressions in HK-2 of different groups in different time(±s,n=5)
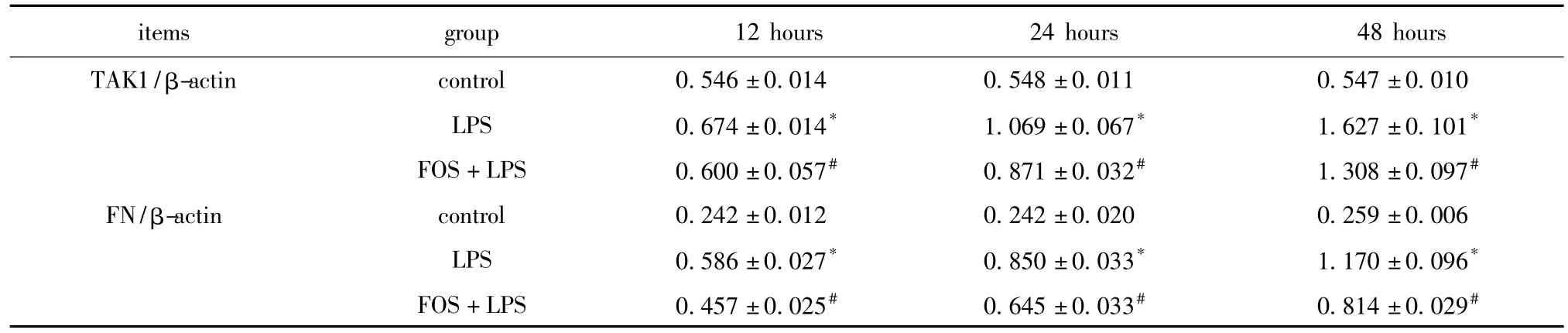
表3 各组HK-2细胞不同时间TAK1和FN蛋白的表达Table 3 TAK1 and FN protein expressions in HK-2 of different groups in different time(±s,n=5)
*P<0.01 compared with control group;#P<0.01 compared with LPS group.
items group 12 hours 24 hours 48 hours TAK1/β-actin control 0.546±0.014 0.548±0.0110.547±0.010 LPS 0.674±0.014* 1.069±0.067* 1.627±0.101*FOS+LPS 0.600±0.057# 0.871±0.032# 1.308±0.097#FN/β-actin control 0.242±0.012 0.242±0.020 0.259±0.006 LPS 0.586±0.027* 0.850±0.033* 1.170±0.096*FOS+LPS 0.457±0.025# 0.645±0.033# 0.814±0.029#

图1 各组细胞不同时间TAK1和FN蛋白的表达Fig 1 Expressions of TAK1 and FN protein in HK-2 of different groups in different time
2.4HK-2细胞TAK1 mRNA的表达
HK-2细胞TAK1mRNA于LPS诱导12 h时表达开始上调,各时间点表达量均显著高于对照组(P<0.01);FOS干预组TAK1mRNA表达量与同时间点相比显著下降(P<0.01)(表4)。
表4 各组HK-2细胞不同时间TAK1 mRNA的表达Table 4 The expression of TAK1 mRNA in HK-2 of different group in different time(±s,2 -△△CT,n=5)

表4 各组HK-2细胞不同时间TAK1 mRNA的表达Table 4 The expression of TAK1 mRNA in HK-2 of different group in different time(±s,2 -△△CT,n=5)
*P<0.01 compared with control group;#P<0.01 compared with LPS group.
group 12 hours 24 hours 48 hours control 1.000±0.000 1.046±0.020 1.042±0.027 LPS 1.655±0.032* 2.421±0.217* 3.461±0.215*FOS+LPS 1.355±0.027# 1.559±0.139# 2.593±0.318#
3 讨论
肾间质纤维化是常见的肾脏病理过程,肾脏固有细胞中,肾小管上皮细胞在许多因素包括细胞因子的诱导下,可以转变为肌成纤维细胞,参与肾间质纤维化,TGF-β1被认为是最重要的致纤维化因子之一[5]。由于肾小管上皮细胞的存在,其转分化过程的进展程度对于肾脏病的预后有着重要意义,故寻找有效的抑制肾小管上皮细胞转分化及致纤维化因子活化的因素,对于缓解肾脏疾病的进展至关重要。
TAK1最初被认为是MAPKKK家族成员之一,研究证明,在包括LPS、炎性反应因子等各种细胞外刺激的作用下,TAK1的苏氨酸酪氨酸被双磷酸化而激活[6]。TAK1通路下游激酶依次被磷酸化激活后的作用底物为一些转录因子,可导致多种重要基因产物表达上调,以及细胞表面受体的表达增多[7]。在肾间质纤维化过程中的不同阶段,炎性反应因子和相关细胞因子的释放、ECM的产生、肾小管上皮细胞表型转化可能有TAK1的参与,但目前这方面的研究较少,本研究应用细胞培养技术,探寻在LPS诱导下HK-2中TAK1的表达,为进一步寻找促纤维化因子提供实验依据。
FOS是一种新型ACEI,经肝、肾双通道排泄,可以降低肾小球内压力,减少尿蛋白,延缓肾功能受损的进展,具有很好的肾保护作用[8]。但FOS对肾脏保护作用的机制尚不完全清楚,既往对FOS保护肾脏作用机制的研究大多是从血流动力学方面着手的,比如FOS可以通过抑制肾素-血管紧张素系统(renin-angiotensin system,RAS)的过度激活,降低血浆和组织中血管紧张素Ⅱ(AngⅡ)的生成,达到抗纤维化的作用[9]。
本研究以HK-2为研究对象,观察FOS对体外培养HK-2增殖及TAK1表达的影响。从PCR及Western印迹结果来看,LPS可诱导HK-2表达TAK1增加,经过FOS干预后,HK-2表达TAK1蛋白及mRNA水平均下降,提示TAK1信号通路在LPS诱导的HK-2细胞增殖中起了重要作用,FOS可能通过影响TAK1信号通路,下调TAK1蛋白及mRNA的表达,从非血流动力学方面起到了肾脏保护作用。
总之,FOS可能通过抑制HK-2的增生与活化,减轻细胞外基质FN的沉积,从而起到延缓肾间质纤维化的作用,但其确切机制仍有待进一步研究。
[1]曹建南,郭汉城,丘昭文,等.MG-132对TGF-β1诱导的人肾小管上皮细胞转分化与凋亡的影响[J].中国中西医结合肾病杂志,2009,10:404-408.
[2]殷薇,肖平,黄安兰,等.虫草菌液拮抗人白蛋白致HK-2细胞增殖及TGF-β1、FN表达的影响[J].中国现代医学杂志,2009,19:509-512.
[3]Inokuchi S,Aoyama T,Miura K,et al.Disruption of TAK1 in hepatocytes causes hepatic injury,inflammation,fibrosis,and carcinogenesis[J].Proc Natl Acad Sci USA,2010,107:844-849.
[4]张翠平,尚勇,符艳敏.福辛普利联合罗格列酮对早期糖尿病肾病疗效观察[J].现代医药卫生,2009,25:42-43.
[5]谢席胜,刘衡川,樊均明,等.人参皂甙Rb1对转化生长因子-β1诱导的肾小管上皮细胞p47phox的表达及细胞外基质的影响[J].四川大学学报:医学版,2009,40:106-110.
[6]Pang HY,Liu G,Liu GT.Compound FLZ inhibits lipopolysaccharide-induced inflammatory effects via down-regulation of the TAK-IKK and TAK-JNK/p38MAPK pathways in RAW264.7 macrophages[J].Acta Pharmacol Sin,2009,30:209-218.
[7]Mikkelsen SS,Jensen SB,Chiliveru S,et al.RIG-I-mediated activation of p38 MAPK is essential for viral induction of interferon and activation of dendritic cells:dependence on TRAF2 and TAK1[J].J Biol Chem,2009,284:10774-10782.
[8]郝志宏,于力,王丽娜,等.福辛普利对大鼠肾小球系膜细胞增殖及转化生长因子β1表达的影响[J].中华妇幼临床医学杂志,2008,4:21-24.
[9]孟和,安桂凤.福辛普利对高血压病肾损害保护作用的疗效观察[J].药物与临床,2009,47:87-88.
Fosinopril suppresses the expression of TAK1 of the human renal tubular epithelial cells induced by LPS
HUANG Wen-hui1,LU Shou-yan1*,TANG Yu2
(1.Dept.of Nephrology;2.Dept.of Clinical Laboratory,Gansu Provincial Hospital,Lanzhou 730000,China)
ObjectiveTo investigate the effects of fosinopril(FOS)on expression of TAK1 and proliferation of the human renal tubular epithelial cells induced by LPS.MethodsHuman renal tubular epithelial(HK-2)cells were divided into three groups:blank control group(Ctrl),LPS group(10 μg/L),FOS group(LPS 10 μg/L+FOS 1×106mol/L).At 12,24,48 hours,HK-2 proliferation was detected by methyl thiazolyl tetrazolium(MTT)assay.The change of fibronectin(FN)in the supernatants of the cultured HK-2 was detected by enzymelinked immunosorbent assay(ELISA).The protein expressions of TAK1 and FN were measured by Western blot.The mRNA expressions of TAK1 was measured by real-time quantitative PCR.ResultsThe cell proliferation and the expression of FN were increased,and the expressions of protein and mRNA of TAK1 in LPS group were upregulating significantly compared with control group from 12 h(P<0.01,P<0.05),but they were downregulating in FOS group compared with LPS group(P<0.01).ConclusionsFOS probably delays renal interstitial fibrosis by inhibiting proliferation and activation of HK-2 and decreasing accumulation of extracellular matrix.
fosinopril;human renal tubular epithelial cells;TGFβ-activated kinase 1;renal interstitial fibrosis
R 692.6
A
1001-6325(2012)09-1088-05
2011-08-29
2011-12-26
*通信作者(corresponding author):lsylushouyan@163.com

