氯普鲁卡因诱导体外人宫颈癌细胞抑癌基因CDH1、APC和P16启动子去甲基化及基因表达
宋银宏,何 苗,符策岗,龙春燕,汪 磊,王 想,吴林蓉
(三峡大学医学院免疫学教研室,湖北宜昌443002)
氯普鲁卡因诱导体外人宫颈癌细胞抑癌基因CDH1、APC和P16启动子去甲基化及基因表达
宋银宏*,何 苗,符策岗,龙春燕,汪 磊,王 想,吴林蓉
(三峡大学医学院免疫学教研室,湖北宜昌443002)
目的 观察氯普鲁卡因(CP)对人宫颈癌细胞HeLa和CaSki的抑癌基因CDH1、APC及P16启动子甲基化水平和基因表达的影响。方法 用不同终浓度的CP(0、1、1.5、2、3和4 mmol/L)处理癌细胞系HeLa和CaSki及正常人脐静脉内皮细胞HUVEC,MTT法检测细胞生长抑制率;用甲基化特异性PCR(MSP)和RT-PCR检测1.5 mmol/L CP处理后各细胞CDH1、APC及P16启动子甲基化状态及基因表达水平。结果 1.5 mmol/L CP作用96 h后,HeLa和CaSki抑制率分别为66.17% ±5.82%和69.12% ±6.89%,显著高于HUVEC的21.78% ±3.12%,1.5 mmol/L CP处理宫颈癌细胞96 h后,CDH1、APC及P16基因启动子均有不同程度去甲基化,3种基因mRNA均增强或者恢复了表达。结论 CP可以抑制人宫颈癌细胞HeLa和CaSki增殖,诱导HeLa和CaSki的CDH1、APC及P16基因启动子去甲基化,并可增加或者恢复相应基因的表达。
氯普鲁卡因;宫颈癌;抑癌基因;DNA甲基化
普鲁卡因(procaine)是沿用多年的局麻药,研究发现普鲁卡因有去甲基化效应,并对肝癌[1]和肺癌细胞[2]等的生长有抑制作用,但其会使患者产生过敏症状甚至导致死亡[3],因此临床使用受到一定局限。氯普鲁卡因(chloroprocaine,CP)是其衍生物,可安全、广泛地应用于临床麻醉[4]。与普鲁卡因相比,很少发现过敏的临床报道。
本实验用CP作用人宫颈癌细胞HeLa、CaSki及正常细胞系人脐静脉内皮细胞HUVEC,以细胞生长抑制率及上皮型钙黏蛋白基因(E-cadherin,又称CDH1)、多瘤抑制基因1(multiple tumor suppressor 1,MTS1,又称P16)及腺瘤性结肠息肉病蛋白基因(adenomatous polyposis coli,APC)3种抑癌基因为检测对象,评价CP是否具有去甲基化并恢复抑癌基因表达的效应,为临床采用新的更安全的去甲基化药物治疗宫颈肿瘤提供实验依据。
1 材料与方法
1.1 细胞系、药品及试剂
人宫颈癌细胞系CaSki(三峡大学湖北省免疫重点学科实验室保藏),人宫颈癌细胞系HeLa和正常人脐静脉内皮细胞HUVEC(CCTCC),氯普鲁卡因(CP)(中国晋城海斯制药有限公司),MTT(Amresco公司),基因组DNA提取试剂盒(Biomiga公司),Trizol试剂及寡核苷酸引物(Invitrogen公司),DNA修饰试剂盒EZ DNA MethylationTMKit(Zymo公司),反转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit及热启动酶Maxima Hot Start PCR Master Mix(Fermentas公司),DMEM培养基(Gibco公司),胎牛血清(Biochrom AG公司)。
1.2 细胞培养与MTT实验
常规条件培养HeLa、CaSki及HUVEC。选择对数生长期细胞进行实验,将HeLa和CaSki于3 000个/孔、HUVEC于4 000个/孔铺96孔板,分别用0、1、1.5、2、3 和4 mmol/L CP 处理细胞,每个浓度设 4个复孔,每24 h换1次含药液新鲜培养液,分别培养48、72及96 h,按常规方法行MTT实验,最后在全波长酶标仪选择570 nm测吸光度值(A570),细胞生长抑制率=(阴性对照组A570-实验组A570)/阴性对照组A570×100%。
1.3 细胞加药处理
取对数生长期细胞,HeLa和CaSki 2×105/孔,HUVEC 3×105/孔接种于6孔板,培养过夜后,用上述MTT实验筛选出的对宫颈癌细胞均有显著抑制作用,而对HUVEC无明显抑制作用的1.5 mmol/L CP处理各细胞,隔天更换含药液新鲜培养液,分别处理4及5 d后收集细胞,不加药处理的各种细胞为阴性对照。
1.4 基因组DNA的提取和亚硫酸氢盐修饰
用基因组DNA提取试剂盒提取细胞基因组DNA,用微量蛋白/核酸定量仪测其浓度和纯度。各个细胞基因组DNA均取1 μg,用DNA修饰试剂盒EZ DNA MethylationTMKit完成亚硫酸盐修饰。
1.5 MSP检测CDH1、APC、P16基因启动子的甲基化状态
各基因甲基化引物(M)和非甲基化引物(U)序列、退火温度及产物大小见表1。以亚硫酸氢钠修饰后的DNA为模板,PCR反应体系包含5 μL的2×Hot Start PCR Master Mix、3 μL H2O、10 μmol/L上下游引物各0.5及1 μL模板。各个MSP反应条件为:95℃预变性5 min;主循环为95℃变性45 s,退火30 s,72℃延伸45 s,共40个循环;72℃延伸5 min。取5 μL产物电泳。
1.6 RT-PCR 检测 CDH1、APC、P16、HPV16-E6E7和HPV18-E6E7 mRNA的表达
用Trizol提取细胞总RNA,RT-PCR按试剂盒说明进行。各基因引物序列、退火温度及产物大小见表2。PCR反应体系同上述MSP。各个RT-PCR条件为:95℃预变性5 min;主循环为95℃变性30 s,退火60 s,72℃延伸60 s,共30个循环;72℃延伸5 min。取5 μL PCR产物电泳,应用 Gene Genius凝胶成像分析系统进行半定量分析,以各基因和内参照GAPDH的吸光度比值作为各基因mRNA水平相对值。

表1 MSP引物及反应条件Table 1 Primers and conditions for MSP
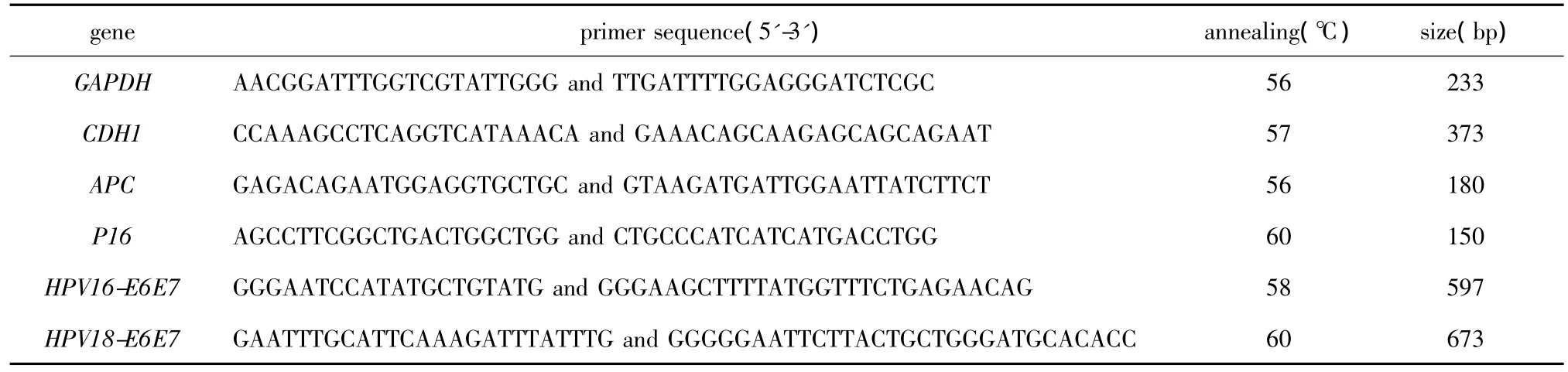
表2 RT-PCR引物及反应条件Table 2 Primers and conditions for RT-PCR
1.7 统计学分析
数据以均数±标准差(±s)表示,采用SPSS 17.0统计软件进行单因素方差分析。
2 结果
2.1 CP对宫颈癌细胞HeLa、CaSki及正常细胞HUVEC增殖的影响
镜下观察,癌细胞体积变小、皱缩变圆、核分裂象少见。HUVEC虽也有类似现象,但数量少。在0~4 mmol/L浓度范围内,随着浓度增加和作用时间延长,CP对细胞生长抑制率均逐渐增大 (P<0.01)。用1.5 mmol/L CP连续处理96 h后,对HeLa和CaSki的抑制率均显著高于HUVEC细胞(P<0.01)(图1)。
2.2 CP对3种细胞抑癌基因CDH1、APC和P16启动子甲基化的影响

图1 1.5 mmol/L CP显著抑制HeLa、CasKi增殖但对HUVEC抑制作用不明显Fig 1 1.5 mmol/L CP inhibited the growth of HeLa and CaSki significantly but not affect the growth of HUVEC apparently
1)CP处理前:CaSki的CDH1、APC和P16基因均既扩增出甲基化条带,也扩增出非甲基化条带。HeLa的CDH1和APC基因只扩增出甲基化条带,而未见非甲基化条带;P16基因则两种条带均有。而HUVEC的CDH1、APC和P16均只能扩增出非甲基化条带(图2A)。2)1.5 mmol/L CP处理96 h后:CaSki的CDH1和APC基因的非甲基化产物条带明显变亮,而甲基化产物条带显著变淡;P16基因则只扩增出非甲基化条带。HeLa的CDH1基因仍然有较明显的甲基化条带,但已可见扩增出非甲基化条带;APC基因的甲基化条带变淡,且出现了非常明显的非甲基化条带;P16基因则只扩增出非甲基化条带。HUVEC处理后,其CDH1、APC和P16基因仍只有非甲基化条带(图2B)。3)1.5 mmol/L CP处理120 h后:3种细胞的CDH1、APC和P16基因均只扩增出非甲基化条带(图2C)。
2.3 CP对3种细胞的CDH1、APC和P16基因表达的影响
1.5 mmol/L CP处理96 h前后,CaSki和 HeLa细胞中均有P16mRNA表达;CaSki细胞在处理前后,CDH1、APC和HPV16E6E7mRNA表达均为阳性,HPV18E6E7mRNA表达均为阴性;HeLa细胞在处理前CDH1和APCmRNA表达均为阴性,处理后均转为阳性,其HPV18E6E7mRNA表达始终为阳性,HPV16E6E7mRNA表达始终为阴性(图3)。CaSki细胞处理后,CDH1、APC及P16mRNA表达均显著增加(分别为P<0.01、P<0.05和P<0.01),而 HPV16E6E7mRNA表达则降低(P<0.01),HPV18E6E7mRNA表达仍为阴性;HeLa细胞处理后,CDH1及APCmRNA表达由阴性转为阳性,并且P16mRNA表达显著上升(P<0.01),HPV16E6E7mRNA和HPV18E6E7mRNA的表达则维持不变(表3)。
3 讨论
研究发现,多种抑癌基因启动子甲基化使其表达沉默是肿瘤发生的重要原因[5]。宫颈癌在我国居妇科肿瘤之首,其细胞系和癌组织标本中也存在P16[6-7]、APC[8-9]及CDH1[6]等抑癌基因启动子区甲基化情况。P16属细胞周期调控基本基因,其编码产物P16蛋白是细胞素依赖性激酶4、6(CDK4、6)抑制物,可负调节细胞增殖及分裂,促进细胞凋亡和衰老;APC编码的APC蛋白是Wnt信号传导途径中最重要的负性调节因子,若其表达异常,则最终启动增殖相关基因转录;CDH1决定上皮型钙黏蛋白表达,其结构与功能变化直接关系癌细胞的生物学行为,影响肿瘤侵袭转移。有报道P16基因启动子甲基化在宫颈癌中占57%,同时还发现CDH1甲基化率在宫颈癌组织中达到52%[6];宫颈癌中APC基因启动子甲基化率明显比正常组织高[9]。本实验结果表明:CDH1、APC和P16在 CaSki中均为半甲基化;在HeLa中P16为半甲基化,CDH1和APC为完全甲基化;而在HUVEC中均为非甲基化状态,这与上述报道基本一致。这些基因由于甲基化而降低表达或表达缺失与宫颈癌发生、发展密切相关,提示纠正这些基因异常甲基化可使失活基因重新表达而逆转癌细胞的恶性行为。

图2 CP对HeLa和CasKi的CDH1、APC和P16基因有去甲基化作用,对HUVEC各基因无影响Fig 2 CP induced demethylation of CDH1,APC and P16 gene in HeLa and CaSki cells but had no effect on those genes of HUVEC cells

图3 CP对各个细胞抑癌基因及癌基因表达的影响Fig 3 The effect of CP on the expression of CDH1,APC,P16 and HPV-E6E7 genes in HUVEC,CasKi and HeLa cells
表3 CP诱导宫颈癌细胞抑癌基因表达增强或者恢复表达而癌基因表达不变或减少Table 3 CP could recover or increase the tumor suppressor genes'expression but not increase the oncogenes'expression in cervical cancer cells(±s)
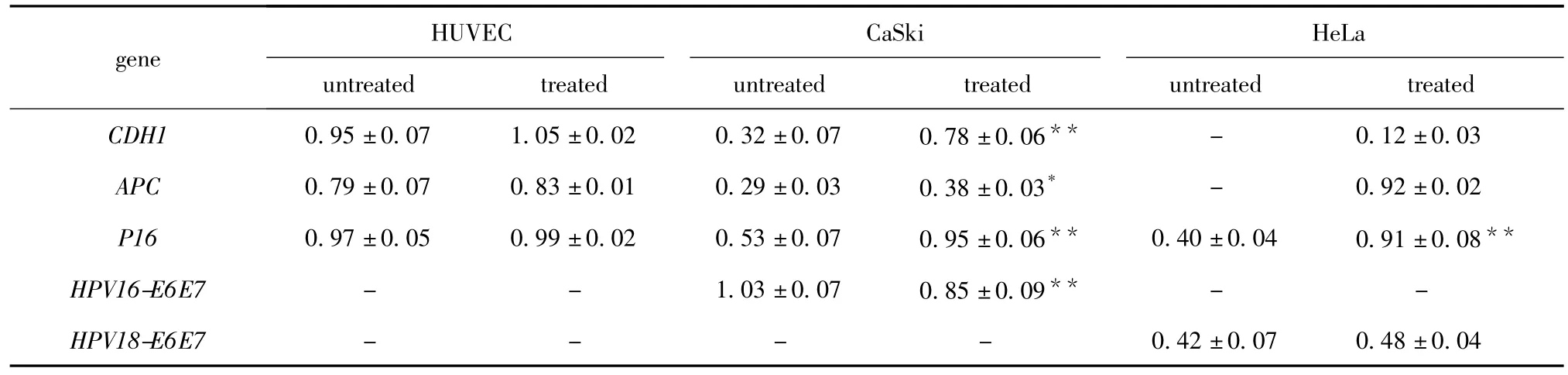
表3 CP诱导宫颈癌细胞抑癌基因表达增强或者恢复表达而癌基因表达不变或减少Table 3 CP could recover or increase the tumor suppressor genes'expression but not increase the oncogenes'expression in cervical cancer cells(±s)
*P <0.05,**P <0.01 compared with untreated group.
gene ed treated CDH1 0.95±0.07 1.05±0.02 0.32±0.07 0.78±0.06**HUVEC CaSki HeLa untreated treated untreated treated untreat-0.42±0.07 0.48±0.04 0.12±0.03 APC 0.79±0.07 0.83±0.01 0.29±0.03 0.38±0.03* - 0.92±0.02 P16 0.97±0.05 0.99±0.02 0.53±0.07 0.95±0.06** 0.40±0.04 0.91±0.08**HPV16-E6E7 - - 1.03±0.07 0.85±0.09** - -HPV18-E6E7----
现最常用DNA甲基化抑制剂为5-氮杂脱氧胞苷等胞苷类似物[10-11],由于细胞毒性较强且致突变,临床应用受限,因此不少研究致力于发现有相同去甲基化作用且毒性小的药物。已发现肼苯哒嗪、Zebularine、普鲁卡因及普鲁卡因胺等药物均有去甲基化作用,且毒副作用小[8,12]。普鲁卡因由于不少患者用后会产生过敏甚至死亡,在临床使用受到一定局限。CP是一种普鲁卡因衍生物,已证实其比普鲁卡因起效快,且副作用小,已安全、广泛应用于临床麻醉[4]。本实验用1.5 mmol/L CP处理96 h时,CaSki和 HeLa的生长抑制率均大于 65%,而HUVEC表现为耐药。同时发现CaSki细胞原本半甲基化的CDH1和APC基因转向非甲基化;而HeLa细胞原本完全甲基化的CDH1和APC基因部分去甲基化;两个癌细胞中半甲基化的P16基因则在CP作用后均完全去甲基化。而且还发现,CaSki细胞3种抑癌基因的mRNA表达水平均显著增加,但癌基因HPV16E6E7表达并无增加,反有下降趋势,另外CP作用前后均未扩增出HPV18E6E7产物,这与CaSki为 HPV16阳性相符;CP作用于 HeLa后,CDH1和APC基因mRNA的表达从阴性转为阳性,同时P16基因表达明显增强,而癌基因 HPV18E6E7的表达没有显著改变,CP作用前后均未扩增出HPV16E6E7产物,这与HeLa为HPV18阳性相符。为进一步探讨CP去甲基化作用,本研究又延长其对细胞的处理时间至120 h,结果发现此时癌细胞的抑癌基因均完全去甲基化,说明随时间延长CP的去甲基化作用增强。这些结果均提示:宫颈癌细胞中CDH1、APC和P16的表达与其启动子甲基化状态相关,CP对甲基化或者半甲基化的抑癌基因具有一定去甲基化作用,并能增强或恢复抑癌基因的表达;另一方面,CP对宫颈癌细胞的作用并没有增加癌基因E6E7的表达,对CaSki细胞作用后,甚至能减少E6E7表达。这说明CP抑制宫颈癌细胞增殖的机制可能不止是对抑癌基因的去甲基化作用。
综上所述,CP能在一定浓度抑制宫颈癌细胞生长,但对正常细胞却无明显抑制作用,且CP同普鲁卡因一样,也具有一定的去甲基化作用,并增加或恢复抑癌基因的表达;另一方面,由于CP在临床上具有效果好,安全性更高等优势,则在以后去甲基化治疗中可以优先考虑CP而不是普鲁卡因。
[1]Tada M,Imazeki F,Fukai K,et al.Procaine inhibits the proliferation and DNA methylation in human hepatoma cells[J].Hepatol Int,2007,1:355 -364.
[2]Gao Z,Xu Z,Hung M,et al.Procaine and procainamide inhibit the Wnt canonical pathway by promoter demethylation of WIF-1 in lung cancer cells[J].Oncol Rep,2009,22:1479-1484.
[3]耿青.预防与减少普鲁卡因引起过敏反应的对策[J].海峡预防医学杂志,2000,6:55.
[4]傅润乔,田玉科.CP麻醉进展[J].中国新药与临床杂志,2006,25:949-954.
[5]Taberlay PC,Jones PA.DNA methylation and cancer[J].Prog Drug Res,2011,67:1 -23.
[6]Jeong DH,Youm MY,Kim YN,et al.Promoter methylation of p16,DAPK,CDH1,and TIMP-3 genes in cervical cancer:correlation with clinicopathologic characteristics[J].Int J Gynecol Cancer,2006,16:1234 -1240.
[7]Attaleb M,Elhamadani W,Khyatti M,et al.Status of p16(INK4a)and E-cadherin gene promoter methylation in Moroccan patients with cervical carcinoma[J].Oncol Res,2009,18:185-192.
[8]宋银宏,张昌菊.肼苯哒嗪对宫颈癌细胞系APC基因异常甲基化的影响[J].基础医学与临床,2007,27:981-984.
[9]Wisman GB,Nijhuis ER,Hoque MO,et al.Assessment of gene promoter hypermethylation for detection of cervical neoplasia[J].Int J Cancer,2006,119:1908 -1914.
[10]张爱凤,张师前,位玲霞.5-氮-2'-脱氧胞苷对人卵巢癌细胞SKOV3凋亡及HMLH1和HMSH2表达的影响[J].基础医学与临床,2007,27:412-416.
[11]刘丽乔,罗达亚,付晶晶,等.5-Aza-CdR对人结肠癌Caco-2细胞系P16基因甲基化状态及其生物学表型的影响[J].基础医学与临床,2011,31:161-165.
[12]Szyf M.DNA methylation and demethylation probed by small molecules[J].Biochim Biophys Acta,2010,1799:750-759.
Effects of chloroprocaine on the methylation status and the expression of CDH1,APC and P16 genes in human cervical cancer cells in vitro
SONG Yin-hong*,HE Miao,FU Ce-gang,LONG Chun-yan,WANG Lei,WANG Xiang,WU Lin-rong
(Dept.of Immunology,Medical College,Three Gorges University,Yichang 443002,China)
ObjectiveTo investigate the effects of chloroprocaine(CP)on the methylation status and the expression ofCDH1,APCandP16genes in human cervical cancer cell lines HeLa and CaSki.MethodsHeLa,CaSki and the normal human cell HUVEC culturedin vitrowere exposed to different concentrations(0,1,1.5,2,3 and 4 mmol/L)CP.The growth inhibition of the three cell lines treated at 48,72 and 96 h were studied by MTT assay.The three cell lines were all treated by the certain concentration CP which inhibited the growth of HeLa and CaSki significantly but not affect the growth of HUVEC apparently.The methylation status and the expression ofCDH1,APCandP16genes in the three cell lines were analyzed by methylated specific-PCR(MSP)and RT-PCR,respectively.ResultsAfter being treated by 1.5 mmol/L CP for 96 h,the inhibition rates of HeLa and CaSki were 66.17% ±5.82%and 69.12% ±6.89%,which were significantly higher than that of HUVEC,21.78% ±3.12%.CDH1,APCandP16genes were all demethylated at different levels and mRNA expression of the three genes were recovered or increased in HeLa and CaSki cells after treated by 1.5 mmol/L CP for 96 h.ConclusionsCP may inhibit the growth of HeLa and CaSki cells,meanwhile,it could demethylateCDH1,APCandP16genes and recover or increase the genes'expression in the two cervical cancer cells.
chloroprocaine;cervical cancer;tumor suppressor genes;DNA methylation
R 737.3
A
1001-6325(2012)09-1070-06
2011-10-09
2011-12-28
湖北省教育厅自然科学研究项目(Q20121306);三峡大学博士启动基金(KJ2010B047);三峡大学2011大学生科研创新基金(2011XGK011)
*通信作者(corresponding author):syh728@126.com

