慢性神经病理性疼痛对大鼠脊髓背角miRNA表达的影响
李敏娜,申 乐,黄宇光
(中国医学科学院北京协和医学院北京协和医院麻醉科,北京100730)
慢性神经病理性疼痛对大鼠脊髓背角miRNA表达的影响
李敏娜,申 乐,黄宇光*
(中国医学科学院北京协和医学院北京协和医院麻醉科,北京100730)
目的 筛选慢性神经病理性疼痛大鼠脊髓背角差异表达的miRNA,并预测其调控的靶基因。方法 建立大鼠坐骨神经慢性压迫损伤CCI模型,在术后疼痛高峰期取腰膨大脊髓背角,用miRNA芯片筛选CCI大鼠差异表达的miRNAs,再用荧光实时定量RT-PCR验证差异表达的miRNAs,并利用MIRANDA、TARGETSCAN、PICTAR 3个数据库找出这些miRNA可能调控的靶基因。结果 CCI大鼠表达上调的有miR-99b,表达下调的有miR-674-3p、miR-879与miR-325-5p。RT-qPCR验证结果与芯片基本相符。预测这些miRNA可能的靶基因约26个,这些基因功能广泛。结论 慢性神经病理性疼痛可导致miRNA的表达发生变化,这些miRNA及其调控的靶基因为进一步研究奠定了基础。
慢性疼痛;微小RNA;芯片;荧光实时定量PCR;脊髓背角
微小RNA(microRNA,miRNA)是一种内源性非编码单链小分子RNA,约18~25个核苷酸,可通过碱基配对与mRNA分子相结合来直接降解mRNA或抑制其翻译,从而在转录后水平使基因沉默[1-2]。miRNA参与早期发育、细胞增殖、细胞死亡和细胞分化等重要生命进程[3]。miRNA在神经系统的分化、发育、决定细胞命运方面有重要作用。miRNA可在突触部位选择性聚集或缺失,调节突触局部的基因表达和蛋白合成,影响神经细胞的突触可塑性[4]。有研究者发现炎性反应疼痛小鼠神经系统miRNA表达水平发生变化,推测在疼痛的发生机制中miRNA可能发挥了重要作用[5-6]。本研究旨在通过miRNA芯片和实时定量PCR筛选发现慢性神经病理性疼痛大鼠脊髓背角组织中差异表达的miRNA,分析其对慢性疼痛相关信号传导可能产生的影响,以初步探索miRNA在慢性疼痛的分子生物学机制中所发挥的作用。
1 材料与方法
1.1 CCI大鼠模型的建立
24只SPF级SD雄性大鼠[北京维通利华实验动物技术有限公司,经营许可证编号:SCXK(京)20022003],体质量 180~200 g,随机均分为对照(control)组、假手术(sham)组和慢性神经病理性疼痛(CCI)组。按文献[7]的方法制作坐骨神经慢性压迫损伤(chronic constrictive injury,CCI)模型,在坐骨神经分成三支前的主干部位距神经起始处上方2 mm用4-0羊肠线结扎坐骨神经4道,每道间隔约1 mm,结扎的松紧度以打结时可见肌肉轻微抽动为准。以电子Von Frey刺激针(NC 12775-99 Touch Test Evaluator Set 20,North Coast公司)刺激大鼠足底,大鼠会出现抬足、缩足、快速甩足以及甩足后舔足等反应,每只大鼠刺激3次,间隔大于10 s,将3次平均值作为机械缩足反射阈值(mechanical withdrawal threshold,MWT)。将RCY-2热板测痛仪(上海市益联科技设备有限公司)水浴箱预热至52±0.3℃,测量大鼠从后足接触热板起到发生缩足反射潜伏期(paw withdrawal thermal latency,PWTL)。测量3次取平均值,作为热刺激伤害感受阈。于术前及术后第3、5和7天测量机械缩足反射阈值及热刺激伤害感受阈值。术后7 d取大鼠腰膨大手术侧脊髓背角,立即放入液氮冷却5~10 min后放入-80℃冰箱保存。
1.2 RNA提取
根据Invitrogen公司说明书,用Trizol法提取组织RNA,紫外分光光度仪定量后,用2%琼脂糖电泳鉴定RNA质量。
1.3 miRNA芯片筛选
CCI组、sham组和control组中各随机选取3个样本进行芯片实验(n=3)。选用Exiqon microRNA芯片V11.0版本(上海康成生物技术有限公司),包含所有物种 miRNA 6396个探针。先用 miRCURYTM Array Labelling kit(Exiqon公司,cat 208032)标记miRNA,用 RNeasy Mini Kit(Qiagen公司,cat 74104)浓缩标记样本,再将miRNA芯片杂交。应用Genepix 4000B进行图像扫描,用635 nm激发,用Genepix Pro 6.0分析数据。
1.4 荧光实时定量PCR验证芯片结果
根据文献[8]的Stem-loop法进行miRNA的反转录-荧光实时定量PCR。相应的引物见表1。按照PrimeScriptTM RTreagentkit(Takara公司DRR037A),42 ℃ 15 min反转录,85 ℃ 15 s终止反应,冰上冷却,合成cDNA第一链。根据Takara公司说明书配制20 μL/体系,各样品对应miRNA和U6内参两组,每个反应设3个平行孔,PCR反应在ABI 7500仪器进行。
1.5 生物信息学分析
应用 miRNA靶基因预测软件 Pictar、Targetscan、MiRbase、MiRanda 在线服务站点,输出差异表达miRNA的预测靶基因,取至少3个软件预测到的基因作为靶基因。
1.6 统计学分析
用SPSS 11.5软件进行统计学分析,计量资料经以均数±标准差(±s)表示,两组样本均数间的比较用t检验,多组样本间均数的比较用方差齐性检验和方差分析。
2 结果
2.1 CCI成功建模
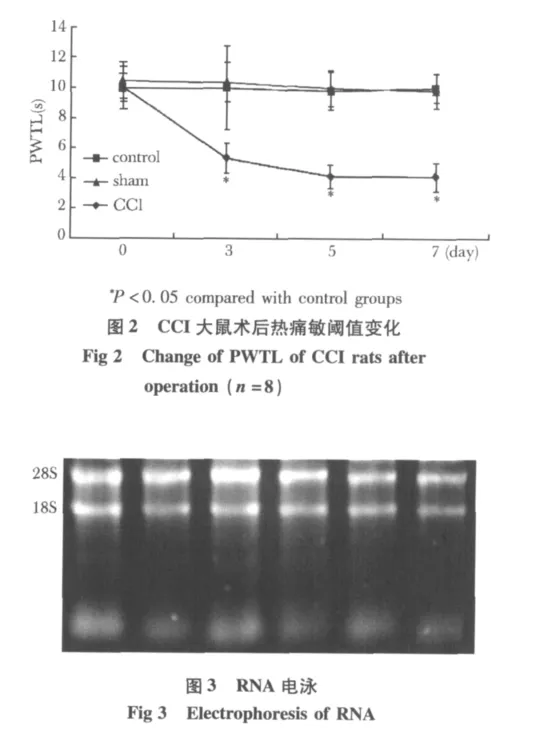
CCI大鼠术后3~5d,手术侧足趾并拢轻度外翻,行走无力,步态跛行,经常左后足悬空或不敢着地;站立时以右后肢持重,左后肢抬起并紧贴于腹部,CCI大鼠无发生自噬肢体现象。CCI组大鼠术后第3天手术侧机械性痛阈明显低于非手术侧,也明显低于sham组和control组,第7天达到最低值(图1)。CCI组大鼠自术后第3天患足热痛敏阈值显著下降,与术前基础值和sham组及control组相比有显著性差异(图2)。

表1 Real-time PCR引物序列Table 1 Primer sequence for real time PCR

图1 CCI大鼠术后机械性痛阈值变化Fig 1 Change of the MWT of CCI rats after operation(n=8)
2.2 总RNA质量鉴定
提取各组大鼠脊髓背角总RNA,测A260/A280,均为1.8~2.1,行琼脂糖凝胶电泳显示28S和18S条带清晰,28S的亮度大约是18S亮度的两倍(图3),说明提取的总RNA完整,质量较好,可用于芯片实验以及荧光实时定量RT-PCR。
2.3 miRNA芯片筛选
分别将CCI、sham和control组(n=3)大鼠脊髓背角提取的RNA经过标记,杂交,再扫描将图像信号转化为数字信号,用配套软件对原始数据进行分析运算。
根据芯片结果比较分析CCI与sham、control组差异表达的miRNA,共同上调的有miR-99b,共同下调的有 miR-325-5p、miR-674-3p、miR-879(变化倍数>1.5或 <0.6,均P<0.05)(表2)。

表2 CCI大鼠差异表达的miRNAsTable 2 Differently expressed miRNAs of CCI rats(n=3)
2.4 荧光实时定量PCR验证芯片结果
miRNA的real-time RT-PCR产物约65 bp,U6的产物约90 bp(图4)。荧光实时定量PCR扩增结果与芯片结果基本一致,其中miR-99b、miR-674-3p、miR-879 CCI组与sham组和control组有显著性差异,表明本实验的miRNA芯片结果基本可靠(图5)。

图4 荧光实时定量RT-PCR产物电泳Fig 4 Electrophoresis of real time RT-PCR products
2.5 靶基因预测
4个miRNA共找到潜在的靶基因26个(表3),这些基因功能广泛,涉及信号传导、转录调控、细胞周期、细胞生长和凋亡、细胞骨架、细胞黏附、细胞运动以及能量代谢等各个方面。
3 讨论
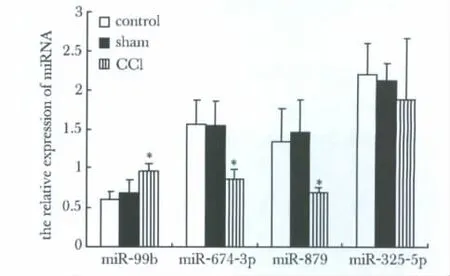
图5 Real-time PCR验证CCI大鼠差异表达的miRNAsFig 5 Real-time PCR test and verify the differently expressed miRNAs of CCI rats(n=8)

表3 预测差异表达miRNA的靶基因Table 3 Predict the target genes of the differently expressed miRNAs
神经病理性疼痛的发病机制至今未明,目前仍缺乏有效的治疗措施,因此进一步探求发病机制尤为重要。许多研究发现miRNAs与调节生物生长、发育,疾病发生过程密切相关[3]。miRNA可以调节突触局部的基因表达和蛋白合成,影响神经细胞突触可塑性[4],炎性疼痛模型小鼠前额叶皮质miRNA表达水平发生显著变化[5],背根神经节miR-143表达水平显著下降[9],提示miRNA可能成为研究疼痛机制的新领域。但目前神经病理性疼痛相关miRNA的研究相对很少。本研究利用miRNA芯片和real-time PCR的方法对慢性压迫性损伤CCI大鼠脊髓背角组织miRNA的表达水平进行分析,发现表达上调的有miR-99b,表达下调的有miR-325-5p、miR-674-3p、miR-879。其中miR-99b曾在大鼠和小鼠的大脑皮质神经元克隆和测序中被发现[10],并且在人胚胎干细胞向血管内皮细胞分化过程中可能起重要作用[11],子宫内膜异位症组织的miR-99b也表达上调[12]。miRNA的功能主要是抑制靶基因的表达,因此本研究预测了这些差异表达的4个miRNA对应的26个靶基因,这些基因功能广泛,涉及信号传导、转录调控、细胞周期、细胞生长、凋亡、细胞黏附、细胞运动以及能量代谢等各个方面。这些靶基因中,LRRC4是富亮氨酸重复(leucine rich repeats,LRR)超家族的新成员,是神经系统发育与轴突生长的功能基因,能够下调一系列神经生长因子或受体的表达,可以调控多种信号传导通路,调节突触发育的各个方面,包括轴突-树突联系的建立、早期突触形成和突触成熟[13]。
综上所述,本研究首次以miRNA芯片技术对慢性神经病理性疼痛的表达谱进行研究,发现CCI大鼠脊髓背角miRNA表达发生变化,预测这些差异表达miNA的靶基因,这些miRNA及其调控的靶基因可能为今后的神经病理性疼痛研究提供新的思路。
[1]Rácz Z,Kaucsár T,Hamar P,et al.The huge world of small RNAs:regulating networks of microRNAs[J].Acta Physiol Hung,2011,98:243-251.
[2]Eulalio A,Huntzinger E,Izaurralde E,et al.Getting to the root of miRNA-mediated gene silencing[J].Cell,2008,132:9-14.
[3]Hobert O.Gene regulation by transcription factors and microRNAs[J].Science,2008,319:1785-1786.
[4]Zeng Y.Regulation of the mammalian nervous system by microRNAs[J].Mol Pharmacol,2009,75:259-264.
[5]Poh KW,Yeo JF,Ong WY.MicroRNA changes in the mouse prefrontal cortex after inflammatory pain[J].Eur J Pain,2011,15:11-12.
[6]Niederberger E,Kynast K,Lötsch J,et al.MicroRNAs as new players in the pain game[J].Pain,2011,152:1455-1458.
[7]Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33:87-107.
[8]Caifu C,Dana AR,Adam JB.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucl Acid Res,2005,33:e179.
[9]Tam S,Bastian I,Zhou XF,et al.MicroRNA-143 expression in dorsal root ganglion neurons[J].Cell Tissue Res,2011,346:163-173.
[10]Eric AM,Ezequiel AS.Microarray analysis of microRNA expression in the developing mammalian brain[J].Genome Biology,2004,5:68-69.
[11]Kane NM,Howard L,Descamps B,et al.Role of microRNAs 99b,181a,and 181b in the differentiation of human embryonic stem cells to vascular endothelial cells[J].Stem Cells,2012,30:643-654.
[12]Ohlsson TEM,Van der HKH.MicroRNA-regulated pathways associated with endometriosis[J].Mol Endocrinol,2009,23:265-275.
[13]Woo J,Kwon SK,Choi S,et al.Trans-synaptic adhesion between NGL-3 and LAR regulates the formation of excitatory synapses[J].Nat Neurosci,2009,12:428-437.
Effect of chronic neuropathic pain on the expression of microRNA in the spinal dorsal horn of rats
LI Min-na,SHEN Le,HUANG Yu-guang*
(Dept.of Anesthesiology,PUMC Hospital,CAMS& PUMC,Beijing 100730,China)
ObjectiveTo investigate the differentially expressed miRNAs in the spinal dorsal horns of rats with chronic neuropathic pain,and predict the target genes of the miRNAs.MethodsChronic constrictive injury(CCI)rat model was established,and spinal dorsal horns were harvested when a peak pain was achieved on the 7th day post-op.Microarray analysis was applied to investigate the differentially expressed miRNAs in CCI rats,and the screened miRNAs were confirmed by real time RT-PCR.Furthermore,the possible target genes were predicted by three databases.ResultsmiRNA microarray analysis showed the expression of miR-99b as significantly up-regulated,while the expressions of miR-674-3p,miR-879 and miR-325-5p as significantly down-regulated in the spinal dorsal horns of CCI rats compared with those in the sham and control rats.The different expression profiles of the 4 miRNAs were confirmed by quantitative RT-PCR.About 26 target genes were predicted through the 3 databases based on the previous screened miRNAs.ConclusionsChronic neuropathic pain affects the expression of miRNAs.These miRNAs and target genes provide new clues for further research.
chronic pain;miRNA;microarray;real time PCR;spinal dorsal horn
R 338.3
A
1001-6325(2012)09-1044-05
2012-06-19
2012-07-02
国家自然科学基金(30872436)
*通信作者(corresponding author):pumchhyg@yahoo.com.cn

