罗格列酮对2型糖尿病大鼠血清ox-LDL、ET、NO的干预作用
胡丽叶,宋光耀,朱旅云,李晓玲
(1.中国人民解放军白求恩国际和平医院内分泌科,河北石家庄050082;2.河北省人民医院内分泌科,河北石家庄050051)
罗格列酮对2型糖尿病大鼠血清ox-LDL、ET、NO的干预作用
胡丽叶1*,宋光耀2,朱旅云1,李晓玲1
(1.中国人民解放军白求恩国际和平医院内分泌科,河北石家庄050082;2.河北省人民医院内分泌科,河北石家庄050051)
2型糖尿病(type 2 diabetes mellitus,T2DM)的危害主要在于与之相关的动脉硬化(atherosclerosis,AS)可涉及全身多个脏器,本研究之前的实验显示糖耐量异常期及DM初期患者已存在有早期AS[1]。因此,早期发现DM人群甚至糖耐量异常人群的AS,对其进行早期干预治疗对于防治DM血管并发症以及减少与糖代谢异常相关的心、脑血管事件的发生,降低死亡率具有重要意义。本研究旨在了解ox-LDL、ET和NO与T2DM者AS发生的关系,并研究罗格列酮的干预作用。
1 材料与方法
1.1 实验动物:7周龄清洁级雄性Wistar大鼠80只,体质量128~140 g(河北医科大学实验动物中心,合格证号:912111)。随机均分为对照组(control)、高脂组(high fat diet)、T2DM模型(diabetes mellitus)、T2DM+罗格列酮治疗组(type 2 diabetes mellitus+rosiglitazone treatment)。
1.2 方法:T2DM造模成功[2],治疗组每日以罗格列酮4 mg/kg(溶于2 mL蒸馏水)灌胃,DM组以等量蒸馏水灌胃。分别于DM成模后6和12周,禁食过夜8~12 h后,应用10%水合氯醛3~4 mL/kg对动物进行麻醉,取血做生化指标检测。应用全自动生化分析仪测定血糖、血脂,采用放免法测定胰岛素(批内变异系数:CV<10%;批间变异系数:CV<15%),ELISA法检测氧化低密度脂蛋白和内皮素;硝酸还原酶法检测一氧化氮。
1.3 统计学分析:应用SPSS10.0统计软件处理,实验数据用均数±标准差(±s)表示,先进行方差齐性检验,再采用单因素方差分析,以LSD法进行组间比较。
2 结果
2.1 DM成模后6周和12周时血糖、血脂的变化(图1,2):4组CHO和LDL-C在12周时较6周时升高(P<0.05或P<0.01)。DM组HDL-C在12周时较6周时下降(P<0.01)。
2.2 DM成模后6和12周时胰岛素、ox-LDL、内皮素和一氧化氮的变化(表1)。
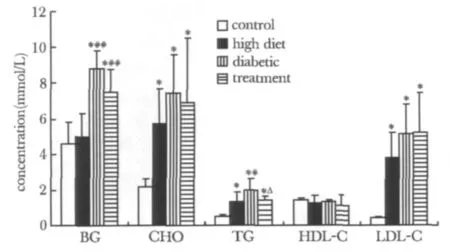
图1 4组在成模6周的血糖血脂比较Fig 1 Levels of blood glucose,blood lipid in four groups at 6 weeks after diabetic modeling(±s,mmol/L,n=20)

图2 4组在成模12周的血糖血脂比较Fig 2 Levels of blood glucose,blood lipid in four groups at 12 weeks after diabetic modeling(±s,mmol/L,n=20)
表1 4组在成模后6和12周的指标比较Table 1 Data of four groups at 6 weeks and 12 weeks after diabetic modeling(±s)
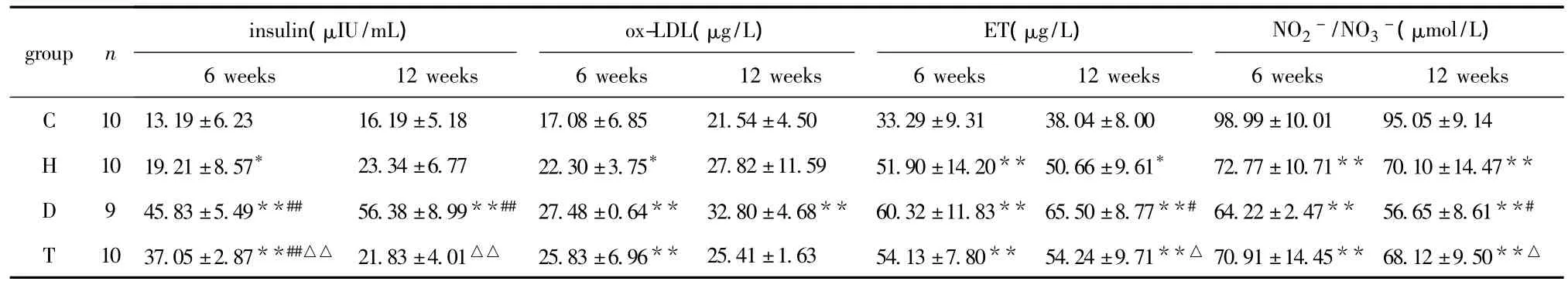
表1 4组在成模后6和12周的指标比较Table 1 Data of four groups at 6 weeks and 12 weeks after diabetic modeling(±s)
C.control group;H.hight fat diet group;D.diabetes group;T.rosiglitazone treatment group*P <0.05,**P <0.01 compared with control;#P <0.05,##P <0.01 compared with high diet;△P <0.05,△△P<0.01 compared with diabetic.
group ninsulin(μIU/mL)ox-LDL(μg/L)ET(μg/L)NO2-/NO3-(μmol/L)5±9.14 H 10 19.21±8.57* 23.34±6.77 22.30±3.75* 27.82±11.59 51.90±14.20** 50.66±9.61* 72.77±10.71** 70.10±14.47**D 9 45.83±5.49**## 56.38±8.99**## 27.48±0.64** 32.80±4.68** 60.32±11.83** 65.50±8.77**# 64.22±2.47** 56.65±8.61**#T 10 37.05±2.87**##△△ 21.83±4.01△△ 25.83±6.96** 25.41±1.63 54.13±7.80** 54.24±9.71**△ 70.91±14.45** 68.12±9.50 6 weeks 12 weeks C 10 13.19±6.23 16.19±5.18 17.08±6.85 21.54±4.50 33.29±9.31 38.04±8.00 98.99±10.01 95.0 6 weeks 12 weeks 6 weeks 12 weeks 6 weeks 12 weeks**△
3 讨论
临床上DM患者较非DM患者的AS出现更早、更重,其原因与血糖升高有关,而同时合并的脂质代谢紊乱也是导致其AS发生发展的重要原因。罗格列酮能通过增加介导胆固醇外流的载体ABCG1的表达,增加巨噬细胞内胆固醇的外流,抑制泡沫细胞形成,发挥抗AS作用。
血浆中葡萄糖、TC、TG以及LDL-C水平的升高,HDL-C降低均可促进AS的发生。近年研究发现,葡萄糖耐量水平与AS指标呈反比[3]。本研究显示,6周时高脂组、DM组及罗格列酮治疗组的CHO、TG、LDL-C均较对照组升高,至12周时升高更明显,并出现HDL-C下降。而罗格列酮组较DM组糖脂紊乱有所改善。6周时高脂组、DM组及罗格列酮治疗组胰岛素水平升高,尤其是DM组更明显,提示存在胰岛素抵抗(insulin resistance,IR),而这种 IR在12周时更明显。罗格列酮治疗组胰岛素水平升高及IR现象较DM组比较明显减轻,在12周时的胰岛素分泌水平几乎和高脂组相似,说明罗格列酮可有效改善IR。ox-LDL可通过多种效应促进AS发生,在T2DM大血管病变中起重要作用,而高血糖则促进了LDL的氧化。本研究显示,6周时DM组和罗格列酮治疗组ox-LDL较对照组和高脂组升高;12周时DM组仍较对照组和高脂组升高,但罗格列酮治疗组与对照组和高脂组比较无差异。提示高脂组、DM组和罗格列酮治疗组较对照组具有更高的AS的危险,应用罗格列酮干预有降低危险的趋势,起到预防AS作用。血管内皮细胞可分泌多种生物活性物质,其中NO和ET是由其分泌的具有拮抗作用的血管活性物质,对维持血管正常舒缩功能具重要意义。AS早期表现为血管内皮功能紊乱,DM患者发生血管内皮功能紊乱时,表现出NO/ET失衡。本研究显示,6和12周时高脂组、DM组及罗格列酮治疗组ET均较对照组显著升高,NO则显著下降。并且12周时DM组ET较高脂组和罗格列酮治疗组显著升高,NO则显著下降。DM组NO 12周时较6周时下降。DM组和高脂组的缩血管物质ET均升高,以及舒血管物质NO下降,并且同时合并有高血糖和高血脂的DM组这种表现在12周时更明显,提示高血糖、高血脂促进AS,两者并存时的促进AS作用更明显。而罗格列酮可降低ET,提高NO分泌,改善NO/ET失衡,发挥其抗AS作用。
[1]胡丽叶,朱旅云,李晓玲,等.不同糖耐量人群血清脂联素、胰岛素抵抗指数及血管内皮功能的对比研究[J].中国慢性病预防与控制,2009,17:336-338.
[2]郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10:290 -294.
[3]Hu L,Song G,Zhu L,et al.Investigation of early change of endothelial function and related factors in individuals with hyperglycemia[J].Diabetes Res Clin Pract,2011,92:194-197.
R 589.2;R 363
A
1001-6325(2012)09-1093-02
2011-08-14
2011-12-26
项目项目:河北省自然科学基金(C2009001352)
*通信作者(corresponding author):qianqianhu1998@163.com
——内分泌科住院患者的护理安全隐患与应对措施

