PEG-6000引发对苦荞种子萌发及幼苗生长的影响
贾 婷,赵 钢,彭镰心,胡一冰,邹 亮,赵江林
(1.四川农业大学农学院,四川温江 611130;2.成都大学生物产业学院,四川成都 610106)
0 引言
荞麦属于蓼科荞麦属,起源于我国西南地区.我国栽培的荞麦主要有甜荞和苦荞两种,其中,苦荞是自然界中少有的药食兼用作物,具有极佳的营养保健价值和较好的食疗功效.随着人们对苦荞营养和保健价值的逐渐认知,苦荞作为较理想的功能性食物资源颇受青睐.与其他作物相比,苦荞种皮较为坚厚,发芽整齐度较差,严重影响了苦荞田间出苗的整齐一致性,因此,获得健壮整齐的幼苗群体是苦荞栽培生产的关键.种子引发也称渗透调节,对其研究始于上世纪70年代中期,由Heydecker等首次将其应用于洋葱种子的引发试验[1,2].种子引发是一种使种子缓慢吸收水分和后期回干的技术,可使种子吸水停留在吸胀吸水阶段,即使种子处于发芽的准备阶段,但不发生可见的萌发[3-6].种子引发技术不仅能提高田间出苗率,使出苗率高而整齐,而且可提高植株的抗逆性[8,9].目前,国内外关于种子引发技术在水稻、小麦、玉米、大豆及蔬菜等作物中的应用均有报道,但有关荞麦种子引发的研究报道相对较少.本研究以苦荞品种为试验材料,研究不同浓度PEG溶液引发处理对苦荞种子萌发性状与幼苗生长的影响,以及引发处理对苦荞幼苗的生理效应,以期为种子引发技术在荞麦生产上的应用提供理论基础和实践依据.
1 材料与方法
1.1 材 料
实验所用苦荞种子为颗粒饱满、大小一致的川荞1号种子,由成都大学农业部国家杂粮加工技术研发分中心提供.
1.2 方 法
1.2.1 实验设计.
实验所用苦荞种子先用1‰高锰酸钾消毒2 min,再用蒸馏水将种子清洗干净,室温晾干后分别置于浓度为10%、20%、25%、30%的PEG-6000溶液中,种子重量与溶液的体积比为1∶3,在恒温光照培养箱中,25℃恒温引发培养,引发培养时间为12 h、24 h、36 h,之后将种子洗净,用滤纸吸干表面水分,置于鼓风干燥箱中,25℃回干至与处理前相同的重量.同时,以未经引发处理的苦荞种子为对照.
1.2.2 性状测定.
挑选颗粒饱满、大小一致的引发处理和未处理的苦荞种子,置于垫有两层滤纸9 cm×9 cm培养皿中,每皿100粒,室内培养,每天喷晒适量蒸馏水使滤纸保持湿润状态.每个处理重复3次.从第2 d起逐日统计种子发芽数,以第10 d作为发芽结束时间.发芽结束后统计发芽率,并计算发芽指数、活力指数等相关指标.计算公式如下:
Gr(发芽率)=ΣGt/NT×100%;
GI(发芽指数)=Σ(Gt/Dt);
VI(活力指数)=GI×S.
其中,Gt表示在t日时的发芽数,Dt表示相应的发芽天数,NT表示种子总数,S表示幼苗的长度.
2 结果
2.1 不同处理浓度及时间对苦荞萌发性状的影响
在实验中,我们发现不同的引发处理对苦荞种子的发芽影响差异较大.图1为不同浓度PEG溶液引发处理对苦荞种子发芽率的影响.

图1 不同浓度PEG溶液引发苦荞种子的发芽率
由图1可知,苦荞种子在经过引发处理后其发芽率发生显著变化.同一浓度不同处理时间,苦荞种子的发芽率差异显著;不同浓度的统一处理时间,苦荞种子的发芽率也存在显著差异.以10%的浓度分别浸种12 h,24 h,36 h后,苦荞种子发芽率略高于蒸馏水处理的发芽率,20%和25%的浓度处理显著提高了苦荞种子发芽率,其中以25%的浓度浸种24 h后苦荞种子发芽率提高最为显著,其次为20%浓度浸种24 h,浓度为30%的处理不同时间苦荞种子发芽率均出现下降趋势.
2.2 不同处理浓度及时间对苦荞幼苗生长的影响
表1为苦荞幼苗生长测定的结果.经方差分析和F测验,不同浓度PEG溶液及处理时间对苦荞幼苗的发芽势、发芽率、芽长、芽鲜重、芽干重与活力指数均达到显著水平,说明PEG溶液引发对苦荞麦种子的萌发及活力均有显著影响.
由表1可见,经PEG溶液引发处理的川荞1号种子的发芽势、发芽率、芽长、芽鲜重、芽干重与活力指数较对照组大多数均有不同程度的提高.
2.3 各项活力指标间的相关分析
将各项活力指标进行相关分析,结果如表2所示.
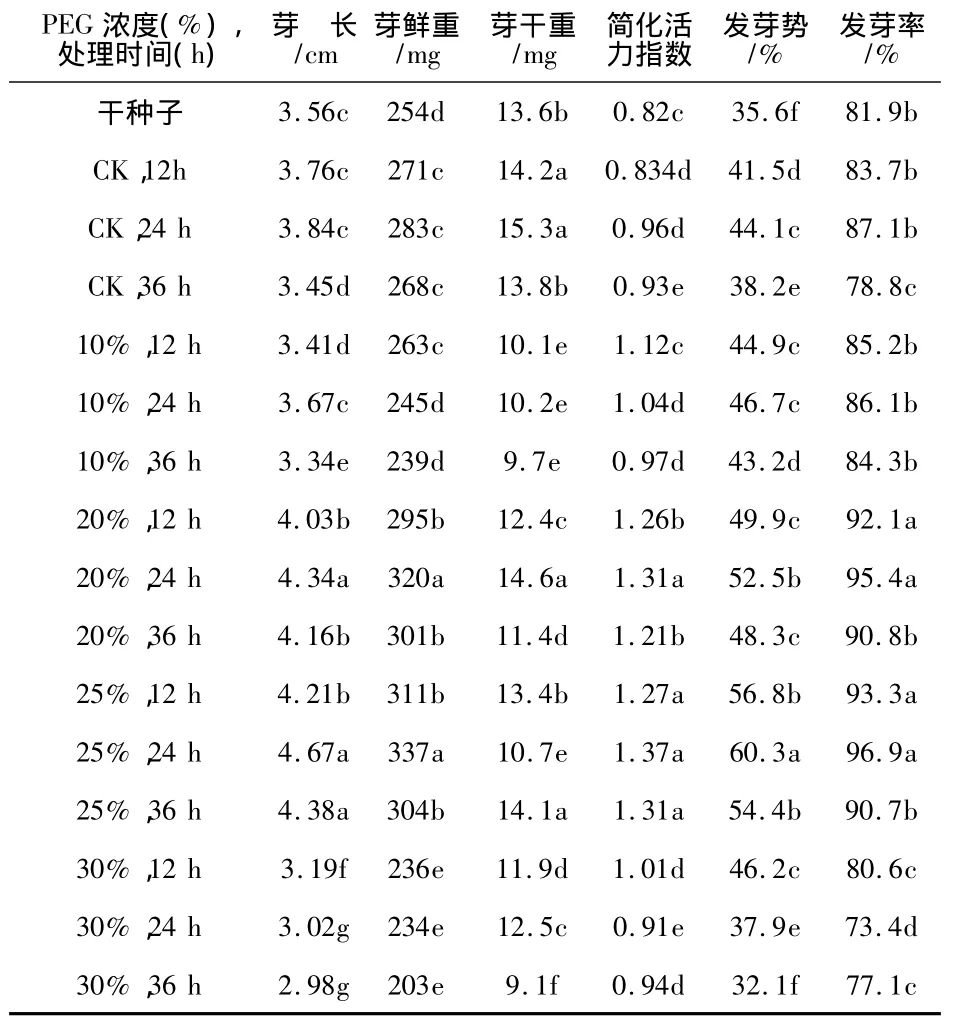
表1 不同PEG浓度及处理时间处理下的幼苗生长各项活力指标测定结果
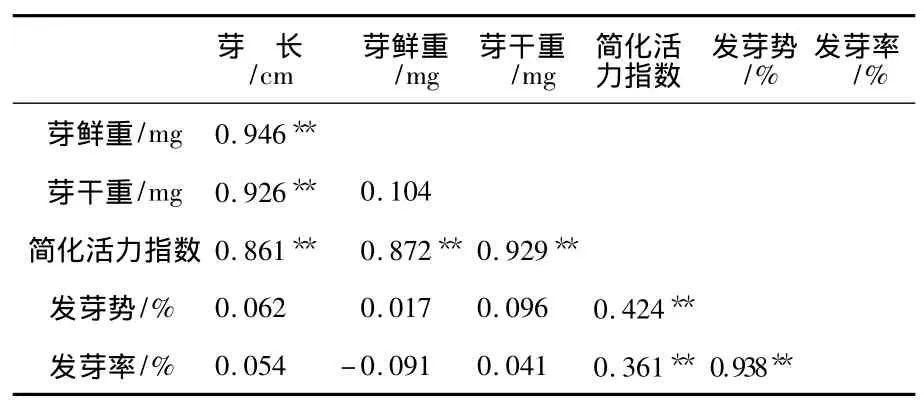
表2 荞麦种子各活力指标的相关分析
从表2可以看出,简化活力指数与芽长、发芽势、发芽率、芽干重与芽鲜重活力指标均呈极显著正相关.
3 结论与讨论
采用PEG-6000溶液对种子引发的实质是在限制种子吸水速率的条件下使种子的膜系统得到较好地修复[10,11],并提前启动萌发所需的物质代谢,使有害物质的含量降低,从而提高种子的发芽率.
本实验结果表明,适宜浓度的PEG溶液的引发能提高荞麦种子的活力,加快其发芽速度,且经过引发的幼苗长势较好,简化活力指数提高,这与有关PEG溶液引发可促进种子萌发,提高种子活力的报道结果相一致.同时,本实验表明,适宜引发苦荞种子的最佳PEG浓度为25%,最佳引发时间为24 h.据相关文献报道,苦荞和甜荞的生理结构有一定差别,故甜荞最佳的引发浓度和引发时间有待进一步研究解决.
[1]Hydecker W,Higgins j,Cullier R L.Accelerated Germination by Osmotic Seed Treatment[J].Nature,1973,246(2):42-44.
[2]Hydecker W,Higgins J,Turne Y J.Invigorration of Seeds[J].Seed Science and Technology,1975,3(3):881-888.
[3]Litay A,Tan C S.Effect of Various Levels of Available Water on Germination of PEG Pretreated or Untreated Tomato Seeds[J].Journal of the American Society for Horticultural Science,1985,110(6):748-751.
[4]Wiebe H J,Muhyaddin T.Improvement of Emergence by Osmotic Seed Treatments in Soil of High Saltnity[J].ISHS Acta Horticulture,1987(1):91-100.
[5]陈禅友.PEG处理提高长豇豆种子活力的初步研究[J].种子,1991,11(1):32-35.
[6]张燕,方力,李天飞,等.聚乙二醇对烟草种子活力及幼苗保护酶活性的影响[J].云南农业大学学报,2004,19 (1):36-40.
[7]刘宇,王萍娟,李天昊,等.聚乙二醇渗透处理对膜荚黄芪种子发芽及幼苗抗冷害的影响[J].吉林农业大学学报,2007,29(1):61-64.
[8]洪法水,赵海泉.聚乙二醇和聚乙烯醇对黄瓜种子活力和抗寒性的影响[J].园艺学报,1997,24(4):395-396.
[9]何晓明,谢大森.浸种处理对超甜玉米种子发芽率的影响[J].中国种业,2002,21(4):24-27.
[10]张桂和,徐碧玉.安祖花茎段培养与离体繁殖[J].上海农业学报,2001,17(3):13-16.
[11]Joseph D,Martin K P,Madassery J,et al.In Vitro Propagation of Three Commercial Cut Flower Cultivars of Anthurium Andraeanum[J].Indian Journal Biology,2003,41(2):154-159.

