甘薯中可溶性糖的HPLC法测定及其在加工中的变化研究
卞 科,刘孝沾
(河南工业大学 粮油食品学院,河南 郑州 450001)
甘薯中可溶性糖的HPLC法测定及其在加工中的变化研究
卞 科,刘孝沾
(河南工业大学 粮油食品学院,河南 郑州 450001)
用80%乙醇溶液提取甘薯中的可溶性糖,并用高效液相色谱(HPLC)测定其组成.结果显示:生甘薯中的可溶性糖主要是蔗糖、葡萄糖和果糖;经过烘烤、蒸、微波处理、煮、高压蒸煮处理的甘薯中主要含有麦芽糖、蔗糖、葡萄糖和果糖.所有加工方法都能使淀粉大量转化为还原糖,但在此过程中非还原糖含量变化不大.
高效液相色谱;甘薯;糖
0 前言
甘薯营养丰富、生态适应性强且产量极大,可溶性糖和胡萝卜素等含量较高,蒸煮食味好,具有良好的营养保健功能[1].目前,甘薯主要加工成一些传统食品的配料,或者在大米、小麦、玉米等主要粮食作物短缺时作为替代品使用.甘薯由于含糖量高及在大量食用过程中产生的胀气现象是阻碍其成为主食的主要因素.
胀气现象在豆类的食用过程中非常普遍,国外关于胀气现象有较全面的综述和研究.绝大多数研究者认为棉子糖、水苏糖和毛蕊花糖等寡聚糖是豆类的胀气因子.豇豆、鹰嘴豆、蚕豆、小扁豆等豆类中这3种寡聚糖的含量在5.5%~8.0%,其中毛蕊花糖是主要成分;大豆中含有大约1%的棉子糖和2.5%的水苏糖;龙豆含有1%~2%的棉子糖,2%~4%的水苏糖和0.2%~1%的毛蕊花糖[2].由于人体肠内黏膜缺乏消化这3种寡聚糖的α-l,6-半乳糖苷酶[3],所以它们能避开上消化道的消化吸收而直接进入结肠,然后在结肠内微生物的作用下代谢产生大量的H2、CO2和少量的甲烷气体,同时 pH降低.除此之外,Tadesse等[4]指出植物纤维中的半纤维素也能引起胀气;Hellendoorn等[5]认为淀粉也能引起一定程度的胀气;要深入了解纤维素和淀粉与胀气的关系还需要更进一步研究证实.
甘薯中的碳水化合物在成熟、储藏、加工中的变化已经有深入的研究,但未见对甘薯胀气因子的研究.另外,生甘薯中的可溶性糖成分的测定结果也存在分歧,部分研究者[6]测定生甘薯中只含有蔗糖、葡萄糖和果糖,不含棉子糖等寡聚糖;但另一些研究者[2]则指出生甘薯中含有少量的棉子糖族寡聚糖.
因此,笔者用HPLC法测定我国几个常见甘薯品种的可溶性糖成分,确定是否有棉子糖等寡聚糖,并研究多种加工方法对一些可溶性糖含量的影响.
1 材料和方法
1.1 材料与设备
1.1.1 主要原料和试剂
新收获的甘薯郑 20、秦薯 7号、紫薯、SL-19、豫薯13、徐薯22、梅营8号、漯05-1购于河南农业科学院,新鲜开封农家薯(开封SP)购于郑州市农贸市场.将以上9个品种的甘薯储存在相对湿度85%,温度13℃的恒温恒湿箱中45 d,然后用于测定.
无水乙醇(分析纯):天津市天力化学试剂有限公司;三乙胺(分析纯):汕头市西陇化工有限公司;超纯水:杭州娃哈哈有限公司;果糖(色谱纯):天津市科密欧化学试剂有限公司;葡萄糖、蔗糖、麦芽糖、乙腈:均为色谱纯,天津市科密欧化学试剂有限公司;棉子糖(色谱纯):美国Amresco公司.
1.1.2 主要设备
DHG—9246A型电热恒温鼓风干燥箱:上海精密设备有限公司;BS210S分析天平:北京赛多利斯天平有限公司;5810R高速冷冻离心机:德国艾本德有限公司;Lsc—278w HWS智能恒温恒湿箱:宁波东南仪器有限公司;Labconco冷冻干燥机:美国Labconco有限公司;WG800DSL20Ⅱ—K6家用格兰仕微波炉:格兰仕微波炉有限公司;YXQ.SG41.280手提式压力蒸汽灭菌锅:上海华岩仪器设备有限公司;DL—1电炉:北京中兴伟业仪器有限公司;Waters 2695高效液相色谱仪(配2420蒸发光散射检测器和Empower Pro工作站):美国Waters公司.
1.2 试验方法
1.2.1 样品预处理
新鲜甘薯经过45 d的储藏后,从每个品种中选取质量较好并且单个质量在100~130 g的用于糖分测定.
生甘薯糖分的测定:首先将甘薯用自来水清洗干净,削皮后切成厚度大约为3 mm的薄片;接着对甘薯片进行48 h冷冻干燥,冻干的甘薯片经过粉碎机粉碎,过40目筛,最后将所得甘薯粉装入塑料密封袋中放入4℃冰箱中用于理化分析.
熟甘薯的糖分测定:只对开封农家薯(开封SP)这一个品种进行研究.与生甘薯处理方法不同,在清洗削皮后将整个甘薯横向切为两半然后进行加工处理.其加工方法为:(1)煮:将甘薯块浸入装有水的铁锅中,在电炉上加热,当水沸腾时开始计时;(2)蒸:将甘薯块放入铁锅上面的蒸笼中,在铁锅中加入适量的水用电炉进行加热,当水沸腾时开始计时;(3)高压蒸煮:将甘薯块放入装有适量水的杀菌锅中,当温度达到121℃开始计时;(4)微波处理:将甘薯块放入格兰仕家用微波炉中,功率设为800W;(5)烘烤:将甘薯块放入烘箱中,烘箱温度设为170℃,烘箱内温度达到设定温度时开始计时.然后将加工所得的各个样品冷却至室温,切成约3mm厚的薄片进行冷冻干燥.
1.2.2 理化分析
1.2.2.1 水分测定
参照GB5009.3-85.
1.2.2.2 乙醇不溶物(AIS)质量测定
参照参考文献[7]中的方法.
1.2.2.3 可溶性糖的提取和测定
可溶性糖的提取:参考GB/T 22491-2008和GB/T 22221-2008的方法并做适当修改.首先,准确称取2.0 g甘薯粉放入150 mL的烧杯中,在烧杯中加入约40 mL 80%的乙醇溶液;然后用薄膜将烧杯口密封并在45℃下磁力搅拌2 h,放至室温后用容量瓶定容至50 mL;离心后取约1.5 mL上清液用0.45μm滤膜过滤,所得滤液移至样品瓶中用于测定.
可溶性糖的测定:(1)色谱条件:色谱柱:Waters XBridge Amide 3.5μm×4.6 mm×250 mm;流动相:乙腈 /水 =75/25(V/V);检测器温度:80℃;氮气压力:25 psi;流速:1.0 mL/min,进样体积为 10 μL;柱温:35℃.(2)标准糖溶液的配制:用80%乙醇分别配制不同质量浓度的果糖、葡萄糖、蔗糖、麦芽糖和棉子糖标准溶液,配制 0.5、1.0、2.0、5.0、10.0 mg/mL的混标溶液,备用.(3)样品测定:分别取 0.5、1.0、2.0、5.0、10.0 mg/mL各种糖的标准溶液,然后进行液相色谱分析,以标准品质量浓度为横坐标(X)、标准品峰面积为纵坐标(Y)绘制工作曲线;将处理后的样品溶液进行液相色谱分析,采用外标法定量测定样品中各种糖的含量.
2 结果与讨论
2.1 甘薯的可溶性糖组成
2.1.1 生甘薯的可溶性糖组成
糖的标准品和生甘薯样品的色谱图见图1、图2,各品种生甘薯的可溶性糖含量见图3.

图1 标准品色谱图
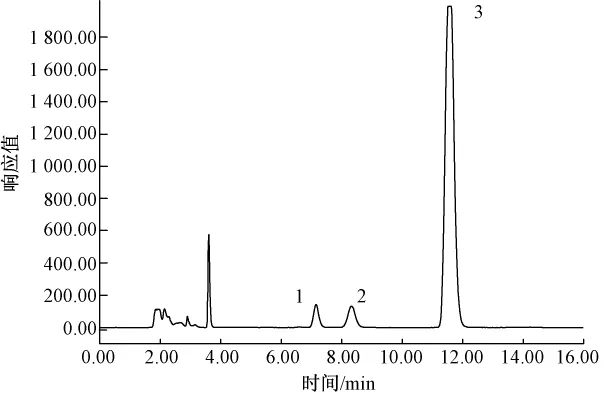
图2 生甘薯色谱图
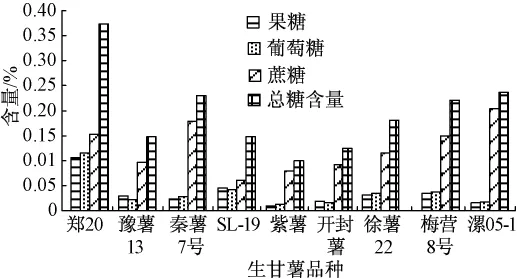
图3 各品种生甘薯中可溶性糖含量(干基)
生甘薯中糖的组成通过保留时间确定,各种糖的含量通过标准曲线利用外标法计算.由图2可知,果糖和葡萄糖首先被洗脱出来,蔗糖最后被洗脱出来.尽管所选的各品种的甘薯含糖量差异很大,但是由图3可知糖的组成相同,这些甘薯中都含有果糖、葡萄糖和蔗糖,不含棉子糖等寡聚糖.测定结果与N.S.Susheelamma等[9]的研究结果一致;但与Truong Van Den等[2]测定美国甘薯的结果有所差异,他们的测定结果除了含有以上3种糖外,还含有大约0.5%(湿基)的棉子糖,这可能是因为甘薯的品种和生长环境不同.虽然甘薯中不存在(或者含有极少量)棉子糖等易产生胀气的寡聚糖,但是大量食用甘薯后仍会产生一定程度的胀气现象[2,9].尽管有部分学者[2]认为这是由于部分甘薯淀粉在上消化道内未被分解吸收而吸进入大肠发酵所致,但仍然需要进一步研究来证实这一观点.
2.1.2 熟甘薯的可溶性糖组成
熟甘薯的色谱图如图4所示,不同处理方法处理的甘薯的可溶性糖组成见表1.
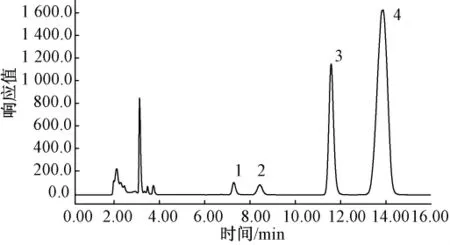
图4 熟甘薯色谱图
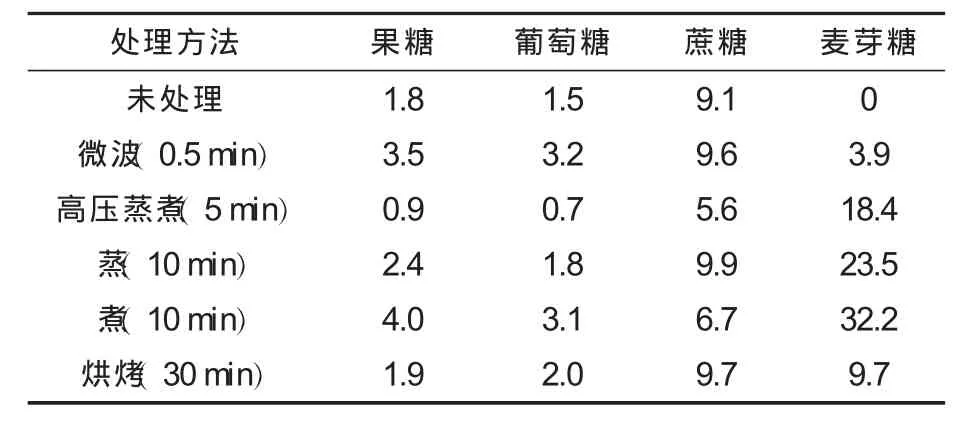
表1 在不同处理方法下甘薯中可溶性糖的组成(干基) %
由表1可见,不同加工方法(蒸、煮、高压蒸煮、微波处理、烘烤)处理的甘薯,其可溶性糖组成却相同,结果与 David H.Picha等[8,10]的测定结果一致,除了含有果糖、葡萄糖和蔗糖,还含有大量的麦芽糖.在加工过程中,甘薯淀粉在淀粉酶的作用下转化为还原糖、糊精和麦芽糖[10].甘薯中α-淀粉酶和β-淀粉酶在这种转化中起主要作用,甘薯中α-淀粉酶的最佳活力范围在70~75℃,在常温或者低温下活力非常弱,随着甘薯储藏时间的增加,其活力也有所增加,虽然α-淀粉酶具有一定的热稳定性,但如果长时间处在高温下其活力会逐渐丧失[11];与α-淀粉酶不同,甘薯中β-淀粉酶最佳活力范围在60~70℃[12-13].
2.2 不同加工方法对甘薯中可溶性糖的影响
不同加工方法对甘薯中可溶性糖的影响见图5—图9,不同处理方法处理的甘薯中各类可溶性糖的含量见图10.
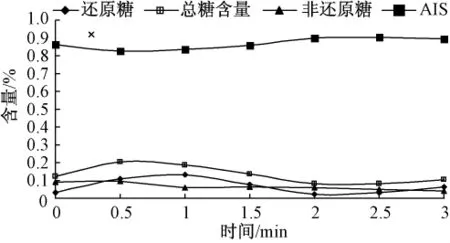
图5 微波处理对可溶性糖和AIS的影响(干基)

图6 煮处理对可溶性糖和AIS的影响(干基)
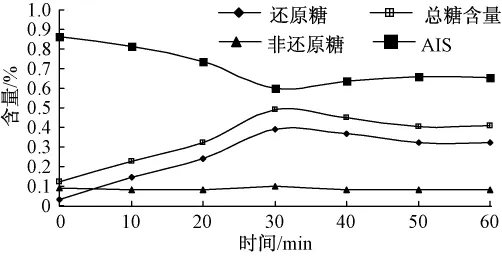
图7 烘烤对可溶性糖和AIS的影响(干基)
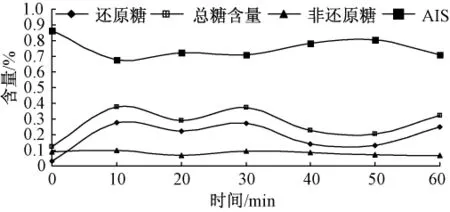
图8 蒸处理对可溶性糖和AIS的影响(干基)
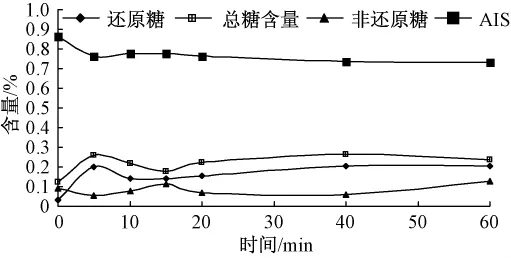
图9 高压蒸煮对可溶性糖和AIS的影响(干基)
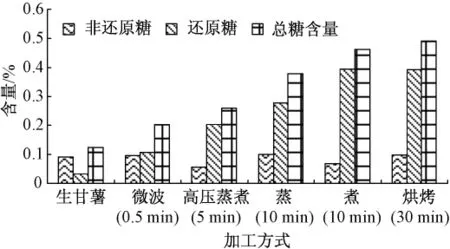
图10 不同处理方法下甘薯中可溶性糖的含量
如图10所示,蒸、煮、高压蒸煮、烘烤和微波处理这5种加工方法对甘薯中非还原糖的含量几乎没有影响,这与A.A.Damir等[14]的研究结果一致.加热时间对糖含量的影响可分为两个阶段:第一阶段,在加热初期甘薯中糖含量(特别是还原糖)随着加热时间延长而迅速增加;第二阶段,继续加热糖含量几乎不变.原因可能是最初加热过程中,甘薯块内部温度达到淀粉酶的最佳活力范围(α-淀粉酶在 70~75℃,β-淀粉酶在 60~70℃),淀粉酶的活性增强并加快淀粉转化;继续加热淀粉酶在高温下就失去活性,糖含量不再上升[14].在第二阶段,甘薯糖含量有轻微下降.这可能是部分糖溶于加热介质或者发生美拉德反应的结果.在高淀粉含量的甘薯中,乙醇不溶物(AIS)质量是反映淀粉含量变化的优良指标,图10中还原糖含量变化与乙醇不溶物(AIS)质量变化完全对应,从另一个角度说明部分淀粉在淀粉酶作用下转化成还原糖.
如图5—图9所示,甘薯经过10min的蒸或者煮处理,或者分别经过5min高压蒸煮和30min烘烤后,其糖含量基本不变,这可能是淀粉酶在高温处理5 min后完全失去活性,而在烘烤过程中淀粉酶完全失活需要的时间较长.在不同处理条件下得到甘薯的非还原糖含量差异不大,但是还原糖含量差异很明显.烘烤处理的甘薯糖含量最大,接着是煮和蒸,高压蒸煮和微波处理的甘薯糖含量明显偏小,这可能与淀粉酶在不同处理方法下作用时间和活性强弱有关.然而,在N.N.Reddy等[15]的研究中,微波处理的甘薯中糖含量与烘烤处理所得到甘薯的糖含量非常接近,其原因可能是选取甘薯的体积和微波加热功率不同.
3 结论
利用高效液相色谱(HPLC)法测定不同甘薯品种中的可溶性糖组成.结果表明:(1)生甘薯中含有果糖、葡萄糖和蔗糖3种可溶性糖,不含棉子糖等易产生胀气的寡聚糖类;(2)分别通过蒸、煮、高压蒸煮、烘烤和微波处理得到的熟甘薯中,糖的组成相同,都含有果糖、葡萄糖、蔗糖和麦芽糖,但还原糖的含量差异很大.
[1]柳洪鹃,李作梅,史春余,等.腐植酸提高食用型甘薯块根可溶性糖含量的生理基础[J].作物学报,2011,37(4):711-716.
[2]Truong Van Den,Christopher J Biermann,Judith A Marlett.Simple sugars,oligosaccharides and starch concentrations in raw and cooked sweet potato[J].Journal of Agricultural and Food Chemistry,1986,34(3) :421-425.
[3]Gitzelmann R,Auricchio S.The handling of soy alpha-galactosides by a normal and galactosemic child[J].Pediatrics,1965,36:231-235.
[4]Tadesse K,Eastwood M A.Metabolism of dietary fiber component in man assessed by breath hydrogen[J].British Journal of Nutrition,1978,40:393-398.
[5]Hellendoorn E W.Intestinal effects following ingestion of beans[J] .Food Technology,1969,23:87-93.
[6]Shen C,Sterling C.Changes in starch and other carbohydrates in baking Ipomoea batatas[J].Starch,1981,33:261-268.
[7]Walter William M Jr,Catignani George L.Biological quality and composition of sweet potato protein fractions[J] .Journal of Agricultural and Food Chemistry,1981,29:797-799.
[8]Picha David H.HPLC determination of sugars in raw and baked sweet potatoes[J] .Journal of Food Science,1985,50:1189-1210.
[9]Susheelamma N S,Reddy G Changala,Rukmani C S,et al.Studies on sweet potatoes.Part I:Changes in the carbohydrates during processing[J].Starch,1992,44:163-166.
[10]Losh June M,Phillips Jean A,Axelson Julein M,et al.Sweet potato quality after baking[J] .Journal of Food Science,1981,46:283-290.
[11]Masayuki Ikemiya,Deobald H J.New characteristic alpha-amylase in sweet potatoes[J].Journal of Agricultural and Food chemistry,1966,14:237-241.
[12]Hoover M W.An enzyme activation process for producing sweet potato flakes[J] .Food Technology,1967,21:322.
[13]Deobald H J,Hasling V C,Catalano E A,et al.Relationship of sugar formation and sweet potato alpha-amylase activity during processing for flake production[J].Food Technology,1969,23:82.
[14]Damir A A.Effect of heat penetration during cooking on some physico-chemical properties and microstructure of sweet potatoes[J].Food Chemistry,1989,34:41-45.
[15]Reddy N N,Sistrunk W A.Effect of cultivar,size,storage,and cooking method on carbohydrates and some nutrients of sweet potatoes[J].Journal of Food Science,1980,45:682-684.
DETERMINATION OF SOLUBLE SUGARS IN SWEET POTATO BY HPLC AND ITSCHANGESDURING PROCESSING
BIAN Ke,LIU Xiao-zhan
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
In this paper,we extracted soluble sugars in sweet potatoes by using 80%ethanol solution,and determ ined the composition of the soluble sugars by HPLC.The results showed that the fresh sweet potatomainly contained sucrose,glucose and fructose;and the sweet potato processed by baking,steaming,microwave,cooking and high-pressure cooking mainly contained maltose,sucrose,glucose,and fructose.All of the processing methods could make themajority of starch transformed to reducing sugars,but the content of non-reducing sugars changed little.
HPLC; sweet potato; sugar
TS 201.2
B
CNKI:41-1378/N.20120208.0844.001
1673-2383(2012)01-0001-05
http://www.cnki.net/kcms/detail/41.1378.N.20120208.0844.001.html
网络出版时间:2012-2-8 08:44:47AM
2011-07-31
卞科(1960-),男,陕西兴平人,教授,研究方向为农产品储藏与加工.

