GATA-4在卵巢性索间质肿瘤中的表达及意义
姚秀娟,尹晓娜,陈祥义,陈国荣,董磊
(温州医学院附属第一医院 病理科, 浙江 温州 325000)
卵巢性索间质肿瘤起源于原始性腺中的性索和间质组织,约占卵巢肿瘤的5%~l0%[1]。Laitinen等[2-4]发现转录因子GATA-4在大部分颗粒细胞瘤和卵泡膜细胞瘤中表达,认为GATA-4在性索起源的卵巢肿瘤的表型中起作用。本研究采用免疫组织化学PV-6000二步法检测正常卵巢、卵泡膜细胞瘤、颗粒细胞瘤及支持-间质细胞瘤中GATA-4的表达,分析其临床病理意义,从而为判断卵巢性索间质肿瘤的生物学行为、指导其临床治疗以及预测预后提供客观依据。
1 材料和方法
1.1 材料
1.1.1 研究对象:收集2003年4月至2010年8月温州医学院附属第一医院行手术切除的卵巢性索间质肿瘤石蜡包埋标本80例,病理诊断均再次确认。其中卵泡膜细胞瘤45例,患者平均年龄53.4岁(26~80岁);颗粒细胞瘤28例,均为成人型,患者平均年龄50.4岁(33~91岁);支持-间质细胞瘤7例,其中2例呈高分化,5例呈中分化,患者平均年龄39.7岁(21~68岁)。根据2000年FIGO标准将颗粒细胞瘤进行临床分期:Ia期19例,Ic期8例,III期1例。同时选取20例非卵巢肿瘤性疾病切除的卵巢组织标本作为对照组,患者平均年龄37.2岁(35~42岁)。
1.1.2 试剂:选用的一抗GATA-4(G-4):sc-25310,由SANTA CRUZ BIOTECHNOLOGY提供,稀释度为1:300。二抗PV-6000试剂盒及DAB染色试剂盒(ZLI-9019)购自北京中杉金桥生物有限公司。
1.2 方法
1.2.1 免疫组织化学染色:复习患者临床资料及所有的病理组织学切片,选取其中有代表性的蜡块进行免疫组织化学染色。采用免疫组织化学PV-6000二步法,按试剂盒提供的说明书进行操作。用PBS缓冲液代替一抗作为阴性对照。
1.2.2 结果判定:GATA-4阳性表达定位于细胞核,呈棕黄色或者棕黑色。根据文献[5],以正常卵巢窦卵泡性索间质细胞的免疫反应水平作为标准,随机选择10个高倍视野(400倍),计数500~1000个肿瘤细胞中阳性细胞数,计算出各例标本免疫组化阳性细胞百分比,无阳性细胞为阴性表达(-),阳性细胞数<20%为低表达(+),20%~80%为中表达(++);>80%为高表达(+++)。进行统计学分析时,将GATA-4的免疫组化染色结果分为两组:①与在正常卵巢中的表达相当或更强(即高表达);②低于在正常卵巢中的表达(即中、低及阴性表达)。
1.3 统计学处理方法 应用SPSS15.0统计软件,四格表资料的Chi-square检验或者Fisher确切概率法进行分析,检验水准a=0.05。
2 结果
2.1 正常卵巢及卵巢性索间质肿瘤中GATA-4的表达情况 GATA-4在正常卵巢组织、卵泡膜细胞瘤、颗粒细胞瘤及支持-间质细胞瘤中的高表达率分别为100%、89%、68%、71%(见图1)。组间两两比较,颗粒细胞瘤组GATA-4的表达率低于卵泡膜细胞瘤组及正常卵巢组,差异均有统计学意义(分别P=0.026,P=0.006),而卵泡膜细胞瘤组与正常卵巢组的表达差异无统计学意义(P=0.313),支持-间质细胞瘤组与正常卵巢组、卵泡膜细胞瘤组、颗粒细胞瘤组的表达差异均无统计学意义(P=0.060,P=0.235,P=1.000),见表1。
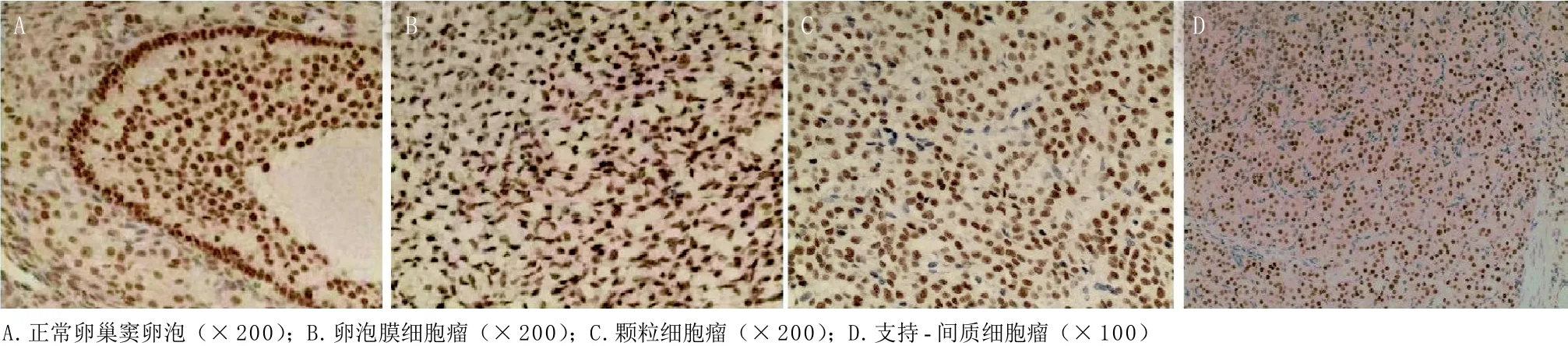
图1 GATA-4在正常卵巢及卵巢性索间质肿瘤中呈高表达的免疫组化染色
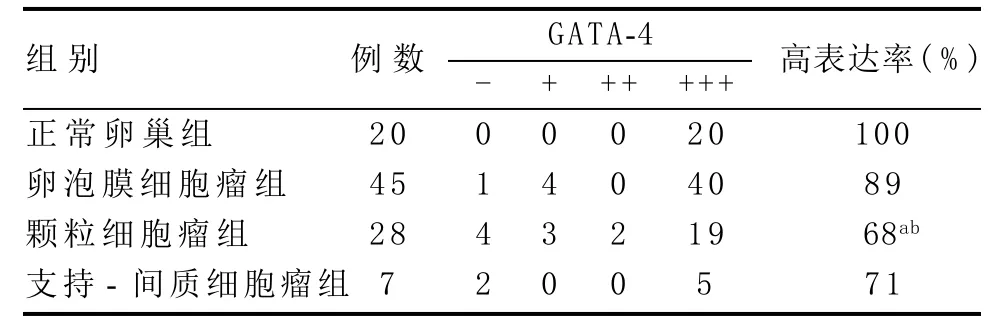
表1 正常卵巢及卵巢性索间质肿瘤中GATA-4的表达情况
2.2 不同临床分期的颗粒细胞瘤中GATA-4的表达情况 临床上,Ia期与Ic期及以上期别的卵巢颗粒细胞瘤治疗方法不同,因此,本实验分成两组进行统计学分析:①Ia期组;②Ic及III期组。Ia期组GATA-4的表达率高于Ic及III期组,差异有统计学意义(P=0.013),见表2。
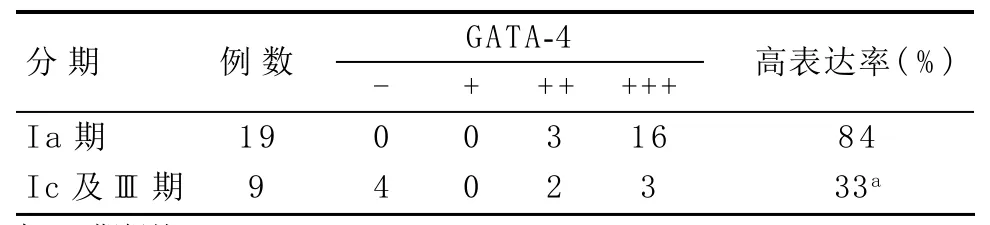
表2 不同临床分期的颗粒细胞瘤中GATA-4的表达情况
2.3 不同组织学类型的颗粒细胞瘤中GATA-4的表达情况 根据文献[5],将成人型颗粒细胞瘤分为两个亚型组:①分化型:包括小滤泡型、大滤泡型、缎带型、小梁型、岛状型及这些类型混合型;②弥漫型(即肉瘤样型)。两组比较,GATA-4的表达差异无统计学意义(P=1.000),见表3。
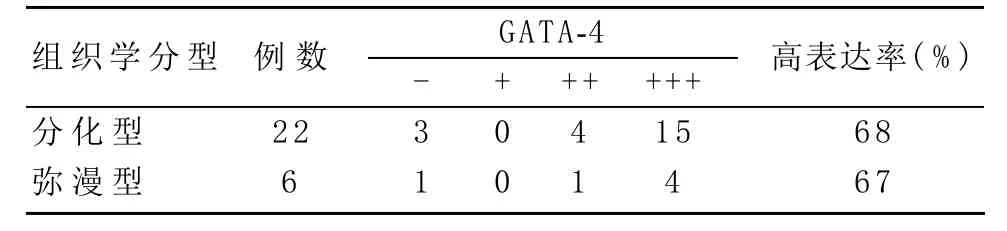
表3 不同组织学类型的颗粒细胞瘤中GATA-4的表达情况
3 讨论
1993年Arceci等[6]通过筛查小鼠胚胎cDNA文库首次克隆出小鼠GATA-4 cDNA,1995年Huang等[7]通过筛查人类心脏cDNA文库首次克隆出GATA-4 cDNA,以后相继在人类肺脏、肝脏、小肠、睾丸及卵巢等器官中检测到GATA-4 mRNA和蛋白的表达。GATA-4转录因子与生殖系统的关系非常密切,参与了性别分化、类固醇激素的合成与调节、生殖激素的调节,及颗粒细胞分化与凋亡的调节[2-4,8-9]。在人类卵巢的颗粒细胞、卵泡膜细胞和黄体中都检测到GATA-4 mRNA[10-12]。
卵巢性索间质类肿瘤相对少见,其生物学行为和临床经过一般呈良性或者低度恶性,其中,颗粒细胞瘤容易远期复发和转移,呈低度恶性;中、低分化的支持-间质细胞瘤表现为恶性生物学行为;其他大部分肿瘤均为良性[1]。
本研究中,GATA-4在正常卵巢窦卵泡的性索间质细胞中均呈高表达,与文献[2-4]报道一致,提示GATA-4的高表达是正常卵巢性索间质细胞分化成熟的一个标记。GATA-4在大部分的卵泡膜细胞瘤、颗粒细胞瘤及支持-间质细胞瘤中呈高表达,颗粒细胞瘤组的表达低于卵泡膜细胞瘤组及正常卵巢组,差异均有统计学意义(P<0.05),而卵泡膜细胞瘤组与正常卵巢组的表达差异无统计学意义(P>0.05),表明在分化程度高的肿瘤中GATA-4的表达高于分化程度低的肿瘤,GATA-4的表达可能与肿瘤的生物学行为有关,在肿瘤的分化表型中起作用,GATA-4在颗粒细胞瘤中的表达降低可能代表了肿瘤细胞的分化障碍,结合文献报道GATA-4在卵泡闭锁及排卵后表达显著降低,而在即将排卵前表达达到最高[10-12],提示GATA-4的表达与颗粒细胞分化能力保持同步,说明部分颗粒细胞瘤瘤细胞有分化障碍,与该肿瘤属于低度恶性相符合。此外,不同临床分期,GATA-4的表达差异有统计学意义(P<0.05),Ia期组高于Ic及III期组,提示肿瘤侵袭行为越高,瘤细胞的分化障碍越显著。然而有研究表明GATA-4的高表达与Ic及以上期别相关,GATA-4的高表达可作为具有较高侵袭行为的颗粒细胞瘤的一种标记[5],与本实验结果相反,考虑可能由于抗体克隆号不同引起。此外,在不同组织学类型的颗粒细胞瘤中,GATA-4的表达差异无统计学意义(P>0.05),表明组织学类型不能代表肿瘤细胞的分化程度,与文献[13]报道一致。本实验中,支持-间质细胞瘤组GATA-4的表达略低于正常卵巢组及卵泡膜细胞瘤组,略高于颗粒细胞瘤组,但差异均无统计学意义(P>0.05)。
总之,本研究结果表明GATA-4的高表达是正常卵巢性索间质细胞分化成熟的一个标记,且在卵巢性索间质肿瘤的分化表型中起作用,与肿瘤生物学行为可能有关。GATA-4在卵巢颗粒细胞瘤中的表达降低可能代表了肿瘤细胞的分化障碍,且GATA-4的表达与临床分期有关,而目前临床分期是指导颗粒细胞瘤治疗和预测预后最重要的因素[13],因此,检测GATA-4的表达可能有助于判断卵巢性索间质肿瘤生物学行为,指导卵巢颗粒细胞瘤的治疗及预测预后。
[1] Haines M, Jackson I. Granulosa-cell tumor of the ovary[J].J Obstet Gynaecol Br Emp,1950,57(5):737-746.
[2] Laitinen MP, Anttonen M, Ketola I, et al. Transcription factors GATA-4 and GATA-6 and a GATA family cofactor,FOG-2, are expressed in human ovary and sex cord-derived ovarian tumors[J]. J Clin Endocrinol Metab,2000,85(9):3476-3483.
[3] Chu S, Rushdi S, Zumpe ET, et al. FSH-regulated gene expression profiles in ovarian tumours and normal ovaries[J].Mol Hum Reprod,2002,8(5):426-433.
[4] 景彩霞, 杨加周, 艾庆燕,等. GATA 家族与生殖[J]. 中华男科学杂志, 2009,15 (10): 932-936.
[5] Anttonen M, Unkila-Kallio L, Leminen A, et al. High GATA-4 expression associates with aggressive behavior, whereas low anti-Müllerian hormone expression associates with growth potential of ovarian granulosa cell tumors[J]. J Clin Endocrinol Metab,2005,90(12):6529-6535.
[6] Arceci RJ, King AA, Simon MC, et al. Mouse GATA-4:a retinoic acid-inducible GATA-binding transcription factor expressed in endodermally derived tissues and heart[J]. Mol Cell Biol,1993,13(4):2235-2246.
[7] Huang WY, Cukerman E, Liew CC. Identification of a GATA motif in the cardiac α-myosin heavy-chain-encoding gene and isolation of a human GATA-4 cDNA[J]. Gene,1995,155(2): 219-223.
[8] Nishida H, Miyagawa S,Vieux-Rochas M, et al. Positive regulation of steroidogenic acute regulatory protein gene expression through the interaction between Dlx and GATA-4 for testicular steroidogenesis[J]. Endocrinology, 2008,149(5):2090-2097.
[9] Kwintkiewicz J, Cai Z, Stocco C. Follicle-stimulating hormone-induced activation of GATA-4 contributes in the upregulation of Cyp19 expression in rat granulosa cells[J].Mol Endocrinol, 2007, 21(4):933-947.
[10]Silverman E, Eimerl S, Orly J. CCAAT enhancer-binding protein β and GATA-4 binding regions within the promoter of the steroidogenic acute regulatory protein (StAR)gene are required for transcription in rat ovarian cells[J]. J Biol Chem,1999,274:17987-17996.
[11] Vaskivuo TE, Anttonen M, Herva R, et al. Survival of human ovarian follicles from fetal to adult life: apoptosis,apoptosis-related proteins, and transcription factor GATA-4[J]. J Clin Endocrinol Metab, 2001, 86(7):3421-3429.
[12]Gillio-Meina C, Hui YY, LaVoie HA. GATA-4 and GATA-6 transcription factors: expression, immunohistochemical localization, and possible function in the porcine ovary[J].Biol Reprod,2003,68(2):412-422.
[13] Miller BE, Barron BA, Wan JY, et al. Prognostic factors in adult granulosa cell tumor of the ovary[J]. Cancer, 1997, 79(10):1951-1955.

