白灵菇原生质体制备与再生研究
刘文芳,郭成金
(天津师范大学 生命科学学院,天津 300387)
白灵菇原生质体制备与再生研究
刘文芳,郭成金
(天津师范大学 生命科学学院,天津 300387)
借助正交设计法对白灵菇原生质体制备与再生进行研究.结果表明,原生质体最佳制备体系是:液体静置培养7d的菌丝体,在20g/L的溶壁酶作用下,以0.6mol/L蔗糖为渗透压稳定剂,28℃酶解2h,最高制备率为1.34×107个/mL;其最佳再生体系是:以液体静置培养7d的菌丝体,0.6mol/L MgSO4·7H2O为渗透压稳定剂,在15g/L溶壁酶与10g/L蜗牛酶作用下,34℃酶解3h,最高再生率为3.7%.
白灵菇;正交设计;原生质体;制备;再生
白灵菇(PleurtusnebrodensisLnzenga)隶属于真菌界、担子菌门、层菌纲、伞菌目、侧耳科、侧耳属,又名阿魏蘑[1-2].白灵菇为掌状白阿魏蘑的商品名,多生于伞形花科的草本植物上[3].它营养丰富,有调节人体生理平衡、增强人体免疫功能的功效[4].
近年来,原生质体技术已作为研究蕈菌生理、生化、遗传等基础理论和改良菌种的一种重要方法和有效手段[5].有学者[6-7]已用单因素实验对白灵菇原生质体制备及再生有一定的研究,得到了高的制备率,但再生率都不高.故作者借鉴前人[6-7]的研究,采用正交实验系统地研究了白灵菇原生质体制备与再生条件,希望得到高的再生率及优良的再生菌株,为今后对白灵菇原生质体融合、基因工程、发酵工程研究带来有益的支持,为中医药业、食品加工业的开发利用,保健品、抗癌药物的深层挖掘提供支持.
1 材料与方法
1.1 材料
北京房山白灵菇(PleurotusnebrodensisLnzenga):天津师范大学生命科学学院蕈菌研究所保藏菌种.
综合培养基(质量分数):马铃薯20%、棉籽皮20%、葡萄糖2%、KH2PO40.3%、MgSO4·7H2O 0.15%、VB10.004%、琼脂1.6%,pH 自然[2].
液体培养基(质量分数):马铃薯20%、葡萄糖2%、酵母粉0.3%、蛋白胨0.2%、KH2PO40.3%、MgSO4·7H2O 0.15%、VB10.001%,pH 自然[8].
RM(质量分数):液体培养基+琼脂0.8%,以0.6mol/L甘露醇配制,对照以蒸馏水配制[9].
1.2 方法
白灵菇菌丝体与相应渗稳剂混合,离心去除培养基,加无菌相应酶液,在相应温度下酶解相应时间;经无菌滤网过滤,离心得沉淀,溶于适量渗稳剂中,得到纯化的原生质体悬液.显微镜下观察计数,计算制备率.
调整悬液浓度至105个/mL,分别取0.2mL涂布RM和对照RM,记录再生情况,计算再生率.用L16(45)正交法分析诸因素对白灵菇原生质体制备与再生的影响,结果见表1.

表1 白灵菇原生质体制备与再生正交实验因素水平表Tab.1 Orthogonal experimental factors and levels for Pleurotusnebrodensis Lnzengaprotoplast preparation and regeneration
2 结果与分析
2.1 诸因素对原生质体制备的影响
诸因素对原生质体制备的影响见表2.据表2知:菌龄的R值最大,因此,影响白灵菇原生质体制备率的首要因素是菌龄;分析K值之间存在的差异可确定白灵菇原生质体制备最佳体系为7d菌龄的菌丝体,0.6mol/L蔗糖为渗稳剂,用20g/L溶壁酶,28℃酶解2h.该体系经3次验证,制备率达1.34×107个/mL,见图1.

表2 白灵菇原生质体制备与再生正交实验直观分析表Tab.2 Visual analysis of orthogonal experiment scheme of Pleurotusnebrodensis Lnzengaprotoplast preparation and reparation

图1 最佳制备条件下纯化的白灵菇原生质体(×400)Fig.1 Gained protoplasts under the optimal condition of Pleurotusferulae Lanzi(×400)
实验发现,在菌龄7d时,白灵菇原生质体的释放方式随着时间的变化可以同时观察到4种释放现象,见图2.首先在菌丝顶端部位形成结构简单的细胞壁,原生质体从细胞壁孔洞溢出;之后,菌丝渐渐变疏松,侧壁出现孔洞释放出原生质体;当大部分菌丝裂解成菌丝段时,在断裂部位又释放出原生质体;随着酶解时间延长,细胞壁彻底被酶解,发生质壁分离,在内外环境的压力下,原生质体从孔洞溢出,呈串珠排列在原位.原位释放尤为明显,这种方式释放的原生质体活性强,能更好地再生.整个过程在2h内完成.

图2 原生质体释放方式(原图放大倍数均为×400)Fig.2 Protoplast release(the amplificationfactor is×400of artwork)
2.1.1 酶条件
若用15g/L溶壁酶,则酶浓度过低,破壁困难,原生质体产量少,这与文献[6-7]的结果不同.适当提高酶浓度,有利于破壁.加入蜗牛酶和纤维素酶时,其成分与白灵菇菌丝细胞壁成分不吻合,不利于破壁,这与文献[9]得出的结果不同,因为不同菌丝的细胞壁组成成分不同,白灵菇为侧耳属真菌,其细胞壁成分是β-葡聚糖和几丁质,该研究使用的溶壁酶是含有这两种成分的复合酶,故使用20 g/L溶壁酶最佳.
2.1.2 渗稳剂
合适的渗稳剂浓度可使菌丝细胞保持生理状态的内外压动态平衡,使原生质体完好释放.渗稳剂的性质影响酶的活性,分离白灵菇原生质体,有机渗稳剂比无机渗稳剂效果要好.实验表明:0.6 mol/L蔗糖为白灵菇原生质体制备的最佳渗稳剂,这与文献[7]得出的结果一致.
2.1.3 酶解时间
随着酶解时间延长,菌丝逐渐解体,释放原生质体的速度加快,数量增多.酶解2h时,原生质体制备率最高;超过2h,酶活性降低,原生质体产量减少.
2.1.4 酶解温度
据表2知:28℃为白灵菇原生质体最适宜的酶解温度,这与李轶超等[6]得出的最佳温度为32℃不同,但与刘玉霞等[7]的结论相同,因为超过30℃时,酶易失活,菌丝易老化,原生质体易破裂.
2.1.5 菌龄
5d菌龄的菌丝较幼嫩,细胞壁成分简单,极易被降解,原生质体产量少,有别于文献[7],该研究增加菌龄至7d.菌龄超过7d后,菌丝细胞壁上容易沉积色素等次生物质,酶的作用减弱,原生质体产量减少,故最佳菌龄为7d.
2.2 诸因素对原生质体再生的影响
实验采用L16(45)正交法研究诸因素对原生质体再生的影响.据表2知:酶条件的R′值最大,是影响白灵菇原生质体再生的首要因素.分析K′值之间的差异,确定白灵菇原生质体的最佳再生体系是,用7d菌龄的菌丝体,0.6mol/L MgSO4·7H2O为渗稳剂,15g/L溶壁酶与10g/L蜗牛酶组合酶解,34℃酶解3h.经3次验证实验,再生率达3.7%,高于文献[6-7],见图3.
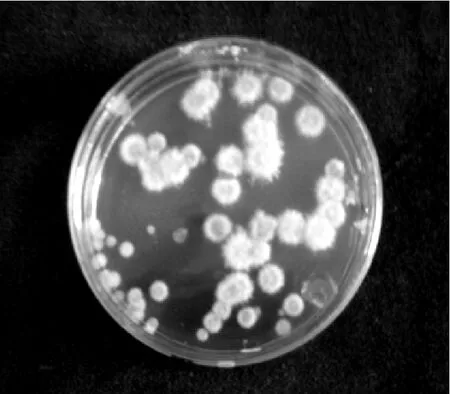
图3 白灵菇原生质体最佳再生状况Fig.3 Pleurtusnebrodensis protoplasts regeneration
2.2.1 酶条件
实验使用15g/L溶壁酶与10g/L蜗牛酶酶解时,原生质体再生率最高.这与之前制备的最佳酶条件不同,因为适合原生质体分离的酶条件,不一定适合其再生,酶浓度过高,导致酶解对细胞过于强烈,对原生质体有损伤.而与文献[6-7]所用的酶组合也不同,溶壁酶与蜗牛酶组合效果最佳.
2.2.2 渗稳剂
实验发现:0.6mol/L MgSO4·7H2O可促进白灵菇原生质体细胞壁再生,形成菌丝.这不同于文献[6-7]指出的甘露醇和蔗糖利于白灵菇原生质体再生,因为对某种特定蕈菌原生质体再生体系而言,选择其渗稳剂,既要考虑有利于原生质体的稳定又要兼顾有利于细胞壁形成和细胞器及超分子复合物功能的修复.不同种性的大型高等真菌其细胞的渗透势不同,所选择的渗稳剂也应不同,无机渗稳剂是否通过提供利于白灵菇原生质体存活和再生的离子进而促进了白灵菇原生质体细胞壁再生还有待进一步研究.
2.2.3 酶解时间
酶解1~2h时,大多数为菌丝片段,原生质体数量不足,难以再生;酶解3h时,原生质体多为非尖端菌丝细胞释放,产生的原生质体结构功能较为完整,原生质体再生率最高.
2.2.4 酶解温度
原生质体再生需要一定的细胞壁残余物作为再生引物,而酶解温度较高时,细胞壁的合成完全,有利于再生.白灵菇原生质体的再生率随温度的升高而升高,34℃时达到最高值.
2.2.5 菌龄
7d菌龄的菌丝释放的原生质体活性较高,基本都有核,易于再生复原;小于或大于7d菌龄则菌丝细胞或过于幼嫩或已老化,不易被酶解,因此原生质体活力弱,再生率低.
原生质体在再生培养基上生长6~7d,形成透明突起时开始计数;7~10d时,菌落扩大,边缘整齐,数目增加;10~15d后菌落颜色变白,数目不再增加,边缘呈辐射状,见图4.
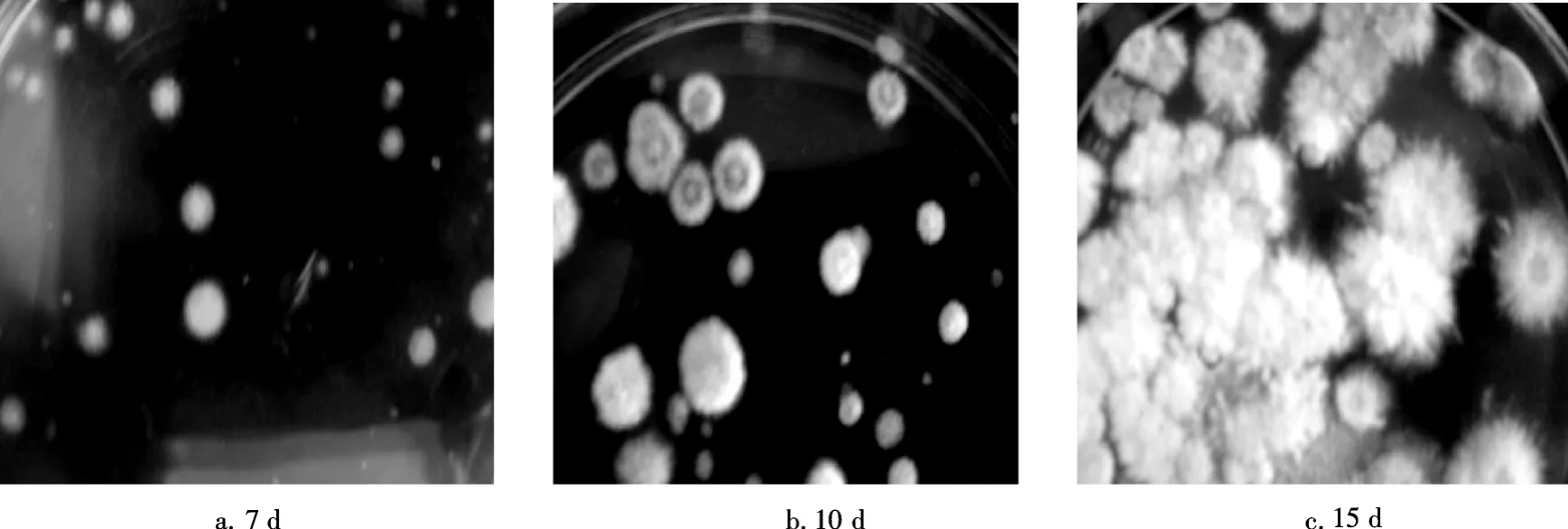
图4 白灵菇原生质体生长过程Fig.4 Protoplasts regeneration of Pleurotusferulae
3 结论
白灵菇原生质体制备及再生最佳制备体系是:以7d菌龄的菌丝体,0.6mol/L蔗糖为渗稳剂,在20g/L溶壁酶作用下,28℃酶解2h,制备率达1.34×107个/mL;最佳再生体系是:液体培养7d的菌丝体,0.6mol/L MgSO4·7H2O 为渗稳剂,在15g/L溶壁酶与10g/L蜗牛酶作用下,34℃酶解3h,再生率为3.7%.得到的原生质体再生率比前人[6-7]得到的高2倍,这将为白灵菇原生质体技术深入研究提供有益的支持.
在原生质体制备过程中观察到4种释放现象.
[1] 黄年来,吴经伦,陈忠纯,等.18种珍稀美味食用菌栽培[M].北京:中国农业出版社,1997:17-18.
[2] 郭成金.蕈菌生物学[M].天津:天津科学技术出版社,2005:144-146.
[3] 刘生学.白灵菇的生物学特性及栽培技术要点[J].甘肃农业科技,2002(10):34-35.
[4] 郑明耀.白灵菇遗传转化体系的建立 [D].广州:华南农业大学,2006:15-17.
[5] 杨新美.食用菌研究法[M].北京:中国农业出版社,1998:200-217.
[6] 李轶超,马淑凤,李书倩,等.白灵菇原生质体制备与再生的研究[J].食用菌,2006(2):10-13.
[7] 刘玉霞,王谦,陈瑞玲,等.白灵菇原生质体制备及再生的研究[J].食用菌,2009(4):24-25.
[8] 张长青,王红英,张建民,等.适宜白灵菇菌丝生长条件的研究[J].特产研究,2003(4):12-14.
[9] 郭成金,杨子美.槐耳原生质体制备与再生研究[J].天津师范大学学报:自然科学版,2010,30(4):63-66.
Study on protoplast preparation and regeneration ofPleurtusnebrodensisLnzenga
LIUWen-fang,GUOCheng-jin
(College of Life Science,Tianjin Normal University,Tianjin 300387,China)
The conditions of preparing and regenerating ofPleurtusnebrodensisLnzengaprotoplasts were studied through orthogonal design experiments.The results showed that the optimal preparing conditions ofPleurtusnebrodensisLnzengaprotoplast were 7-day-old mycelium cultured in static liquid,using 20g/L Lywallzyme,applying 0.6 mol/L sucrose for osmotic pressure stabilizer,digesting at 28℃for 2hours.And protoplast achieved 1.34×107/ml.Protoplasts produced in the conditions of 7-day-old mycelium cultured in static liquid,applying 0.6mol/L Mg-SO4·7H2O for osmotic pressure stabilizer,using 15g/L Lywallzyme and 10g/L Snailase,digesting at 34℃for 3 hours were optimal to regeneration.And the regeneration rate was 3.7%.
PleurtusnebrodensisLnzenga;orthogonal design;protoplast;preparation;regeneration
S646.1+4
A
1671-1114(2012)01-0088-05
2011-05-14
刘文芳(1986—),女,硕士研究生.
郭成金(1952—),男,教授,主要从事植物细胞营养及蕈菌生物学方面的研究.
(责任编校 纪翠荣)

