不同强度耐力运动训练对大鼠心肌细胞ATP敏感性钾通道表达的影响
彭峰林 ,张 林 ,郭艳菊 ,莫伟彬 ,廖慧萍
不同强度耐力运动训练对大鼠心肌细胞ATP敏感性钾通道表达的影响
彭峰林1,2,张 林3,郭艳菊1,莫伟彬1,廖慧萍1
目的:探讨不同强度耐力运动训练对大鼠心肌ATP敏感性钾通道表达的影响。方法:40只雄性SD大鼠,随机分为对照组、大强度组、中强度组和小强度组。建立大鼠运动模型,采用RT-PCR技术与Western blot技术,检测大鼠心肌KATP各亚基的表达。结果:RT-PCR结果显示,大强度组和中等强度组Kir6.1的基因表达明显高于对照组;大强度组、中等强度组及小强度组Kir6.2的基因表达显著高于对照组;大强度组、中等强度组及小强度组SUR2的基因表达均显著高于对照组;在大鼠心肌组织中未能检测到SUR1的基因表达。Western blot结果与PCR结果基本相同,但小强度组Kir6.1蛋白表达也明显高于对照组。结论:各种强度的长期耐力运动训练可增加KATP的表达。
耐力运动;大鼠;心肌细胞;ATP敏感性钾通道;基因表达;蛋白表达
ATP敏感性钾通道(ATP sensitive potassium Channel,KATP)是由Noma于1983年利用膜片钳技术在豚鼠心室肌上首先发现的[1],随后证实KATP在缺血再灌注过程中对心肌具有保护作用。KATP包括肌膜KATP通道(sarc-KATP)和线粒体KATP通道(mito-KATP),sarc-KATP存在于细胞膜上,由内向整流钾通道(Kir)和磺酰脲受体(SUR)组成。mito-KATP存在于线粒体内膜,但 mito-KATP的结构尚未完全清楚。目前已克隆两个内向整流亚单位Kir6.1、Kri6.2和三个磺脲类亚单位SUR1、SUR2A和SUR2B。在短时间缺血时sarc-KATP开放可引起心脏保护效应[2],mito-KATP可能是缺血预适应(IPC)的终末效应器[3]。为了探索不同强度运动训练对心肌细胞KATP表达产生的影响,本研究设计了实验方案,从基因表达水平及蛋白表达水平来检测不同强度耐力训练对大鼠心肌KATP亚基表达的影响,与以往研究不同处在于,本研究既设计了不同强度的运动训练方案,同时检测了KATP各亚基的基因表达和蛋白表达变化,这将为进一步探索KATP在心肌运动适应性变化中的作用和机理提供充实的依据。
1 材料与方法
1.1 实验动物及分组
11周龄Sprague-Dawley雄性大鼠40只(上海斯莱克实验动物有限任公司提供),随机分为大、中、小3个运动负荷组和对照组。饲养条件:动物房维持在温度(22±2)℃,湿度 60%±%5,每日照明12 h,自由进食饮水,喂养饲料采用国家标准固体混合饲料,大鼠自由饮水进食。
1.2 实验方法
1.2.1 训练方法 跑台训练8周,第1周为适应性训练,每周训练6天,每天训练60 min。依据Bedford[4]的研究结果制定运动负荷,大强度组:坡度 10°,速度 26.8 m/min,相当于最大耗氧量92.3%±2.8%;中等强度:坡度 5°,速度 15.2m/min,相当于最大耗氧量 64.0%±4.5%;小强度组:坡度 0°,速度 8.2m/min,相当于最大耗氧量52.9%±3.1%。对照组不做任何训练,常规饲养,自由活动。在末次训练结束后24 h进行动物急性处理,采样并测试。1.2.2 心肌组织KATP基因表达的测定 心尖部位无菌操作取100 mg心肌,Trizol试剂盒提取心肌总RNA,操作方法同试剂盒(RNAisoTM Plus,Takara)说明书,将提取出的RNA于-20℃保存。测OD值计算RNA含量,RNA电泳,紫外灯下可显示清晰的28S、18S两个条带,5S条带亦可见。
PT-PCR反应条件:95℃预变性3 min,95℃变性20 s,55℃退火20 s,72℃延伸30 s,35个循环,最后72℃延伸5 min。贮存于4℃。
引物(由金思特南京科技有限公司合成),dsGAPDH(432 bp):上游引物为 5′-ACCACAGTCCATGCCATCAC-3′;下游引物为 5′-TCCACCACCCTGTTGCTGTA-3′。Kir 6.1(209 bp):上游引 物 为 5′GAGTGAACTGTCGCACCAGA3′; 下 游 引 物 为 5′CGATCACCAGAACTCAGCAA3′。Kir6.2(167 bp):上游引物为 5′TCCAACAGCCCGCTCTAC3′;下游引物为 5′GATGGGGACAAAA CGCTG3′。SUR1(210bp):上游引物为 5′GGAGCAATCCAGACC AAGAT3′;下游引物为 5′Reverse:AGCCAGCAGAATGATGACA G 3′。SUR2(231 bp):上游引物为 5′ACACGCTCCGCTCTAGAC TG3′;下游引物为 5′GCCAGGCAGAACAGCTGTCT3′。
扩增产物检测。应用1.2%琼脂糖凝胶进行电泳分析,电泳后使用βandScan4.0软件对目的条带进行光密度分析,所得数值与相应β-actin光密度的比值即为mRNA的相对含量。
1.2.3 心肌组织KATP蛋白表达的测定 制备样品蛋白:取新鲜心肌标本以生理盐水充分冲洗,置液氮速冻后-80℃保存。把组织剪切成细小的碎片,裂解液裂解,冰上匀浆,至充分裂解。离心,取上清-20℃保存。
电泳:安装电泳槽,配制15%SDS-PAGE分离胶,灌胶,封胶。配制5%的浓缩胶,灌胶,上梳,填满空隙,放置30 min,去离子水洗涤。放入电泳槽,倒入电泳缓冲液,加样品,样品在沸水中煮沸,每井10 μL。80 V 20 min后调至120 V电泳1 h左右,至溴酚蓝跑出胶板。染色4 h,脱色5 h。
免疫印迹:将凝胶移至盛有水的平皿中,浸洗3次,转移至电泳缓冲液中,室温浸泡3 h。准备NC膜,滤纸,NC光面向上,凝胶置于其上,放入电转移槽。14V,100 mA,转印2 h。封闭过夜。NC 置于单克隆抗体 mouse-anti-Kir6.1/Kir6.2/SUR2(1:300)液中,缓摇2 h。PBS/T洗膜3次,每次15 min,将NC置于1:2000 稀释的 goat-anti-mouse IgG,室温缓摇 2 h。PBS/T 洗膜 3次,每次10 min,将NC置于DAB底物中反应着色拍照。
结果半定量:以 β-actin 代替 mouse-anti-Kir6.1/Kir6.2/SUR2重复免疫印迹实验,在底片上得到内参β-actin的条带。图像分析系统扫描条带灰度值,用底片上mouse-anti-Kir6.1/Kir6.2/SUR2条带的灰度值与内参β-actin条带的恢度值的比值半定量分析的 Kir6.1/Kir6.2/SUR2 表达量。
1.3 数据分析
采用SPSS 12.0统计软件进行统计学分析,计量资料均以平均数±标准差(±S)表示。采用单因素方差分析及多重比较,以 P<0.05为有显著性差异,以P<0.01为有非常显著性差异。
2 结 果
2.1 耐力运动对KATP亚基在转录水平的影响
RT-PCR后比较KATP各亚基与GAPDH基因表达的比值,大强度组和中等强度组的Kir6.1的基因表达明显高于对照组(P<0.01);大强度组、中等强度组及小强度组的Kir6.2的基因表达显著高于对照组(P<0.05 或 P<0.01);大强度组、中等强度组及小强度组的SUR2的基因表达均显著高于对照组(P<0.05或P<0.01);在大鼠心肌组织中未能检测到SUR1的基因表达(见图1)。

图1 各组大鼠心肌细胞KATP亚基基因表达(GAPDH为内参),Hig:大强度组;Mid:中强度组;Low:小强度组;Con:对照组Fig.1 Relative expression levels of KATP subunits Kir6.1,Kir6.2 and SUR2 mRNA in myocardial cells in different groups.▲P<0.05,▲▲P<0.01,vs control group.
2.2 耐力运动对KATP亚基在翻译水平的影响
Western blot实验蛋白电泳结果见图2,比较KATP各亚基与β-actin条带的灰度比值,发现小强度组、中等强度组和大强度组 Kir6.1 的蛋白表达明显高于对照组(P<0.05);大强度组、中等强度组及小强度组Kir6.2的蛋白表达非常显著高于对照组(P<0.01);大强度组、中等强度组及小强度组SUR2的基因表达均显著高于对照组(P<0.05 或 P<0.01),以中等强度组 SUR2 表达值最高。
3 分析与讨论
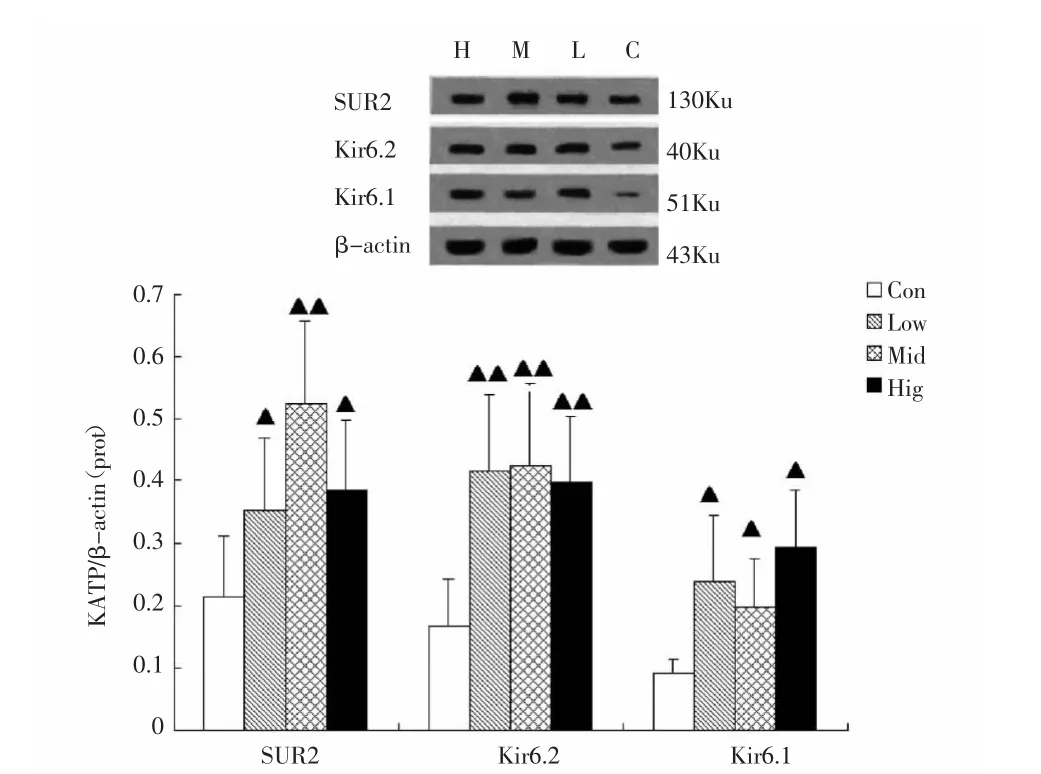
图2 各组大鼠心肌细胞KATP亚基蛋白表达。Hig:大强度组;Mid:中强度组;Low:小强度组;Con:对照组Fig 2 The expression of KATP subunits protein in different groups rat myocardial cells.
KATP属于内向整流钾通道超家族的一种,通道的开闭直接受到胞内[ATPi]/[ADPi]的影响,被认为是一种与细胞代谢状态密切相关的配体门控型离子通道。KATP最早发现于心肌细胞[1],随后又陆续在平滑肌细胞、胰腺p细胞等外周细胞发现了KATP的表达。研究表明:KATP是由Kir和ATP结合蛋白按1∶1组成的四聚体,而组成KATP的Kir和SUR具有组织特异性。在不同组织,KATP的表达呈现多样性,已有报道证实在心肌、胰腺表达的KATP亚型结构各不相同,并且通过药理学、生物物理学手段检测出的功能也不尽相同。现在认为胰腺β细胞和大脑神经细胞KATP由kir6.2和SUR1组成,心肌和骨骼肌KATP由kir6.2和SUR2A组成,肾脏KATP由kir1.1和CFTR组成,平滑肌KATP为Kir6.2和SUR2B组成[5~7]。KATP不仅存在于细胞膜上,也存在于线粒体膜上。1991年,INOUE在大鼠肝线粒体内膜记录到KATP的存在,虽然mito-KATP通道亚基组成已有几个研究小组进行了深入研究,但此通道的分子结构仍存在争议。SUZUKI等1997年报道大鼠心肌mito-KATP含有Kir6.1[8]。2003年LACZA和SINGH的研究小组报道大鼠和小鼠心肌线粒体中有Kir6.1和Kir6.2亚基的表达[9,10],另有研究报道,Kir6.1和Kir6.2都不是家兔和小鼠心肌细胞mito-KATP通道的组成部分[11-12]。至于磺脲类受体(SUR)亚基,2003年SINGH[10]在大鼠心肌中检测到SUR2A,但LACZA等[12]在小鼠心肌细胞线粒体中既没发现SUR1也没发现SUR2,表明mito-KATP不仅有组织特异性,还有种属特异性。DANG VAN CUONG等[13]采用荧光检测技术和Western blot分析方法研究了大鼠心肌细胞mito-KATP的分子组成,认为mito-KATP通道亚单位包括Kir6.1、Kir6.2和SUR2,不包含SUR1。基于mito-KATP分子组成尚没有形成统一认识,所以本研究采用RTPCR技术和Western-blot技术分别在转录水平和翻译水平检测KATP四个亚基在大鼠心肌中的表达,首次探索不同强度的耐力运动对KATP各亚基表达的影响。
本研究结果显示:无论是转录水平还是翻译水平,均出现了Kir6.1、Kir6.2、SUR2的表达,但没有检测到SUR1的表达,表明大鼠心肌细胞KATP通道的亚单位为Kir6.1、Kir6.2、SUR2。结果证实了Dang Van Cuong等[13]的研究结论。另外研究发现:高、中、低强度的耐力运动训练均可以促进大鼠心室肌Kir6.1、Kir6.2、SUR2的表达。有研究报道过一次性反复力竭运动对大鼠心肌Kir6.1表达的影响,结果显示两种运动情形下,心室肌Kir6.1的表达均显著增加[14],而运动对心肌KATP另两个亚基表达的影响的研究少见报道,更没有系统研究不同强度运动训练对KATP表达影响的差异,运动训练提高心室肌KATP亚基表达的机理也缺乏深入研究。根据本研究的结果,并结合运动训练对心肌细胞代谢、内分泌及神经调控的影响,推测运动可能通过下列途径影响KATP的表达:其一,长时间耐力运动可以引起血糖水平的下降和肌糖原含量的下降,而能源底物浓度的降低可通过一些细胞内信号机制促进KATP亚基的表达[15,16]。其二,运动训练中大鼠心脏血流动力学发生明显改变,血流动力学的改变参与了AngⅡ表达的调节。研究发现,AngⅡ参与了KATP通道亚基表达的调节。AngⅡ是RAS中的一个组成成分,局部RAS调节了KATP亚基的表达[17]。其三,运动训练中应激激素水平的升高,会通过多条途径诱导KATP表达的增加[18]。其四,运动过程中心肌的相对缺血或绝对缺血会诱导KATP表达的增加[19]。
心肌KATP在正常生理情况下并不开放,当心肌缺血、缺氧、能量匮乏时,KATP开放以保护心肌。KATP通道的净活力是由细胞内的KATP通道数量和开放程度决定的,运动训练促进心肌细胞Kir6.1、Kir6.2和SUR2表达的增加,表明KATP通道表达增加,KATP活力增加,这对于提高心肌的抗缺血再灌注损伤具有重要意义[20]。KATP可能通过如下机制介导缺血预适应。(1).减轻再灌注Ca2+超载,sarc-KATP通道开放导致细胞膜超极化,电压依赖性慢Ca2+通道关闭,Ca2+内流减少[21]。另外sarc-KATP通道开放致K+外流,复极加速,动作电位时程缩短,平台期内流Ca2+减少,Na+-Ca2+交换加强而排出胞质内的Ca2+。激活mito-KATP通道,进而激活 Na+/K+ATPase,减少 Na+内流和[Na+]i,减少 Na+-Ca2+交换,也能达到心肌保护的目的[22]。(2)减少心肌能量消耗。心肌细胞内Ca2+水平降低,致缺血心肌电机械活动抑制,心肌收缩力减弱,从而减少ATP的消耗[23]。(3)减少氧自由基的损伤,KATP通道可使缺血心肌的过氧化物释放减少[24]。有研究认为,mito-KATP通道在抗自由基方面可能有一个独立的信号传导途径[25-26]。(4)抑制心肌细胞凋亡。mito-KATP通道可通过影响一些凋亡调节机制达到抗凋亡的目的。mito-KATP开放,降低caspase-3及bax水平,抑制caspase-3的活化[27]。总之,不同强度的耐力运动训练能不同程度引起KATP表达的增加,提高KATP的活性,从而有利于对抗缺血再灌注损伤,但不同运动引起的心脏保护作用不一定完全相同,而且KATP在介导不同运动心脏保护作用的机制也可能不相同,这些尚需进一步深入研究。
[1]NOMA A.ATP-regulated K+channels in cardiac muscle[J].Nature,1983,305(5930):147-148.
[2]RODRIGO G C,STANDEN N B.ATP-sensitive potassium channels[J].Curr Pharm Res,2005,11(15):1 915-1 940.
[3]GROSS G J,AUCHAMPCH J A.Blockade of the ATP-sensitive potassiumchannels prevents myocardial preconditioningin dogs[J].Circ Res,1992,70(2):223-233.
[4]BEDFORD T G,TIPTON C M,WILSON N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1 278-1 283.
[5]KERR,SANSOM M S.Cation selectivity in ion channds[J].Nature,1995,373(6510):112.
[6]INAKAKI N,CONOI T,CLEMENTJ P,et al.Reconstitution ofIKATP:an inward rectifier subunit plus the sulfonylurea receptor[J].Science,1995,270(5239):1 166-1 170.
[7]INAGAKI N,CONOI T,CLEMENT J P,et al.A family of sulfonylurea receptors determines the pharmacological properties of ATP sensitive K+channels[J].Neuron,1996,16(5):1 011-1 017.
[8]SUZUKI M,KOTAKE K,FUJIKURAK,et al.Kir6.1:a possible subunit of ATP-sensitive K+channels in mitochondria[J].Biochem Biophys Res Commun,1997;241(3):693-697.
[9]LACAZ Z,SNIPES J A,KIS B,et al.Investigation of the subunit composition and the pharmacology of the mitochondrial ATP-dependent KCchannel in the brain[J].Brain Res,2003;994(1):27-36.
[10]SINGH H,HUDMAN D,LAWRENCE CL,et al.Distribution ofKir6.0 and SUR2 ATP-sensitive potassium channel subunits in isolated ventricular myocytes[J].J Mol Cell Cardiol,2003 35(5):445-459.
[11]SEHARASEYONJ,OHLER A,SASAKI N,et al.Molecular composition of mitochondrial ATP-sensitive potassium channels probed by viral Kir gene transfer[J].J Mol Cell Cardiol,2000;32(11):1 923-1 930.
[12]SUZUKI M,SASAKI N,MIKI T,et al.Role of sarcolemmal KATP channels in cardioprotection against ischemia/reperfusion injury in mice[J].J Clin Invest,2002,109(4):509-516.
[13]DAND VAN CUONG,NARI KIM,HYUN JOO,et al.Subunit composition of ATP-sensitive potassium channels in mitochondria of rat hearts[J].Mitochondrion,2005,5(2):121-133.
[14]廖兴林,常芸,景思明.一次性和反复力竭运动后不同时相大鼠心肌Kir6.1的表达[J].中国运动医学杂志,2008,27(5):556-559.
[15]ZHOUG,MYERSR,LI Y,et al.Role ofAMP-activated protein kinase in mechanism of metformin action[J].J Clin Invest,2001,108(8):1 167-1 174.
[16]HAWLEY S A,GADALLA A E,OLSEN G S,et al.The antidiabetic drug metformin activates the AMP-activated protein kinase cascade via an adenine nucleotide-independent mechanism[J].Diabetes,2002,51(8):2 420-2 425.
[17]AKAOM,SAKURAI T,HORIE M,et al.AngiotensinⅡtype 1 receptor blockade abolishes specific KATP channel gene expression in rat with myocardialischemia[J].J Mol Cell Cardiol,2000,32(12):2239-2247.
[18]XIE J,MCCOBB D P.Control of alternative splicing of potassium channels bystress hormones[J].Science,1998,280(5362):443-446.
[19]MASG,FUR F,FENGGQ,et al.Effect of G(alphaq/11)protein and ATP-sensitive potassiumchannels on prostaglandin E(1)preconditioning in rat hearts[J].Acta Pharmacol Sin,2004,25(5):587-592.
[20]LU C,HALVORESN S W.Channel activators regulate ATP-sensitive potassium channel ( KIR611)expression in chick cardiomyocytes[J].FEBS Let ters,1997,412(1):121-125.
[21]JOYEUX M,GODIN R D,RIBUOT C.Resistance to myocardiol infarction induced by heat stress and the effect of ATP-sensitive potassiumchannel blockade in the isolated rat heart[J].Br J Phamacol,1998,123(6):1 085-1 088.
[22]MIURA T,LIU Y,GOTO M,et a1.Mitochondrial ATP-sensitive K+channels play a role in cardioprotection by Na+-H+exchange inhibition against ischemin/reperfusion injury[J].J Am Coll Cardiol,2001,37(3):957-963.
[23]GROVER G J,SLEPH P G.Protective effect of K(ATP)openers in ischemic rat hearts treated with a potassium cardiplegic solution[J].J Cardiovasc Phamacol,1995,26(5):698-706.
[24]GROVER G J.Protective effects of ATP sensitive potassium channel openers in models of myocardial ischemia[J].Cardiovasc Res,1994,28(6):778-782.
[25]OACAN C,BIENENGRAEBER M,PETRAS P,et a1.Potassium channel openers protect cardiac mitochondria by attenuating oxidant stress at reoxygenafion[J].Am J Physiol Heart Circ Physiol,2002,282(2):H53l-H539.
[26]VANDEN HOCK T L,BECKER L B,SHAO Z,et al.Reactive oxygen species released from mitochondria during brief hypoxia induce preconditioning in cardio myocytes[J].J Biol Chem,1998,273(29):18 092-18 098.
[27]AKAO M,OHLER A,O'ROURKE B,et al.Mitochondrial ATP-sensitive potassium channels inhibit apoptosis induced by oxidative stress in cardiac cells[J].Circ Res,2001,88(12):1 267-1 275.
Effect of Different Intensity Endurance Exercise Training on the Expression of ATP-sensitive Potassium Channel in Rat’s Cardiomyocytes
PENG Fenglin1,2,ZHANG Lin3,GUO Yanju1,MO Weibin1,LIAO Huiping1
(1.School of PE,Guangxi Normal University,Guilin 541004,China;2.The Key Laboratory for the Chemistry and Molecular Engineering of Medicinal Resources,Guilin 541004,China;3.School of PE,Suzhou University,Suzhou 215006,China)
Objective∶To explore the effects of different intensity endurance exercise training on the expression of ATP sensitive potassium Channel(KATP)in cardiomyocytes of rats.Methods∶40 male SD rats were randomly divided into control group (n=10),high-intensity group (n=10),moderate-intensity group(n=10)and low-intensity group(n=10).To establish the running exercise models in rats,and detect the changes of the expression of KATP in control group and in the other three exercise groups after training by using the method of RT-PCR and Western blot.Results∶RT-PCR results showed that the gene expression of Kir6.1 in high-intensity group and the moderate-intensity group was significantly higher than control group.The gene expression of Kir6.2 in high-intensity group,the moderate-intensity group and low-intensity group was significantly higher than control group.The gene expression of SUR2 in high-intensity group,the moderate-intensity group and low-intensity group was significantly higher than control group.The gene expression of SUR1 was failed to detect in rat's cardiomyocytes.Western blot analysis was as same as PCR results,but Kir6.1 protein expression in low-intensity group was significantly higher than control group.Conclusions∶After long-time training,all intensity endurance running can increase the expression of KATP.
endurance exercise;rats;cardiomyocytes;ATP sensitive potassium channel;gene expression;protein expression
G 804.8
A
1005-0000(2012)02-093-04
2011-12-02;
2012-02-10;录用日期:2012-02-15
国家自然科学基金项目(项目编号:31060146);药用资源化学与药物分子工程教育部重点实验室资助课题(项目编号:CMEMR2011-02)
彭峰林(1969-),男,湖南双峰人,教授,博士,研究方向为运动适应的生物学机制。
1.广西师范大学体育学院,广西桂林541004;2.药用资源化学与药物分子工程教育部重点实验室,广西桂林541004;3.苏州大学体育学院,江苏苏州215006。

